Rubéole

INTRODUCTION/GÉNÉRALITÉ
- Virus à ARN ayant un sérotype unique de la famille des Togaviridae, genre Rubivirus, qui ne présente pas de réaction croisée avec d'autres togavirus.
- Infection virale commune de l’enfance, asymptomatique dans 50% des cas, et en règle générale bénigne.
- Les complications sont rares (atteinte articulaire, thrombopénie, atteinte neurologique) et la mortalité quasi nulle.
- Le principal problème posé par cette pathologie tient au risque de contamination fœtale en cas d’infection pendant la grossesse d’une femme non immunisée (potentiel tératogène).
- En 2005, la France s’est engagée avec les autres pays de la région Europe de l’OMS à éliminer la rougeole et la rubéole congénitale.
- La rubéole est devenue, en mai 2018, une maladie à déclaration obligatoire.
HISTORIQUE
A) Première description
- Elle a été décrite pour la première fois au milieu du XVIIIème siècle par des médecins allemands comme une forme bénigne de la rougeole 1 ou un hybride de la rougeole et de la scarlatine. La première description clinique très probable de rubéole est attribuée à un médecin allemand, Daniel Sennert en 1619, qui lui donne le nom de rötheln.1 Cet auteur inaugure toute une série de médecins allemands qui cherchent à individualiser la rubéole durant le XVIIIe siècle, dont Bergen (1752) et Orlow (1758).1 Les Anglais appellent encore parfois cette maladie German measles (rougeole allemande) pour l'opposer à la « vraie » rougeole ou English measles.
- En 1866, Henry Veale, médecin écossais servant aux Indes, publie une série de 30 cas en proposant le terme de rubella (diminutif de rouge en latin) « plus court à écrire et plus facile à prononcer ». Lors d'un Congrès international de médecine, tenu à Londres en 1881, un consensus majoritaire se dégage pour reconnaitre la rubéole comme entité indépendante. À cette occasion, l'anglais William Squire déclare qu'il a fallu du temps pour distinguer la variole de la rougeole, la scarlatine de la rougeole, et qu'il en faudra aussi pour reconnaitre unanimement que la rubéole n'est ni une forme de scarlatine, ni une forme de rougeole. 1
B) Études virologiques
- En 1914, Hence est le premier à postuler une origine virale à la rubéole1 alors que plusieurs auteurs de cette période annoncent la découverte de bactéries, travaux qui resteront non confirmés.
-
En 1938, Hiro et Tasaka démontrent que la rubéole est transmissible et due à un virus.
-
En 1961-1962, deux équipes américaines isolent le virus de façon indépendante : l'une à Boston (Harvard), l'autre à Washington (Walter Reed). La première, celle de Thomas Weller, détecte le virus à partir de cultures cellulaires utilisant des cellules amniotiques, mais le procédé est trop long. La seconde, celle de Paul Parkman, utilise des cellules de reins de singe.
-
En 1966, Parkman obtient une première souche atténuée de virus rubéolique.1
-
En 1967 un test sérologique diagnostic est mis au point.
-
En 1969, le premier vaccin vivant atténué est utilisé aux États-Unis.
C) Rubéole congénitale
- Jusqu'à la deuxième Guerre Mondiale, la rubéole a été considérée comme une maladie le plus souvent bénigne, sans conséquence pour l'enfant ou l'adulte.
- En 1939, lors de l'entrée en guerre de l'Australie, le regroupement des jeunes recrues crée les conditions d'une vaste épidémie de rubéole qui se transmet à leurs jeunes femmes. En 1940, Norman Gregg (1891-1966) chirurgien ophtalmologiste,1 voit arriver à son cabinet un nombre inhabituel de cataractes congénitales du nouveau-né ; il découvre que leurs mères ont eu la rubéole durant leur premier trimestre de grossesse.1 Il publie ces constatations en 1941, en décrivant un syndrome congénital associant cataracte et diverses autres anomalies (cardiaques, cérébrales, oreille interne),1 1 connu aussi sous le nom de syndrome de Gregg.
- Sa découverte reste méconnue ou accueillie avec scepticisme, car on ne pensait pas qu'une maladie aussi bénigne puisse provoquer des malformations aussi graves ; mais d'autres auteurs américains, suédois et britanniques confirment les observations de Gregg, et leur importance est mondialement reconnue en 1947 (parution d'un article dans le New England Journal of Medicine).
- En 1962-1963, une pandémie de rubéole démarre en Europe et s'étend aux États-Unis en 1964-1965, où elle prend des dimensions dramatiques avec plus de 20 000 cas de rubéole congénitale, dont des milliers de mort fœtale ou d'enfants nés sourds, aveugles ou retardés mentaux.1 1 Cette pandémie a été l'occasion de compléter le syndrome initial décrit par Gregg, et aussi d'accélérer la mise au point d'un vaccin.1 1
- Dans la perspective d’une élimination de la rubéole congénitale en France, le vaccin anti-rubéoleux a été introduit auprès des jeunes filles dès 1970, puis dans le calendrier vaccinal du nourrisson en 1983 en association avec la rougeole puis avec les oreillons trois ans plus tard (vaccin triple rougeole-oreillons-rubéole : ROR).
- En 2005, dans le cadre du plan d’élimination de la rougeole et de la rubéole congénitale en France 2005-2010, de nouvelles mesures vaccinales ont été préconisées avec notamment un rattrapage avec la vaccination triple de toutes les personnes nées à partir de 1980. Ces mesures devraient permettre d’augmenter la couverture vaccinale anti-rubéoleuse des femmes en âge de procréer.1
PHYSIOPATHOLOGIE
A) Pathogénie
- Réservoir naturel humain (l’homme est le seul hôte connu)
- Transmission :
- Directe : le virus de la rubéole se transmet par contacts inter-humains directs par par voie aérienne (sécrétions rhinopharyngées expulsées par les personnes infectées) favorisée par un contact répété et/ou prolongé.
- Indirecte : par contact des muqueuses avec des mains, des objets ou des surfaces fraîchement contaminés par des sécrétions d'un sujet infecté ou l'urine d'un nouveau-né atteint de rubéole congénitale très contagieux pour l'entourage car excrétant du virus pendant plusieurs mois.
- Infection materno-foetale : contamination transplacentaire, tératogène durant le premier trimestre de la grossesse, et la rubéole congénitale font toute la gravité d’une maladie par ailleurs bénigne.
- L'incubation est de 16 jours à 18 jours en moyenne (avec des écarts allant de 14 à 23 jours).
- La période de contagiosité dure pendant tout le portage
- Elle s’étend approximativement de 7 jours avant l’éruption à 14 jours après mais la contagiosité est maximale entre 5 jours avant et 6 jours après l’éruption. Il est donc très difficile, voire impossible, d’éviter la contamination d’une femme enceinte dans l’entourage d’un sujet infecté, même si la maladie de celui-ci est diagnostiquée dès le premier jour de l’éruption.
- chez les nouveau-nés atteints de rubéole congénitale, l'excrétion du virus se prolonge au moins 6 mois (notamment dans l'urine).
B) La structure du virus
Les Togaviridae sont une famille de virus contenant deux genres : Alphavirus, et Rubivirus.1 1
- Le genre Alphavirus comprenant plusieurs espèces de virus tel que le virus chikungunya, le virus de la forêt Barmah qui peuventt être la cause de maladie aussi bien chez l’humain que chez les animaux et sont toujours propagés par les insectes infectés, notamment les moustiques.
- Le genre Rubivirus, ne présente qu’un seul représentant : le virus de la rubéole. Ce virus ne comprend qu’un seul type antigénique. Il possède un caractère génétique très stable.1
La particule virale, sphérique,1 de 80 nanomètres de diamètre est constituée d’un génome, d’une capside icosaédrique et d’une enveloppe :
- Le génome est un ARN monocaténaire, linéaire, simple brin non segmentaire à polarité positive, de taille comprise entre 10 et 12 kbases.1, coiffé sur son éxtrimité 5’ et polyadynylé en 3’. Il code pour trois protéines structurales et deux protéines non structurales :
- Les protéines non structurales p150 et p90 sont impliquées dans la réplication du virus.
- Les protéines de structure sont formées de la protéine de la capside C et les deux glycoprotéines de l’enveloppe E1, E2. La protéine de la capside C est une protéine non glycosylée, mais phosphorylée. Elle assure diverses fonctions aussi bien dans la formation de la nucléocapside via sa liaison avec l’ARN génomique que dans son interaction avec les protéines membranaires. Sa liaison avec la protéine de l’hôte p32, une protéine de la matrice mitochondriale,1 peut avoir un effet capital sur la distribution des mitochondries et la réplication virale. La surexpression de la protéine p32 peut augmenter le pouvoir infectant du virus.1
- L’enveloppe virale est une bicouche lipidique dérivée de la membrane de la cellule infectée. Elle est entourée de spicules d’hémagglutinine de 6 à 8 nanomètres de long.1 L’enveloppe porte la glycoprotéine virale E1 qui permet l’interaction entre le virus et ses récepteurs cellulaires, et conditionne ainsi la fixation puis la pénétration du virus dans la cellule. Bien que le rôle de l’E2 ne soit pas totalement déterminé, les hétéro-dimères formés par E1et E2 peuvent eux aussi, jouer un rôle dans la réplication. En effet, la mutation dans le domaine transmembranaire d’E1, en altérant la formation de ce complexe E2/E1 altère la réplication.1 1
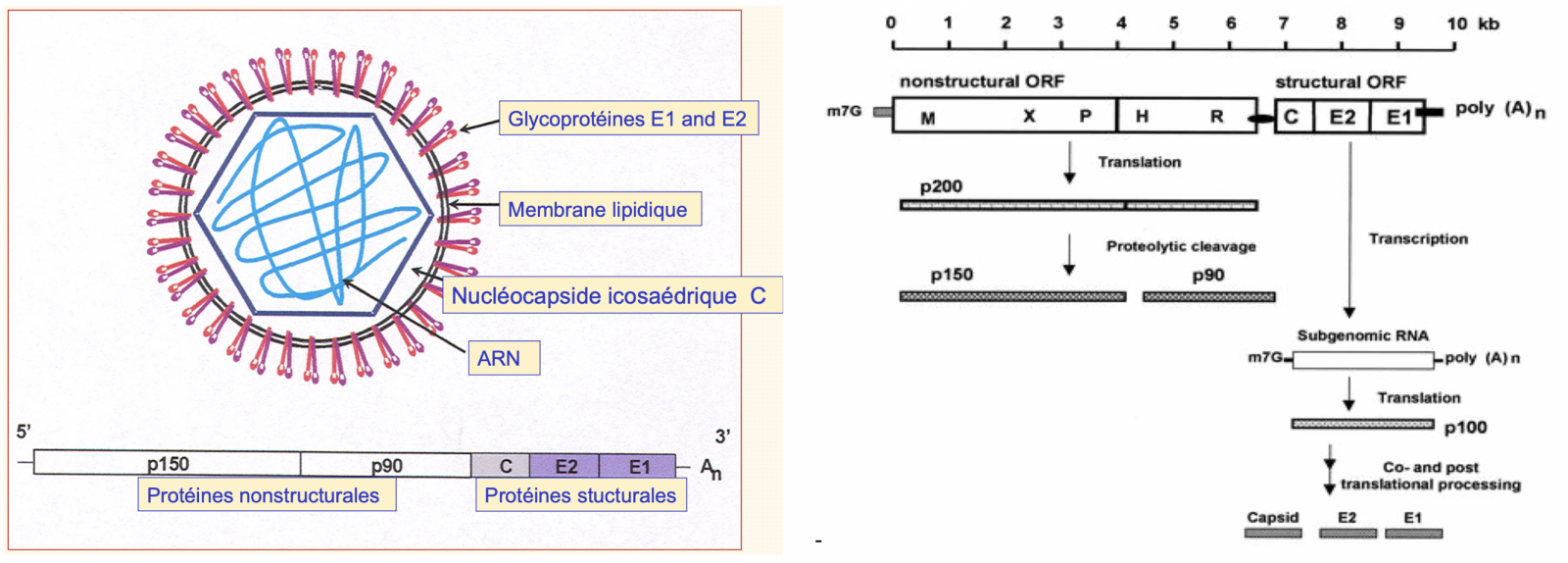
Image 2 : génome du virus
En 2005, une nomenclature systématique des génotypes des virus rubéoleux sauvages a été adoptée. 13 génotypes sont individualisés et se sont divisés en 2 groupes phylogénétiques majeurs, le clade 1 et le clade 2, qui montrent une différence de 8% à 10% au niveau des nucléotides. Actuellement, 3 des 13 génotypes définis (1E, 1G, 2B) ont une large distribution géographique, tandis que les autres apparaissent sporadiquement ou sont plus localisés géographiquement. 1Les différences antigéniques au niveau des épitopes sont mineures et l’immunisation avec un type du virus conduit à l’immunité contre tous les autres virus de la rubéole en circulation.1 1 1
C) Le cycle viral
La multiplication est intracytoplasmique, elle s’effectue en 6 étapes.

1) La fixation
- L’entrée du virus commence par la fixation du virus à son récepteur. Cela est le résultat d’une interaction des sites de liaisons portées par des glycoprotéines d’enveloppe E1, E2 avec les lipides membranaires de la cellule cible donc, des phospholipides et les glycolipides membranaires.1 Après cette reconnaissance, le virus va interagir avec le(s) récepteur(s) cellulaire(s). Les études récentes menées par des chercheurs chinois ont permis d’identifier une protéine transmembranaire comme récepteur de ce virus, la glycoprotéine myéline oligodendrocyte.1 C’est une glycoprotéine exprimée dans les neurones et les oligodendrocytes dans le SNC. Les oligodendrocytes sont des cellules qui ont un rôle essentiel dans la formation et la protection de la myéline et dans l’augmentation de la vitesse de propagation de l’influx nerveux.
2) La pénétration
- Le virus entre dans la cellule cible par endocytose. Dans les conditions normales, c’est-à-dire à un pH neutre, la protéine E2 couvre l’E1, cet hétéro-dimère devient inactif dans le virion mature. Cependant, l’attachement du virus à son récepteur va induire son endocytose et l’acidification de l’endosome entraînera un changement de conformation des protéines E2/E1. E2 se détache d’E1, ce qui exposera le peptide de fusion dans l’E1. Cette action favorise la fusion de l’enveloppe virale à la membrane de l’endosome. Le virus va ainsi expulser sa nucléocapside à l’intérieur du cytoplasme cellulaire.1 1
3) La réplication
- Cette étape est caractérisée par une réplication lente.1 Au sein de la cellule, le virus va synthétiser ses protéines virales et répliquer le génome viral. Contrairement au virus de la rougeole, ce génome ARN de polarité positive va servir tel quel de messager. L’ARN positif génomique est répliqué par l’ARN-polymérase-ARN- dépendante virale en une molécule d'ARN de polarité négative qui servira de matrice pour la synthèse de nouveaux génomes ARN de polarité positive. Ceux-ci pourront recommencer un cycle de traduction-réplication ou être encapsidés dans de nouveaux virions.
- Dans le cadre de la synthèse des virus à ARN à polarité positive, les protéines virales sont synthétisées sous forme de précurseurs, généralement un polypeptide de grande taille. Celui est ensuite clivé par les enzymes lytiques pour donner les protéines structurales et non structurales virales. Cependant, il existe une particularité chez la famille des Togaviridae, les protéines non structurales p90 et p150 sont directement traduites à partir d’une extrémité du génome parental. Les protéines structurales C, E1, E2 sont synthétisées par un ARN subgénomique (ARN+) représentant l’autre partie du génome synthétisé à partir d'une matrice ARN.1
4) L’assemblage et la libération
- La protéine C, une fois synthétisée, polymérise pour former la capside virale et incorpore une nouvelle copie de l’ARN génomique. La formation de la nucléocapside se déroule donc dans le cytoplasme. Alors que les protéines E1 et E2, formées à partir d’une poly protéine sont clivées à l’intérieur du réticulum endoplasmique, leurs glycosylations se passent dans l’appareil de Golgi. C’est probablement la raison pour laquelle la formation de l’hétéromère E2/E1 s’avère nécessaire pour le transport de l’E1 vers l’appareil Golgi où se produit aussi l’assemblage de particules virales puis à la surface cellulaire. La maturation de ces particules virales dépend de la densité de nucléocapside. La libération du virus se fait par bourgeonnement cytoplasmique.
ÉPIDÉMIOLOGIE
- De survenue endémique saisonnière à la fin de l'hiver et au printemps, et à recrudescence épidémique cyclique, c'est une maladie dont le pic de prévalence se situe au cours de l'enfance dans les populations non vaccinées. Des formes sporadiques, voire des épidémies (armée française en 1996-97) sont possibles chez les vaccinés n'ayant pas eu de rappel.
- La rubéole est une maladie très généralement bénigne, asymptomatique dans près de 50 %. Mais l’infection par le virus pendant les premiers mois de la grossesse peut être responsable de morts foetales ou de rubéoles congénitales malformatives.
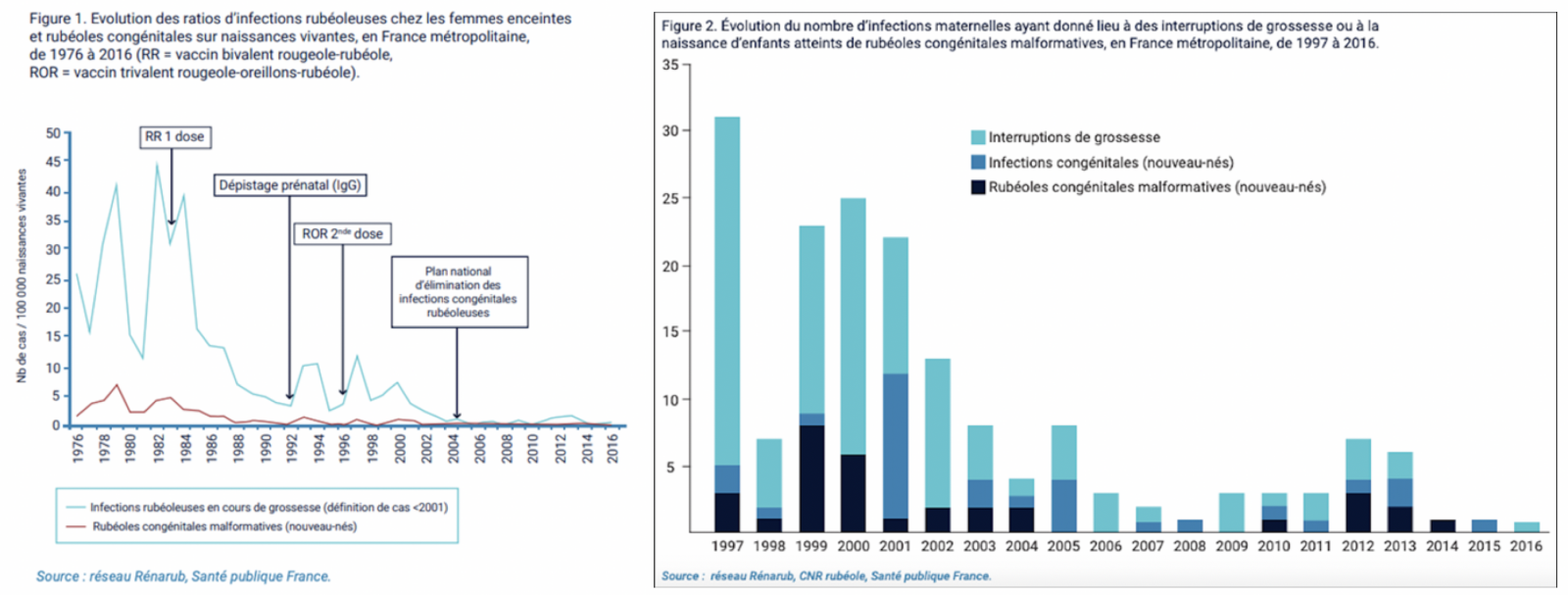
- Le nombre d’infections rubéoleuses diagnostiquées durant la grossesse et recensées par le réseau Rénarub a diminué de 80 % entre 2001 (39 cas) et 2006 (7 cas). Entre 2007 et 2011, 5 cas d’infections maternelles étaient recensés en moyenne chaque année. Depuis, 13 et 12 infections maternelles ont été rapportées en 2012 et 2013. De 2014 à 2016, le nombre d’infections maternelles restaient en dessous de dix par an (6, 1 et 3 respectivement) ; les ratios « nombre d’infections maternelles / nombre de naissantes vivantes » étaient de 0,77, 0,13 et 0,40/100 000 respectivement.
- Depuis 2006, le nombre annuel de grossesses interrompues dans un contexte d’infection maternelle recensées par Rénarub est inférieur ou égal à 3, le nombre d’infections congénitales inférieur ou égal à 5 et le nombre de nouveau-nés atteints de rubéole congénitale malformative (RCM) inférieur ou égal à 3.
- En cas de passage transplacentaire du virus pendant les premiers mois de grossesse, le risque de malformations congénitales est très élevé (de 70 à 100%) quand la primo-infection maternelle survient avant 11e semaine d’aménorrhée (SA) ; il varie de 15 à 80 % entre la 12e et la 18e semaine d’aménorrhée pour devenir quasi nul après ce délai.1
FACTEURS DE RISQUES
Votre texte ici
EXAMEN CLINIQUE
La primo-infection rubéolique se produit en général au cours de l'enfance. Elle est le plus souvent inapparente (asymptomatique dans 50% des cas).
1) Phase d'Invasion
- Brève (1 à 2 jours)
- Sensation de malaise, fièvre modérée < 39 °C, arthromyalgies diffuses, conjonctivite.
- Adénopathies cervicales petites et indolores de localisations de localisations caractéristiques (rétro-auriculaires, cervicales postérieures et surtout sous occipitales), précédent l'éruption de 5 à 10 jours 1 et pouvant persister 10 à 14 jours après disparition de l’éruption.
2) Phase d’état
- Exanthème inconstant- Débute au visage et s’étend en moins de 24 heures- Morbilliforme (J1), parfois scarlatiniforme (J2), disparition à J3 sans séquelles (desquamation fine, inconstante)
- Enanthème discret (quelques taches purpuriques sur le voile du palais)
- Céphalées, toux, conjonctivite et splénomégalie modérée sont possibles
- La fièvre dure rarement au-delà du premier jour de l’éruption
Celle-ci, maculo-papuleuse, érythémateuse, prurigineuse, apparaît chez 50 à 80 % des personnes infectées. Elle dure en général 1 à 3 jours. Elle apparaît sur le visage et le cou avant de s'étendre à tout le corps. Vingt à cinquante pour cent des infections rubéoliques se produisent sans qu'il y ait d'éruption. Des manifestations articulaires (arthrites, arthralgies) peuvent apparaître surtout chez les femmes. Une encéphalite post infectieuse survient dans près de 1 cas / 6 000. Des manifestations hémorragiques (purpura, hémorragies muqueuses dus à une thrombopénie) et un syndrome de Guillain-Barré ont été rarement observ
Fréquence des formes inapparentes ou frustes, limitées à une éruption fugace, peu visible.
La phase d'invasion, souvent muette chez l'enfant, peut être plus marquée chez l'adolescent et l'adulte avec fièvre modérée, céphalées, arthromyalgies et douleurs
pharyngées dans les 5 jours précédant l'éruption. Les adénopathies cervicales sont constantes, parfois tendues et un peu douloureuses,
L'éruption inconstante débute au visage et s'étend en moins de 24 heures au tronc puis aux membres, en respectant les extrêmités ; d'aspect morbilliforme le 1
jour avec éléments maculeux ou maculo-papuleux (visage), elle devient parfois scarlatiniforme le 2 jour (fesses et cuisses) et disparaît au 3 jour, généralement sans
desquamation +/- énanthème très discret +/- splénomégalie modérée.
La fièvre reste modérée et disparaît au 2 ou 3 jour de l'éruption.
Les adénopathies généralisées persistent plusieurs semaines.
Les complications sont rares : polyarthrites contemporaines de l'éruption chez l'adolescent ou l'adulte, purpura thrombopénique post éruptif chez l'enfant (1/3 000),
méningo-encéphalite plus rare que celle de la rougeole (1/5 000 à 1/25 000).
L'éruption de la rubéole peut prendre de nombreux aspects. Il en est un considéré à tort comme typique de rubéole et qu'il vaudrait mieux qualifier simplement de rubéoliforme : éruption débutant sur le visage, rapidement généralisée, faite de petites macules (<3 mm,) rose pâle, durant 3 jours. Le syndrome infectieux est discret, la fièvre modérée (<38,5°C). Deux signes complètent le tableau : des adénopathies quasi-constantes, apparues avant l'éruption, généralisées et notamment cervicales postérieures, et, chez l'adulte, des arthralgies.
Assimiler les éruptions rubéoliformes à la rubéole serait tout à fait faux, pour trois raisons :- La rubéole donne parfois des éruptions intenses, morbilliformes (c.a.d. ressemblant à la
rougeole), scarlatiniformes ou purpuriques.- Au cours de la primo-infection, l'éruption est inconstante, et l'on observe un grand nombre
de primo-infections inapparentes. Une femme enceinte peut infecter son fœtus sans faire
elle-même de manifestations cliniques.- En dehors d'une épidémie de rubéole caractérisée, la moitié des éruptions rubéoliformes
"typiques" sont en fait dues à d‟autres virus : adénovirus, entérovirus, EBV, parvovirus B19, voire HHV-6.
EXAMENS COMPLÉMENTAIRES
Votre texte ici
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
RUBÉOLE CONGÉNITALE :
- La survenue d’une rubéole chez une femme enceinte expose au passage transplacentaire du virus, et donc d’une rubéole congénitale.
- Cet ensemble malformatif a été décrit en 1941 par Gregg, puis mieux compris lors de la grande épidémie de 1964 aux États-Unis, qui entraîna 20000 cas de rubéole congénitale.
-
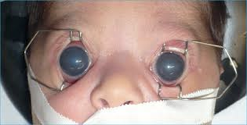
Les appareils les plus souvent concernés sont le système nerveux central (microcéphalie, retard mental, lésions cérébrales focales), l’œil (cataracte, choriorétinite, glaucome), l’oreille (surdité) et l’appareil cardio-vasculaire (canal artériel, sténose de l’artère pulmonaire, communication intraventriculaire).
Un retard de croissance intra-utérin s’observe également, en particulier dans la fœtopathie (infection au cours du deuxième ou troisième trimestre) et peut s’accompagner dans ce contexte d’une hépatosplénomégalie, d’un purpura thrombopénique, d’une anémie hémolytique, de bandes claires métaphysaires osseuses et, éventuellement, d’une encéphalite ou d’une pneumonie.
Les infections rubéoleuses en cours de grossesse et les rubéoles malformatives congénitales sont recensées depuis 1976, en France, par le réseau Rénarub. Depuis 2013, le centre de référence (CNR) des infections rubéoleuses materno-foetales assure la coordination de la surveillance. En 2018, le ministère de la Santé a décidé la mise à déclaration obligatoire (DO) de la rubéole en population générale, avec une attention particulière pour les cas détectés chez les femmes enceintes et chez les nouveau-nés. Le nombre d’infections rubéoleuses diagnostiquées durant la grossesse et recensées par le réseau Rénarub a diminué de 80% entre 2001 (39 cas) et 2006 (7 cas). Entre 2007 et 2011, 5 cas d’infections maternelles étaient recensés en moyenne chaque année. Depuis, 13 et 12 infections maternelles ont été rapportées en 2012 et 2013. De 2014 à 2016, le nombre d’infections maternelles restait en dessous de 10 par an. Depuis 2006, le nombre annuel de grossesses interrompues dans un contexte d’infection maternelle recensées par Rénarub est < 3, le nombre d’infections congénitales < 5 et le nombre de nouveau-nés atteints de rubéole congénitale malformative < 3. Ces données témoignent d’une persistance de la circulation du virus, à un niveau faible mais non conforme à l’objectif d’élimination de la rubéole fixé à 2015 au niveau européen.
PRISE EN CHARGE THÉRAPEUTIQUE
ÉVOLUTION/PRONOSTIC
Votre texte ici
PRÉVENTION
Votre texte ici
SURVEILLANCE
Votre texte ici
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
Votre texte ici
