Lèpre

INTRODUCTION/GÉNÉRALITÉ
- La lèpre est une infection chronique classiquement due à Mycobacterium leprae (M. leprae) ou bacille de Hansen (BH), bacille acido-alcoolo-résistant à croissance lente dont le génome est connu et dont les particularités sont d'une part son tropisme pour la peau et les cellules nerveuses périphériques (cellules de Schwann) et d'autre part l'impossibilité, jusqu'à présent, de le cultiver in vitro.1
- Jusqu'en 2008, M. leprae était considéré comme le seul agent responsable de la maladie. M. lepromatosis a été découvert au Mexique chez des patients atteints d'une forme particulière de la maladie, observée presque exclusivement en Amérique du Sud et principalement au Mexique, appelée lèpre lépromateuse diffuse de Lucio Latapi. Les deux espèces, très proches génomiquement, seraient issues d'un ancêtre commun. M. lepromatosis, comme M. leprae, n'est pas cultivable in vitro et sa présence n'a été confirmée qu'au Mexique.1
HISTORIQUE
Votre texte ici
PHYSIOPATHOLOGIE
Il existe deux niveaux de contrôle génétique de la susceptibilité à la maladie :
- d'une part une prédisposition génétique intrinsèque à contracter la lèpre («lèpre perse»), liée entre autres à des variants des gènes PARK2, PACRG et LTA (lymphotoxine alpha)
- d'autre part, parmi la minorité de sujets qui développeront la maladie, une prédisposition à une des formes cliniques, tuberculoïde ou lépromateuse, de la maladie ainsi qu'aux différents états réactionnels. Celle-ci serait contrôlée par plusieurs gènes dont les gènes HLA, des Toll-like receptors et du TNF-α. La génétique de la lèpre est ainsi devenue très complexe avec plus de 20 gènes cruciaux impliqués.1
ÉPIDÉMIOLOGIE
- En 2017, selon l'Organisation mondiale de la santé (OMS), 210 671 (2,77/100 000) nouveaux cas de lèpre ont été détectés au niveau mondial.1
- Depuis 2008, ce nombre reste relativement stable entre 220000 et 250000 cas.
- Parmi les pays les plus concernés figurent le Brésil, l'Inde, Madagascar, le Népal, l'Angola. Dans la zone «Europe » de l'OMS (50 pays), la situation est inconnue. Il persiste des foyers de la maladie localisés au Portugal, en Espagne, en Sicile et en Grèce. Quelques cas non autochtones sont rapportés en Angleterre, en Allemagne, en Italie et en Suisse. En France, où des enquêtes nationales sont régulièrement réalisées depuis une trentaine d'années, une vingtaine de nouveaux cas, tous non autochtones, sont annuellement détectés en Métropole et plus d'une soixantaine de nouveaux cas autochtones dans les départements d'Outre-Mer, en particulier à Mayotte (Comores) et en Guyane.1
- Le principal réservoir de bacilles est humain et limité aux sujets lépromateux multibacillaires non traités. Cependant, des formes lépromateuses de lèpre «naturelle» ont été observées chez des singes et des tatous sauvages. Ces derniers seraient à l'origine de contamination humaine dans le sud des États-Unis, en particulier en Louisiane.1
- Chez les sujets lépromateux, la source de BH est avant tout les sécrétions nasales. Les lésions cutanées ne sont pas contaminantes à l'exception et, potentiellement, des lésions cutanées des patients lépromateux non traités, lorsqu'elles sont ulcérées, ce qui est exceptionnel. De nombreux bacilles peuvent être trouvés dans les selles et le lait maternel de patients lépromateux, ce qui les fait considérer comme des sources potentielles de BH, mais cela n'a jamais été prouvé.
- Le mode de transmission du BH reste encore mal connu. Les études expérimentales chez l'animal ont permis de montrer que la voie la plus probable de pénétration du bacille serait les voies aériennes supérieures, dans des conditions idéales de température et d'humidité et qu'elle serait favorisée par l'existence d'altérations de la muqueuse. Il n'a pas pu être obtenu de contamination par voie pulmonaire ni par voie gastro-intestinale ou percutanée. Cependant, chez l'homme, des contaminations accidentelles par blessures cutanées (tatouage, bistouris, etc.) ont été rapportées. La transmission in utero, responsable d'une contamination transplacentaire, semble possible chez l'homme, uniquement lorsque les mères sont atteintes de la forme lépromateuse multibacillaire de la maladie. Une cinquantaine de cas de lèpre survenant chez des nourrissons avant l'âge de 18 mois ont été rapportés mais il est possible que ce mode de contamination soit considérablement sous-estimé.
- Après un contact avec M. leprae, plus de 90 % des sujets l'éliminent sans aucune manifestation clinique. Seuls les patients ayant une réponse immunitaire cellulaire (IMC) déficiente vis-à-vis du BH développeront la maladie après une période d'incubation longue, de 3 à 5 ans dans les formes tuberculoïdes et de 7 à 10 ans dans les formes lépromateuses. Des délais plus courts (6 mois) ou plus longs (20 ans) ont été rapportés.
Classification
- En raison du tropisme particulier du BH, les atteintes cliniques sont avant tout cutanées et neurologiques. Cependant, et particulièrement sur le plan cutané, il existe un grand polymorphisme clinique qui fait de la lèpre une maladie à spectre, caractéristique majeure de cette affection. Ce polymorphisme est directement dépendant du statut immunitaire du patient et en particulier des capacités de son IMC à le défendre vis-à-vis de M. leprae.
- À un pôle du spectre, se situent les formes tuberculoïdes. Associées à une bonne IMC spécifique anti-M. leprae, elles se caractérisent par un nombre limité de lésions et une charge bacillaire détectable nulle ou faible. À l'autre pôle, les formes lépromateuses sont considérées comme anergiques vis-à-vis du BH. Elles se traduisent par des lésions multiples et une charge bacillaire forte. Les formes lépromateuses, qui représentent selon les continents 30 à 40 % des cas, sont les seules formes contagieuses de la maladie.
- En raison de ce polymorphisme, de nombreuses classifications ont été proposées. Les plus utilisées sont la classification de Ridley et Jopling et la classification de l'OMS.
A) Classification de Ridley et Jopling 1 1
- Proposée en 1966, elle reste la classification la plus largement utilisée dans les pays développés. Elle repose sur des critères cliniques, histologiques, bactériologiques et immunologiques et elle distingue cinq formes au sein du spectre de la maladie.
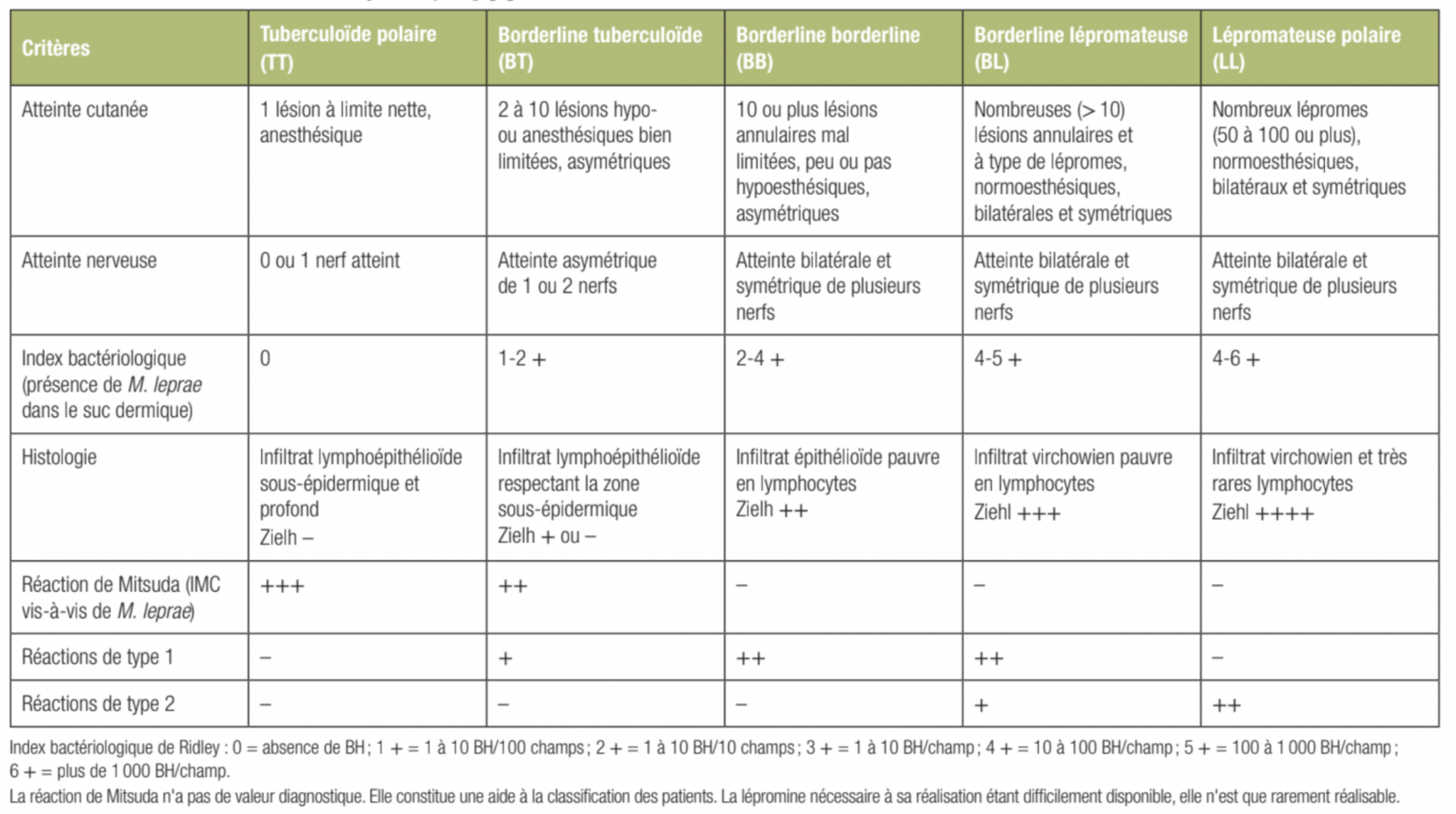
1) Forme tuberculoïde polaire (TT).
- À un pôle du spectre, elle est caractérisée par une bonne réponse de l'individu vis-à-vis du BH. Cette bonne réponse se traduit par une atteinte limitée à une lésion cutanée, l'absence de bacilles détectables dans les lésions cutanées, l'existence d'un granulome lymphoépithélioïde en histologie et une intradermoréaction à la lépromine (réaction de Mitsuda) positive.
2) Forme lépromateuse polaire (LL).
- À l'autre pôle, elle traduit une incapacité totale et définitive de réponse immunitaire vis-à-vis du BH responsable de la multiplication et de la dissémination du bacille dans l'organisme. Les lésions cutanées et neurologiques sont multiples, la charge bacillaire élevée, l'histologie montre un infiltrat de macrophages spumeux (cellules de Virchow) contenant de très nombreux bacilles, la réaction de Mitsuda est négative.
3) Formes intermédiaires ou borderline.
- Entre ces deux pôles, dont le statut immunitaire vis-à-vis du BH est stable, il existe des formes dites borderline, ou intermédiaires, dans lesquelles les capacités de réponse immunitaire anti-M. leprae peuvent se modifier spontanément ou sous l'influence de différents facteurs dont le traitement antibacillaire.
- Selon que prédominent les caractéristiques cliniques, bactériologiques et histologiques de lèpre tuberculoïde ou de lèpre lépromateuse, on distingue la forme borderline tuberculoïde (BT), la forme borderline lépromateuse (BL) et la forme borderline borderline (BB).
4) Forme indéterminée.
- Cette sixième forme, rarement observée, est assimilée à une primo-infection qui peut guérir spontanément ou évoluer vers une des autres formes.
5) États réactionnels.
- Ils correspondent à des complications immunologiques aiguës pouvant survenir au cours de l'évolution de la maladie Encore appelés réactions, ils sont de deux types.
- Les réactions de type 1 traduisent une modification de l'IMC vis-à-vis de M. leprae. Elles surviennent chez les patients borderline BL, BB et BT. La réaction de réversion correspond à un renforcement de l'IMC avec un déplacement vers le pôle tuberculoïde. La diminution de l'IMC avec un glissement vers le pôle lépromateux correspond à une réaction de dégradation.
- Les réactions de type 2 correspondent aux érythèmes noueux (ENL). Ils surviennent dans les formes lépromateuses polaires et borderline lépromateuses. Ils correspondent à une maladie à immuns complexes ou phénomène d'Arthus. Ils ne s'accompagnent d'aucune modification de l'IMC vis-à-vis du BH.
La classification de Ridley et Jopling reposant sur des critères souvent difficiles à obtenir dans les conditions de terrain, l'OMS propose l'utilisation d'une classification bactériologique (1988) et/ou d'une classification clinique (1995) qui distinguent deux groupes de patients : le groupe paucibacillaire (PB) et le groupe multibacillaire (MB).
La classification bactériologique définit :
- les patients PB : patients à charge bacillaire nulle (index bactériologique [IB] = 0 = absence de BH détectable dans le suc dermique);
- les patients MB : patients à IB positif (1 + à 6 +).
La classification clinique définit :
- les patients PB à lésion unique : patients ayant 1 seule lésion hypo- ou anesthésique sans atteinte nerveuse ;
- les patients PB : patients ayant 2 à moins de 5 lésions (maculeuses ou infiltrées ou nodules), hypo- ou anesthésiques, à disposition asymétrique avec un seul nerf atteint;
- les patients MB : patients ayant plus de 5 lésions, plus ou moins hypoesthésiques, à disposition plus symétrique, avec atteinte de plusieurs nerfs.
La correspondance entre les classifications OMS et la classification de Ridley et Jopling est la suivante :
- le groupe PB inclut 75 % des formes tuberculoïdes (100 % des formes TT et 75 % des formes BT).
- le groupe MB inclut 25 % des formes tuberculoïdes BT et 100 % des formes lépromateuses BB, BL et LL.
- La classification bactériologique a pour inconvénient la nécessité de réalisation des prélèvements cutanés et d'une fiabilité de lecture des frottis, ce qui n'est souvent pas possible sur le terrain.
- La classification clinique a l'avantage d'être simple et reproductible. Cependant, elle impose que tous les critères soient respectés. Et il n'est malheureusement pas rare sur le terrain que seul le nombre des lésions soit retenu, ce qui expose à des erreurs non seulement de classification mais également de diagnostic.1 1
- C'est pourquoi, actuellement l'OMS propose de l'utiliser sans exclure la classification bactériologique.
EXAMEN CLINIQUE
Le diagnostic de lèpre est généralement évoqué devant des lésions cutanées et névritiques, plus rarement devant des atteintes névritiques isolées (lèpre nerveuse pure) et exceptionnellement devant des atteintes d'autres organes (œil, os, etc.). Une description clinique détaillée n'existe que dans la classification de Ridley et Jopling.
A) Manifestations cutanées
1) Lèpre tuberculoïde (formes TT et BT).
- Les lésions tuberculoïdes sont peu nombreuses, généralement moins de 10, disposées de façon asymétrique sur le tégument, sans localisation préférentielle. Elles sont de grande taille, supérieure à 5 cm jusqu'à plus de 15-20 cm de diamètre, avec une limite nette par rapport à la peau saine avoisinante. Elles peuvent être maculeuses ou infiltrées.
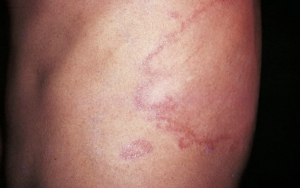
a) Les lésions maculeuses
- Elles sont hypochromiques, planes. Leur surface peut être normale ou discrètement sèche.
b) Les lésions infiltrées
- Succédent ou non à des lésions maculeuses,
- Sont des lésions en relief, hypochromiques et/ou érythémateuses, à surface lisse ou sèche.
- Elles peuvent être infiltrées en totalité, constituant une plaque à limite nettement découpée par rapport à la peau saine, ou infiltrées seulement en bordure, prenant un aspect annulaire avec un centre d'aspect parfois normal et une bordure surélevée bien découpée.
- Qu'elles soient maculeuses ou infiltrées, les lésions tuberculoïdes sont toujours hypo- ou anesthésiques à un, deux ou aux trois modes de sensibilité (toucher, chaleur, douleur).
- Dans la forme TT, il n'existe qu'une seule lésion cutanée, maculeuse ou infiltrée en totalité ou en bordure (lésion annulaire).
- Dans la forme BT, les lésions sont un peu plus nombreuses (2 à 10), de grande taille, maculeuses ou infiltrées et alors volontiers annulaires et sont disposées de façon asymétrique.
2) Lèpre lépromateuse (formes BB, BL, LL)
- Les lésions lépromateuses sont très nombreuses, classiquement plus de 20 pouvant aller jusqu'au-delà de 100 lésions. Elles ont une disposition bilatérale et symétrique. Les lésions lépromateuses peuvent également être maculeuses ou infiltrées.
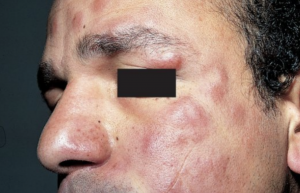
a) Les lésions maculeuses
- Ce sont des lésions planes, de petite taille, de 0,5 à 2 cm de diamètre, plus ou moins discrètement hypochromiques sur peau pigmentée et de teinte érythémato-cuivrée sur peau caucasienne, à limites floues par rapport à la peau saine avoisinante, leur surface est normale.
b) Les lésions infiltrées
- Elles résultent de l'infiltration des lésions maculeuses. Cette infiltration peut être globale et les lésions ont alors l'aspect de papules ou de papulonodules dénommés « lépromes », de petite taille, 0,5 à 2 cm de diamètre, de teinte érythémateuse plus ou moins hypochromique. L'infiltration peut parfois se faire en bordure des lésions maculeuses, réalisant alors des lésions annulaires dont la bordure est large (1 à 3 cm) et mal limitée par rapport à la peau saine avoisinante. Ces lésions annulaires sont de plus grande taille celles à type de lépromes et peuvent atteindre 5 à 8 cm de diamètre.
- En l'absence de traitement, les lésions lépromateuses particulièrement à type de lépromes peuvent confluer et être responsables d'une infiltration diffuse donnant le classique faciès léonin du visage, un aspect boudiné du lobule des oreilles, des doigts et des orteils. Cette infiltration peut provoquer une chute de la queue des sourcils et exceptionnellement des cils. en revanche, la lèpre lépromateuse n'est pas alopéciante sur le cuir chevelu.
- Qu'elles soient maculeuses ou infiltrées, les lésions lépromateuses ne sont pas hypoesthésiques.
- Dans la forme BB, les lésions sont strictement annulaires en nombre variant de 10 à 20, de taille intermédiaire de 5 à 10 cm, à bordure floue.
- Dans la forme BL, les lésions sont à la fois de type léprome et de type annulaire.
- Dans la forme LL, les lésions sont exclusivement à type de macules et/ou de lépromes. Elles sont très nombreuses, supérieures à 50, disposées de façon bilatérale et symétrique. Une infiltration du lobule des oreilles, des doigts et des orteils ainsi qu'une alopécie de la queue des sourcils sont habituelles.
- La lèpre histoïde de Wade est une forme rare de lèpre lépromateuse extrêmement bacillaire d'aspect clinique (papulonodules « fibreux» parfois ulcérés, nodules hypodermiques fermes et indolores, etc.) et histologique (histiocytes fusiformes) particuliers.
- La lèpre diffuse de Lucio-Latapi, ou lepra bonita, est une lèpre lépromateuse vue surtout en Amérique du Sud caractérisée initialement par une infiltration d'emblée diffuse de l'ensemble du tégument, donnant un aspect de «bonne santé ».
3) Lèpre indéterminée.
- Cette forme qui correspondrait à la forme de début de la maladie ou à une sorte de primo-infection passe souvent inaperçue en raison de la discrétion de ses signes.
- De diagnostic difficile, elle se présente sous l'aspect d'une lésion discrètement hypochromique, souvent arrondie de 2 à 5 cm de diamètre, à limites floues, sans troubles de la sensibilité.
- Elle peut guérir spontanément ou évoluer vers une forme tuberculoïde ou une forme lépromateuse.
B) Manifestations neurologiques 1
1) Hypertrophie nerveuse
- Le signe majeur de l'atteinte neurologique, quasi pathognomonique de la maladie, est l'hypertrophie des nerfs périphériques.
- Les nerfs intéressés sont le nerf cubital au coude, le nerf médian au poignet, le nerf radial à la face dorsale du poignet, le nerf sciatique poplité externe au genou, le nerf tibial postérieur à la face interne de la cheville et le plexus cervical superficiel au cou.
- Cette hypertrophie nerveuse peut être asymptomatique ou douloureuse spontanément ou à la pression.
2) Déficit sensitivomoteur
- Le deuxième signe neurologique de l'atteinte des nerfs périphériques est l'existence d'un déficit sensitif et/ou moteur dans les territoires correspondant aux nerfs précédemment cités. Les conséquences de ces atteintes sensitivomotrices font toute la gravité de la maladie à long terme.
- En effet, les troubles sensitifs des mains et des pieds, à type d'hypo- ou d'anesthésie, sont responsables de brûlures ou de blessures accidentelles non perçues par le patient, occasionnant des plaies dont la surinfection peut être à l'origine d'infections osseuses sous-jacentes conduisant à des amputations et à la survenue d'ulcérations chroniques, « maux perforants » palmaires ou plantaires.
- Les troubles moteurs à type de paralysie sont responsables d'amyotrophie et de déformation des doigts et des orteils réalisant les classiques aspects dits en «mains de singe » et de déformation des pieds avec orteils « en marteau». L'atteinte du nerf sciatique poplité externe entraîne un steppage du pied avec impossibilité de relever celui-ci et gêne à la marche.
3) Dans les formes tuberculoïdes (TT, BT)
- L'atteinte névritique intéresse un ou quelques nerfs de façon asymétrique, elle est généralement sévère en raison de l'existence au niveau des nerfs d'un granulome épithélioïde responsable d'une nécrose des cellules nerveuses.
- Dans les formes lépromateuses (BB, BL, LL), l'atteinte névritique est généralement multiple, bilatérale et symétrique. Elle reste assez longtemps silencieuse à type d'hypertrophie et les déficits sensitivomoteurs sont généralement occasionnés par la survenue d'états réactionnels.
4) La forme neurologique pure
- Rare (10-15 % des cas)
- Observée surtout en Inde, se traduit par une atteinte d'un ou plusieurs nerfs.
- Elle peut être tuberculoïde ou lépromateuse.
- Son diagnostic est difficile, nécessitant la recherche de BH dans le suc dermique et souvent la réalisation d'une biopsie nerveuse.
C) Autres manifestations 1
- La lèpre tuberculoïde est presque exclusivement cutanée et/ou nerveuse.
- En revanche, dans la lèpre lépromateuse, d'autres organes peuvent être atteints. En particulier, une atteinte ORL (nez, larynx, pharynx), une atteinte oculaire (gros nerfs cornéens, kératite, uvéite…), une atteinte osseuse (atteinte spécifique des mains et des pieds) sont d'autant plus fréquemment observées que la maladie est évoluée.
EXAMENS COMPLÉMENTAIRES
A) Bactériologie
- La confirmation du diagnostic se fait par biopsie d'une lésion cutanée et le bilan bactériologique (coloration de Ziehl-Neelsen du suc dermique d'une lésion).
- Le comptage des BH, réalisé après coloration de Ziehl-Neelsen, permet de déterminer l'index morphologique et l'index bactériologique.
1) Index morphologique (IM).
Morphologiquement en microscopie optique, les BH se présentent sous deux formes : les formes homogènes, ou viables, en bâtonnets entiers, et les formes granuleuses en bâtonnets fragmentés. L'IM se définit comme le pourcentage de formes homogènes vues sur 100 BH.
2) Index bactériologique (IB).
Il correspond au nombre de BH vus par champ examiné sans tenir compte de leur morphologie. Il s'exprime selon l'échelle logarithmique de Ridley :
- (−) = absence de BH;
- 1 + = 1 à 10 BH/100 champs
- 2 + = 1 à 10 BH/10 champs
- 3 + = 1 à 10 BH/champ
- 4 + = 10 à 100 BH/champ
- 5 + = 100 à 1000 BH/champ
- 6 + = + de 1000 BH/champ.
- Dans les formes tuberculoïdes (TT/BT), l'IM est négatif et l'IB est inférieur à 2 +.
- Dans les formes lépromateuses (BB, BL, LL), l'IM est + et l'IB est supérieur à 2 +, l'IM et l'IB sont d'autant plus élevés que le patient est proche du pôle lépromateux.
- Les techniques de PCR permettent la détection des BH et d'éventuelle résistance médicamenteuse. L'aide de la PCR au diagnostic de lèpre est modeste car le taux de positivité dans les formes tuberculoïdes abacillaires ou paucibacillaires (formes TT et BT) est nul ou très bas (<10-20 %) et dans les formes lépromateuses, la coloration de Zielh sur les biopsies ou les frottis est toujours positive. Elle n'est donc pas indispensable au diagnostic.1
- La recherche de résistances médicamenteuses est utile essentiellement en cas de rechute des formes lépromateuses multibacillaires. Elles sont associées à des mutations génomiques sur le gène rpoB pour la rifampicine, sur le gène gyrA pour les quinolones et sur le gène fol1 pour la dapsone.1 Il n'y a pas de mutation connue pour le lamprène pour lequel les cas de résistance sont rarissimes et douteux.
B) Anatomopathologie
L'examen histologique est indispensable à la classification de Ridley et Jopling, il permet en outre de faire le diagnostic des cas difficiles.
1) Dans les formes tuberculoïdes, il existe dans le derme un infiltrat épithélioïde à disposition périannexielle et surtout périnerveuse, fait de cellules histiocytaires épithélioïdes et/ou géantes et de lymphocytes souvent disposés en couronne. Les filets nerveux cutanés et les glandes sudorales sont infiltrés et, parfois, complètement détruits par l'infiltrat. La coloration de Zielh-Neelsen ne montre pas ou que de rares BH.
2) Dans les formes lépromateuses, l'infiltrat, très pauvre en lymphocytes, est constitué de cellules histiocytaires vacuolisées ou spumeuses, dites cellules de Virchow. L'infiltrat à disposition périannexielle et périnerveuse pénètre les filets nerveux qui sont épaissis, sans les détruire. La coloration de Zielh-Neelsen montre des BH en nombre variable, isolés ou groupés en amas (globi).
3) Dans la forme indéterminée, il existe un très discret infiltrat lymphohistiocytaire à disposition grossièrement périsudorale et périnerveuse. Cet aspect est souvent peu spécifique. La coloration de Ziehl est généralement négative.
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
A) États réactionnels
- Ces complications aiguës ou subaiguës d'origine immunologique peuvent survenir spontanément ou sous traitement, plus rarement avant traitement. On en distingue deux types : les réactions de type 1 comprenant la réaction de réversion (RR) et la réaction de dégradation, et les réactions de type 2 : érythème noueux lépreux et phénomène de Lucio. Elles nécessitent un traitement spécifique.
1) Réactions de type 1
- La réaction de réversion, ou réaction réverse ou up-grading reaction, assimilée à une réaction d'hypersensibilité retardée provoquant un renforcement de l'IMC vis-à-vis du BH et un déplacement vers le pôle tuberculoïde, ne s'observe que chez les patients borderline BT, BB ou BL. Elle peut parfois survenir spontanément (10 %), mais elle apparaît plus fréquemment au cours des 6 (formes BT, BB) à 24 (formes BL) premiers mois de traitement. Depuis l'application des traitements de courte durée, on a également noté de fréquentes RR dites « tardives », survenant quelques mois ou années après arrêt du traitement antibacillaire. Cliniquement, la RR se traduit par l'apparition brutale, sans signes généraux, d'un œdème et d'une turgescence des lésions préexistantes qui parfois peuvent s'ulcérer ainsi que généralement une aggravation ou la survenue d'une hypo- ou d'une anesthésie des lésions. L'atteinte nerveuse fait toute sa gravité, réalisant un tableau de névrite aiguë ou subaiguë, hypertrophique, douloureuse et surtout déficitaire. Une paralysie et/ou une anesthésie totale dans les territoires intéressés peuvent s'installer en quelques heures ou jours et leur réversibilité dépend de la rapidité de traitement de la poussée.
- La réaction de dégradation, ou down-grading reaction, résulte d'un déplacement vers le pôle lépromateux lié habituellement à l'absence de traitement. Rarement observée par le clinicien, elle se traduit par une augmentation du nombre et de la taille des lésions qui prennent un aspect de plus en plus lépromateux polaire.
2) Réactions de type 2
a) L'érythème noueux lépreux (ENL)
- Il est assimilé à un phénomène d'Arthus ou maladie à immuns complexes. Il ne s'accompagne d'aucune modification de l'immunité cellulaire vis-à-vis du BH et ne s'observe que chez les patients lépromateux BL et surtout LL, avant ou sous traitement. L'ENL survient par poussées aiguës volontiers récidivantes.
- Brutalement dans un contexte de fièvre et d'altération de l'état général apparaissent, en n'importe quelle région du corps, des nodules dermo-hypodermiques chauds, douloureux, indépendants des lésions spécifiques lépromateuses.Ces nodules disparaissent en quelques jours sans cicatrice, tandis que d'autres apparaissent.
- Associé à ces nodules, il existe généralement un tableau de névrite aiguë douloureuse mais peu déficitaire. D'autres manifestations systémiques peuvent se voir, telles qu'adénopathies, arthrites, iridocyclite, orchiépidydimite et glomérulonéphrite.
- La gravité des ENL résulte avant tout de leur répétition qui peut entraîner une névrite déficitaire, une infertilité, une gynécomastie, une insuffisance rénale par amylose ou une cécité.
b) Le phénomène de Lucio
- C' est une forme sévère de réaction de type 2 avec vasculite cutanée et systémique nécrosante survenant au cours de la lèpre diffuse de Lucio-Latapi.
PRISE EN CHARGE THÉRAPEUTIQUE
A) Dans les pays médicalisés
Formes paucibacillaires (absence de bacilles aux prélèvements du suc dermique ou moins de 5 lésions cutanées et moins de 2 nerfs atteints) :
- Rifampicine (600 mg/24h) + Clofazimine (100 mg/24h) ou Dapsone (100 mg/24h)
- Au minimum 6 mois ou jusqu'à guérison clinique
Formes multibacillaires :
- Rifampicine (600 mg/24h) + Clofazimine (100 mg/24h) + Dapsone (100 mg/24h)
- Au minimum 24 mois ou jusqu'à négativation bactériologique
B) Dans les pays d'endémie
Formes paucibacillaires (absence de bacilles aux prélèvements du suc dermique ou moins de 5 lésions cutanées et moins de 2 nerfs atteints) :
- Dapsone (100 mgx 1/24h) auto-administrée pendant 6 mois + Rifampicine (600 mg 1 fois par mois en prise supervisée pendant 6 mois)
Formes multibacillaires :
- Dapsone (100 mg x 1/24h) auto-administrée + Rifampicine (600 mg 1 fois par mois en prise supervisée) + Clofazimine (50 mg x 1/24h) auto-administrée + Clofazimine (300 mg/24h 1 fois par mois en prise supervisée)
- Traitement de 12 à 24 mois ou jusqu'à négativation bactériologique
C) Autres Schémas
Si résistance à la Rifampicine (exceptionnelle) ou en cas d'intolérance à l'un des trois antibacillaires cités, on peut les remplacer par l'un des antibiotiques suivants (par ordre préférentiel) :
- Ofloxacine (400 mg/24h en 2 prises)
- Minocycline (100 mg /24h en 1 prise)
- Clarithromycine (500 mg/24h en 1 prise)
D) Etats Réactionnels (Urgences thérapeutiques)
- Poussée d'érythème noueux lépreux : ils réagissent de façon spectaculaire à la thalidomide. Les AINS et les corticoïdes sont efficaces mais moins rapidement
- Les réactions reverses nécessitent la mise sous corticothérapie générale
- La décompression chirurgicale urgente d'un nerf (neurolyse) peut être nécessaire
ÉVOLUTION/PRONOSTIC
Votre texte ici
PRÉVENTION
- Les essais de vaccination par le BCG ou par le BCG associé à M. leprae tué ont montré un effet protecteur de 50-60 % durant 9 ans. Cependant cet effet s'est exercé vis-à-vis des formes paucibacillaires mais pas vis-à-vis des formes multibacillaires lépromateuses contagieuses dont l'incidence est restée la même.1
SURVEILLANCE
Votre texte ici
CAS PARTICULIERS
Votre texte ici
résumé
- Due à Mycobacterium leprae (Bacille de Hansen).
- Anesthésie des lésions cutanées (pathognomonique de la Lèpre tuberculoïde).
- L'association de lésions cutanées et de troubles neurologiques périphériques, sont très évocatrices.
- Confirmation du diagnostic par biopsie d'une lésion cutanée et le bilan bactériologique (coloration de Ziehl-Neelsen du suc dermique d'une lésion). Ceci permet une évaluation de la charge bacillaire, importante pour le traitement.
- Le contrôle de la maladie repose sur le dépistage et le traitement précoce des patients multibacillaires.
