Hypertension artérielle de l'adulte

INTRODUCTION/GÉNÉRALITÉ
A) Généralité
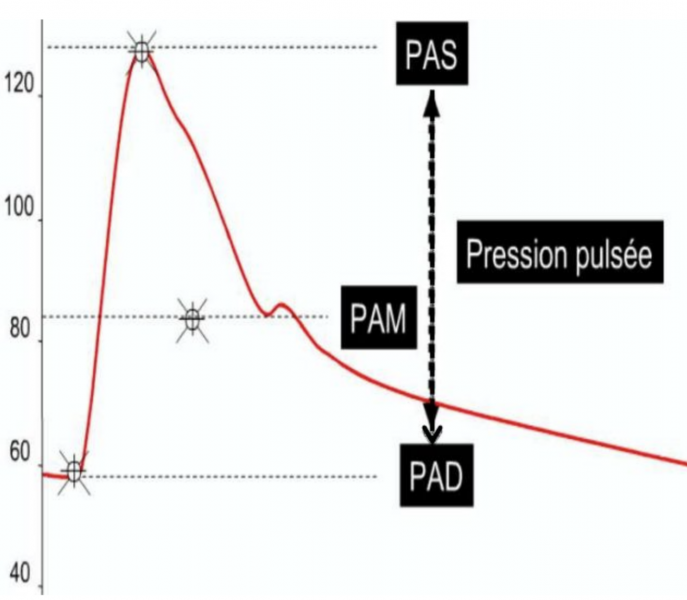
- La pression artérielle ou encore la tension artérielle, correspond à la pression exercée par le sang sur la paroi des artères.
- Le chiffre supérieur correspond à la pression lorsque le cœur se contracte (systole). PAs = paramètre le plus important après 50ans.
- Le chiffre inférieur correspond à la pression quand le cœur se relâche (diastole).PAd = paramètre le plus important avant 50ans.
- La pression artérielle moyenne est calculée comme PAM = (PAS + 2x PAD) / 3.
- La pression artérielle est exprimée en millimètre de mercure (mmHg).
- La Pression artérielle Pulsée (PP = PAs - PAd) reflète la rigidité artérielle et a une valeur pronostique négative si elle est élevée (normale <65mmHg). La PP est surtout augmentée chez le sujet âgé.
B) Définition et classification
- La relation entre l’élévation de la PA et le risque de complications cardio-vasculaires et rénales est linéaire, ce qui rend la distinction entre une PA dite « normale » et l'hypertension artérielle (HTA) quelque peu arbitraire. Les chiffres de pression artérielle (PA) définissant une hypertension artérielle ont donc été déterminés sur la base d’études démontrant un effet bénéfique et significatif sur le risque cardio-vasculaire lorsque la PA est inférieure à ces valeurs.
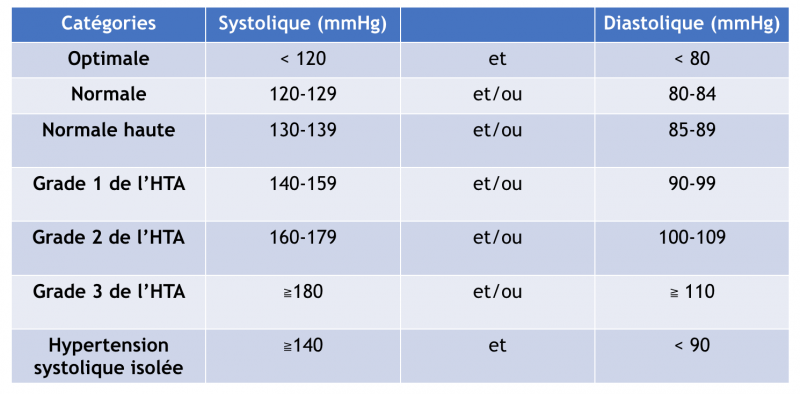
- L’HTA est définie par une PAS > 140 mmHg et/ou une PAD > 90 mmHg mesurées au cabinet du médecin et persistant dans le temps. Cette définition a été adoptée par toutes les recommandations internationales et par l’Organisation mondiale de la santé (2003).1
La classification des différents grades d’hypertension, et la définition (basées sur la mesure de la pression artérielle en cabinet) sont inchangées par rapport aux recommandations précédentes de 2013 : 1
ÉPIDÉMIOLOGIE
- L’hypertension artérielle est un facteur de risque cardio-vasculaire et rénal majeur. C’est une des causes principales de décès prématuré (infarctus du myocarde, accident vasculaire cérébral ..). C’est également un facteur de risque majeur d’insuffisance cardiaque, de fibrillation atriale, d’insuffisance rénale chronique, d’atteintes artérielles périphériques et de déclin cognitif.
- Les bénéfices de la baisse de tension chez le patient hypertendu sont démontrés : elle réduit le risque d’AVC, de démence, d’insuffisance cardiaque, d’infarctus du myocarde et de décès d’origine cardio-vasculaire. Elle retarde également l’apparition de l’insuffisance rénale chronique terminale.
- Le dépistage précoce et la prise en charge de l'HTA contribuent à l'allongement de l'espérance de vie.
Les risques liés à l’HTA en l’absence de traitement sont les suivants :
- Risque d’insuffisance cardiaque x 7,
- Risque d’infarctus du myocarde x 3,
- Risque d’AVC x 8,
- Risque d’artériosclérose associé à une démence vasculaire entre x2 et 8,
- Risque de néphroangiosclérose x 6.
A) En France
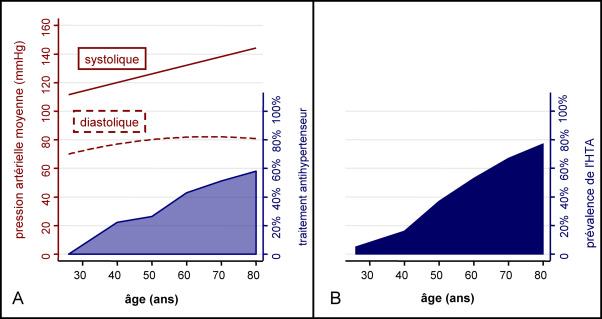
- L’hypertension artérielle (HTA) est la maladie chronique la plus fréquente en France (plus de 15 millions d’hypertendus en France et 1er motif de consultation en médecine générale) et dans le monde.1
- En France, en 2019, 10,2 millions de patients sont traités par des médicaments antihypertenseurs, soit 28 % de la population des sujets de 35 ans et plus. Le nombre de sujet traité par antihypertenseurs augmente avec l’âge : Il est de 3,6 millions chez les 75 ans et plus (59 % de la population), de 5,5 millions chez les 55-74 ans, et de 1,3 million chez les 35-44 ans.
- La prévalence de l’HTA augmente avec l’âge et, en France, 80 % des hypertendus sont âgés de plus de 55 ans. Avant 55 ans, l’HTA systolo-diastolique (PAS et PAD élevées) prédomine, et après 70 ans, c’est l’HTA systolique (PAS et PP élevées) qui est la plus fréquente.
- Environ 1 million de nouveaux patients sont traités pour une HTA en France chaque année, ce qui correspond à une moyenne de 15 à 20 nouveaux patients pour un médecin généraliste. 1
- En France, environ 20 % des patients hypertendus ne sont pas traités et 50 % des patients hypertendus traités n’atteignent pas les objectifs de PA contrôlée.1 1
- L’HTA est plus fréquente chez les sujets en surpoids, chez les sujets dont le père ou la mère a été hypertendu avant l’âge de 55 ans, chez les consommateurs de sel en excès (> 12 g/j), chez les diabétiques de type 2.
B) Au niveau international
- L’hypertension est un problème de santé publique mondial. Selon un rapport de l’OMS publié en 2013, les maladies cardio-vasculaires sont responsables d’environ 17 millions de décès par an dans le monde, soit près d’un tiers de la mortalité totale. Sur ce chiffre, 9,4 millions de morts par an sont imputables aux complications de l’hypertension.
- En 2008, le nombre total de personnes présentant une hypertension diagnostiquée atteignait 1 milliard contre 600 millions en 1980. C’est dans la région africaine (46 %) que la prévalence de l’hypertension est la plus élevée alors que dans les pays à revenu élevé la prévalence de l’hypertension est plus faible (35 %).
- De 1999 à 2010, la prévalence de l’HTA est restée stable (aux environs de 30 %).1
- Dans la Région de la Méditerranée orientale, deux adultes sur cinq sont touchés par l’hypertension.1
PHYSIOPATHOLOGIE
A) Déterminants de la pression artérielle
Les trois déterminants essentiels de la pression artérielle sont :
- La volémie : au travers du volume d’éjection systolique (VES) : volume de sang éjecté lors de chaque systole.
- Les résistances vasculaires périphériques (RVP).
- Le débit cardiaque.

1) Les artères
a) Généralités
- Les résistances artérielles vont dépendre de la vasomotricité artérielle et de la rigidité intrinsèque des parois artérielles.
- Toutes les artères naissent de l’aorte ou de l’artère pulmonaire afin de transporter le sang du cœur vers les organes périphériques.
- De l’aorte sont issues les artères coronaires et l’ensemble des artères assurant le transport du sang oxygéné aux différents organes du corps, aussi appelée circulation systémique.
- Elles distribuent un sang à « haute pression » et doivent donc faire face à de grandes variations pressionnelles.
- Cette capacité à s’accommoder d’important gradient de pression est possible grâce à leur structure histologique, leur conférant une grande élasticité et leur capacité via les fibres musculaires lisses de se vasoconstricter ou vasodilater en fonction des signaux nerveux et hormonaux reçus.
b) Histologie
+ Une artère est constituée de trois couches concentriques :
- L’intima ou couche interne : au contact du sang, bordée par l’endothélium. Il s’agit d’une membrane peu épaisse, lisse et très élastique. Elle est séparée de la média par la limitante élastique interne.
- La média : charpente musculo-élastique du vaisseau, elle est constituée de fibres musculaires lisses, de collagène et d’élastine. Elle aussi est très élastique. Elle est séparée de l’adventice par la limitant élastique externe.
- L’adventice ou couche externe : zone d’innervation et de vascularisation. Cette couche histologique est plus rigide.
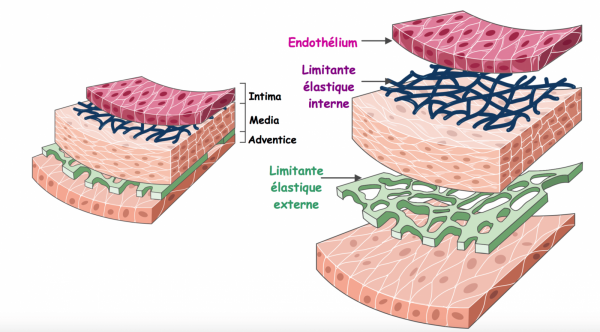
+ Il existe trois types histologiques d’artères :
- Elastique : artère de conduction de gros calibre. Leur média est riche en fibres élastiques afin de diffuser l’énergie transmise par le cœur lors de la systole ventriculaire permettant d’assurer une perfusion tissulaire à la fois en systole et diastole.
- Musculaire : artère de distribution, de plus petit calibre, dont la média contient essentiellement des fibres musculaires lisses.
- Artérioles : les plus petites, situées au sein des tissus et organes. Leur rôle vasomoteur est essentiel afin de réguler le lit capillaire et les résistances vasculaires périphériques.
2) Débit cardiaque
a) Généralités
+ Circulation systémique ou grande circulation
- il s’agit d’un système à haute pression, ayant pour objectif de distribuer l’oxygène et les nutriments aux différents tissus de l’organisme, et d’en extraire les déchets.
- Le débit sanguin artériel est distribué en fonction des besoins prioritaires variables d’un moment à un autre.
- Elle se fait en série à la circulation pulmonaire.
- Le cycle cardiaque se divise en phases successives de remplissage et de vidange des cavités cardiaques.
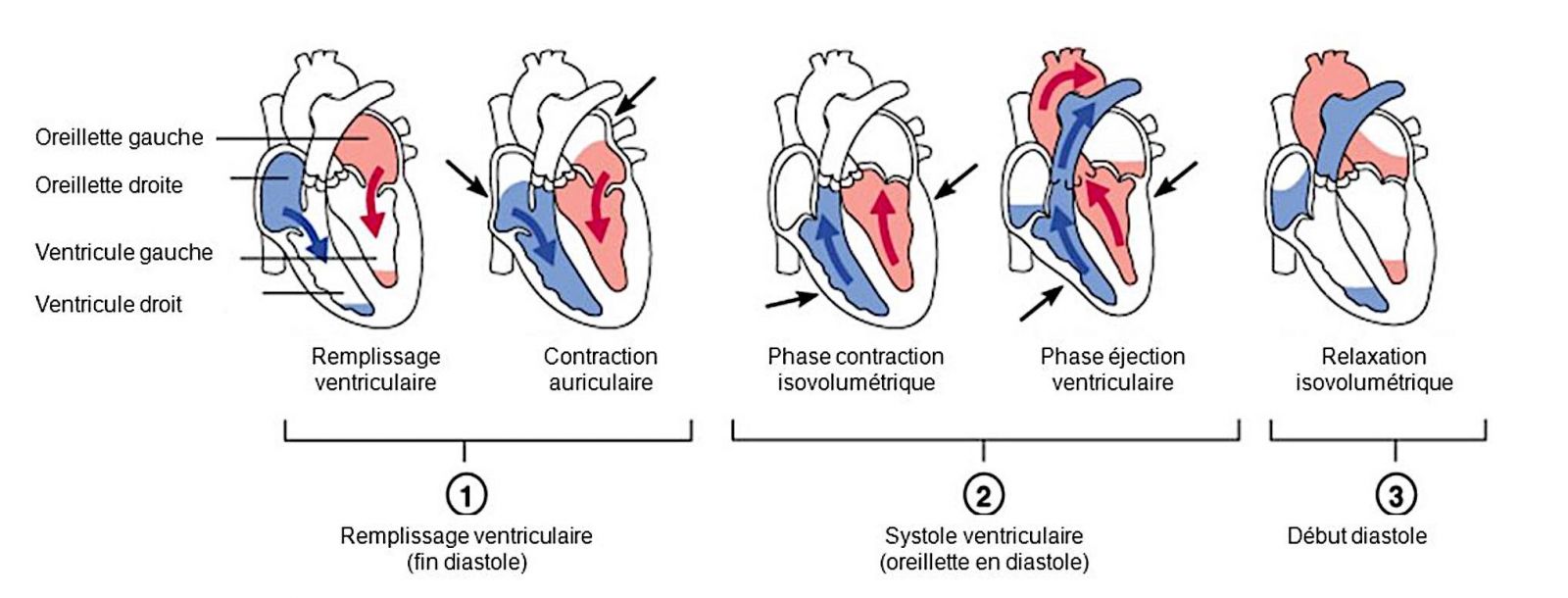
+ Systole auriculaire
- La plus grande partie de la quantité sanguine, environ 70%, s’écoule passivement des oreillettes aux ventricules avant le début de la contraction auriculaire.
- La systole auriculaire permet d’éjecter le reste du volume sanguin présent dans les oreillettes (soit environ 30%)
+ Systole ventriculaire
- Les deux ventricules droit et gauche se contractent de manière synchrone pendant un tiers de seconde au repos.
- La contraction entraine la fermeture des valves auriculo-ventriculaires elle-même suivie de l’ouverture des valves sigmoïdes aortique et pulmonaire.
- La pression intraventriculaire pendant la systole augmente, ce qui est responsable de l’éjection sanguine du ventricule gauche à l’aorte et du ventricule droit jusqu’à l’artère pulmonaire.
- En absence de pathologie valvulaire, il n’y a pas de reflux vers les deux auricules.
- La qualité de l’éjection ventriculaire est variable et dépend de nombreux facteurs : La précharge ventriculaire, la postcharge ventriculaire, et la contractilité myocardique
+ Diastole ventriculaire
- Lors de la diastole ventriculaire, les pressions intra-ventriculaires diminuent jusqu’à devenir plus faibles que les pressions intra-auriculaires (phase de relaxation isovolumétrique).
- Les valves auriculo-ventriculaires s’ouvrent alors que les valves aortiques et pulmonaires se ferment.
- Le sang provenant de l’ensemble du retour veineux jusqu’au oreillettes remplit alors les ventricules.
- La diastole est physiologiquement plus longue que la systole, mais sa durée diminue lors d’une augmentation de la fréquence cardiaque.
b) Les déterminants du débit cardiaque
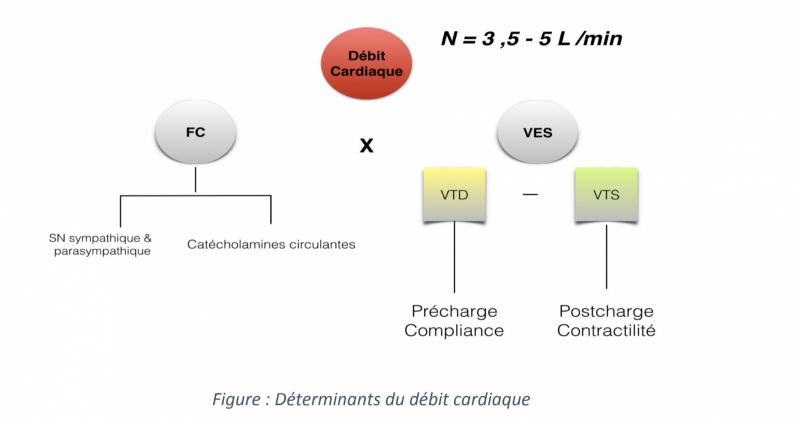
- Le débit cardiaque correspond à la quantité de sang délivrée par chaque ventricule par minute.
- Il est déterminé par le produit du volume d’éjection systolique par la fréquence cardiaque (FC), en litre par minute.
- Il est habituellement compris entre 3,5 et 5L/minute chez un adulte sain.
- Les ventricules contiennent à la fin de la diastole ventriculaire un volume sanguin appelé volume télé-diastolique (VTD).
- En fin de systole, le volume sanguin contenu est le volume télé-systolique (VTS).
- La différence entre les deux est appelée volume d’éjection systolique (VES), qui correspond au volume sanguin éjecté par les ventricules lors de chaque battement cardiaque (FC).
- Le VES normal est de 50 à 65 ml/m2 de surface corporelle au repos.
- La fraction d’éjection ventriculaire correspond au rapport entre le volume d’éjection systolique et le volume télé diastolique et est normalement autour de 65%.
+ Le volume d’éjection systolique dépend de trois facteurs principaux :
- La précharge,
- Les performances myocardiques : contractilité et relaxation,
- La postcharge.
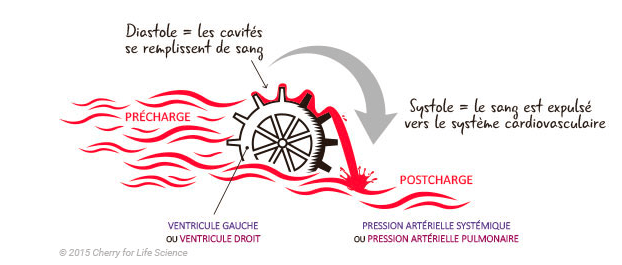
--> La précharge
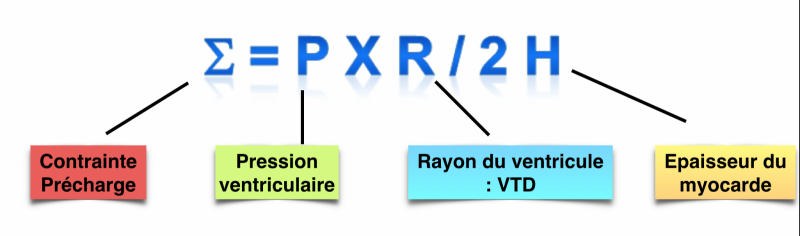
- La précharge représente la contrainte exercée sur la paroi ventriculaire en fin de diastole.
- Physiologiquement la précharge concerne les deux ventricules, droit et gauche.
- Cependant par convention on parlera ici de précharge du ventricule gauche, la précharge du ventricule droit sera quant à elle considérée comme étant le retour veineux systémique.
La précharge dépend également :
- Du retour veineux systémique / du volume d’éjection du ventricule droit : lui-même variable selon la volémie, la résistance et la compliance du système veineux capacitif, le régime de pression abdominal et thoracique mais aussi le débit cardiaque, le système étant clos (précharge du ventricule gauche = volume d’éjection du ventricule droit),
- De la distensibilité cardiaque : variable selon la compliance ventriculaire, péricardique et l’épaisseur du myocarde,
- Du synchronisme auriculo-ventriculaire,
- Des compétences valvulaires,
- Du temps de remplissage ventriculaire (diastole).
--> Les performances myocardiques :
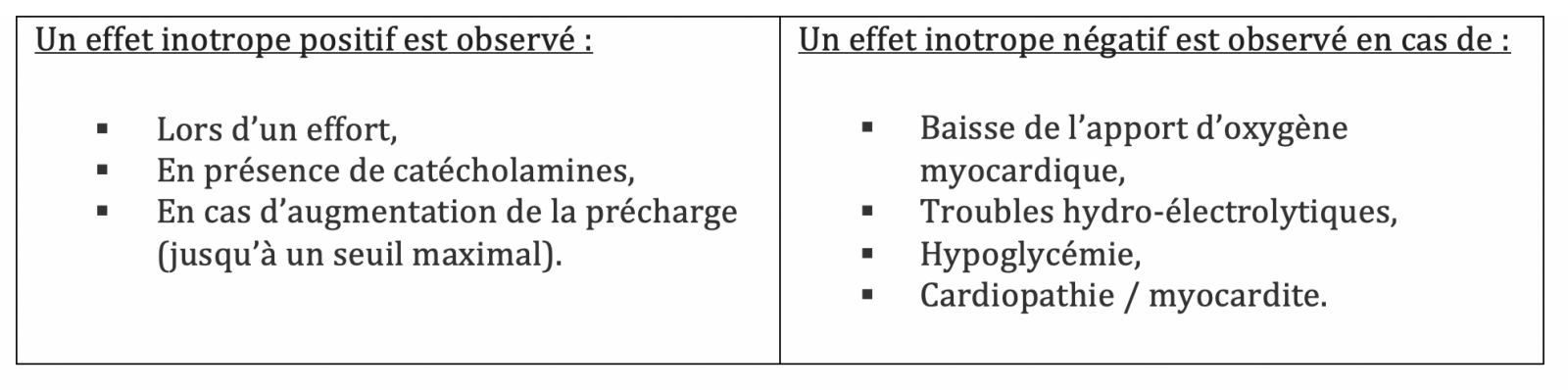
- La contractilité myocardique correspond à la performance musculaire systolique du myocarde ou inotropisme, et est liée à un raccourcissement des fibres musculaires.
--> La postcharge
- La postcharge représente la contrainte exercée sur la paroi ventriculaire lors de la phase de contraction systolique.
- Selon la loi de Poiseuille, pour un fluide parfait de faible densité et avec écoulement laminaire : QC = P/RP (Pression Systolique ; R = Résistance Artérielle)
- Elle est donc proportionnelle à la pression ventriculaire gauche et inversement proportionnelle aux résistances vasculaires artérielles.
B) Systèmes régulateurs de la pression Artérielle
- Il existe plusieurs systèmes régulateurs qui sont interliés avec différentes vitesses de réponses aux variations de la pression artérielle.
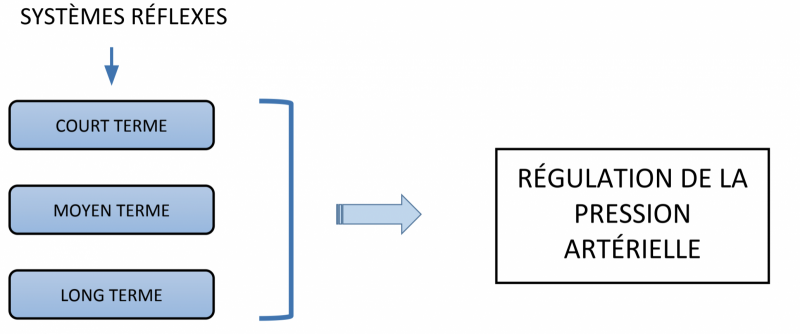
1) Régulation immédiate
La régulation à court terme de la PA est sous la dépendance du système nerveux. Elle est médiée par les barorécepteurs et les volorécepteurs.
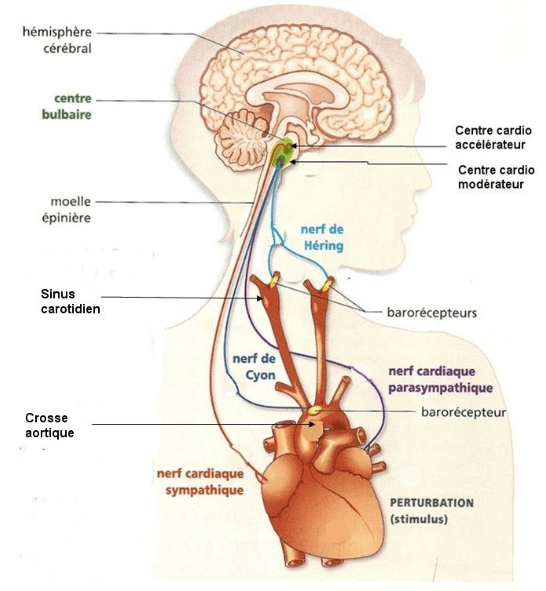
a) Les barorécepteurs
- Sont sensibles à la tension de la paroi de l’artère,
- Sont situés à deux niveaux : aortique et carotidien,
- Les nerfs afférents sont les nerfs vagues (pneumogastrique) et les nerfs de Hering,
- Les nerfs efférents du réflexe sont les nerfs parasympathiques et sympathiques .
- Lorsque les barorécepteurs carotidiens et aortiques détectent une chute de pression artérielle, le message nerveux est envoyé au centre bulbaire par le nerf de Hering et le nerf vague, ce qui provoque une stimulation du système sympathique et une inhibition du système parasympathique avec comme conséquence une vasoconstriction, une augmentation de la fréquence cardiaque, du volume d’éjection systolique, du débit cardiaque et donc une augmentation de la pression artérielle.
b) Système nerveux autonome
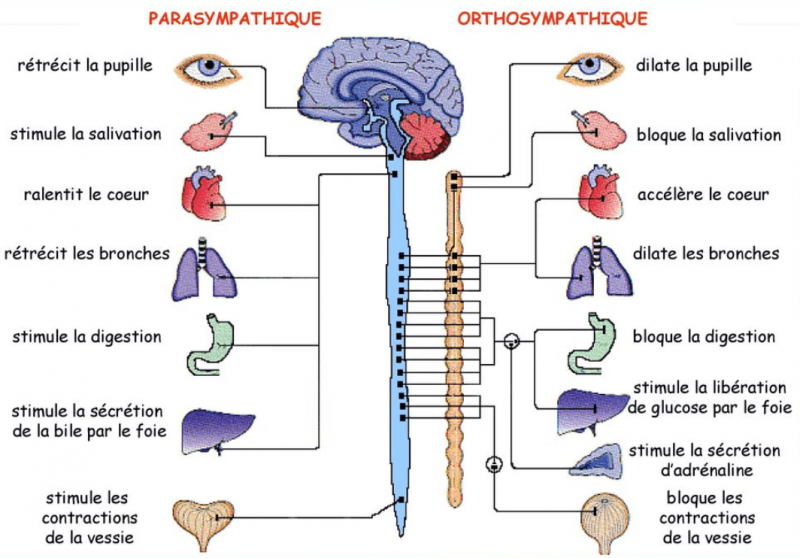
- Le système nerveux autonome (SNA) ou système nerveux végétatif à pour principale fonction la régulation et la modulation de l’hémostasie.
- Son action s’exerce principalement sur les fonctions circulatoire, respiratoire, digestive, endocrinienne.
- Il se divise en deux systèmes à la fois complémentaire et antagoniste.
- Le système parasympathique (PS) médié par l’acétylcholine qui vise au maintien des fonctions organique et à la conservation d’énergie.
- Le système sympathique (S) médié par la noradrénaline qui est destiné à produire une réponse au stress.
- C’est l’équilibre entre ces deux systèmes qui permet une réaction rapide à l’environnement.
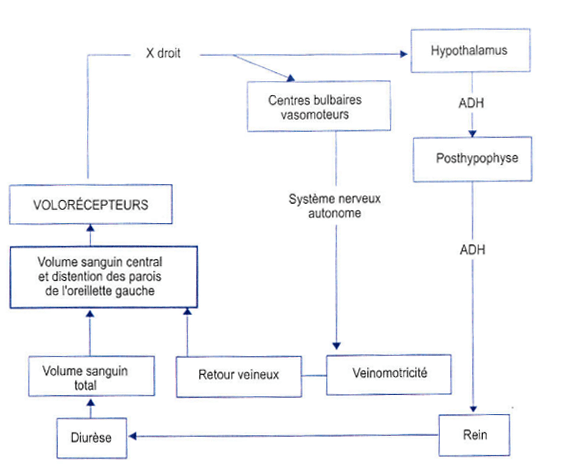
c) les volorécepteurs
- Sont situés dans les parois des systèmes à basse pression (oreillettes et circulation pulmonaire).
- Répondent à des variations de volume et sont sensibles à la déformation de la paroi dans lesquels ils se trouvent.
- Le réflexe est semblable à celui des barorécepteurs.
- Lorsqu’ils sont stimulés par une distension de la paroi liée à une augmentation du volume sanguin, ces récepteurs informent le système nerveux central par des afférences empruntant le nerf vague et ils initient un réflexe dans lequel l’activité sympathique est réduite.
- En conséquence, la pression artérielle diminue par diminution des effets inotrope et chronotrope positifs du sympathique sur le cœur et par réduction du niveau de contraction des muscles lisses vasculaires.
- Ils sont également le point de départ de la régulation hormonale.
2) Régulation à moyen terme
La régulation à moyen terme se fait au travers du système catécholaminergique et du système rénine–angiotensine.
a) Système catécholaminergique
- La médullo-surrénale y tient une place centrale par excrétion plasmatique d’hormone de type catécholamine (adrénaline et noradrénaline) au travers de la stimulation sympathique.
- La durée d’action est plus longue et plus stable que par la stimulation directe du système nerveux sympathique.
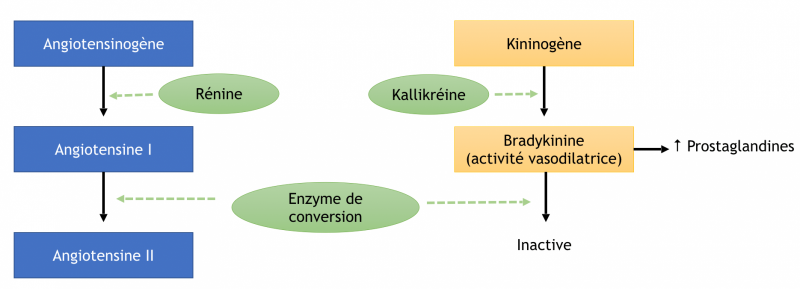
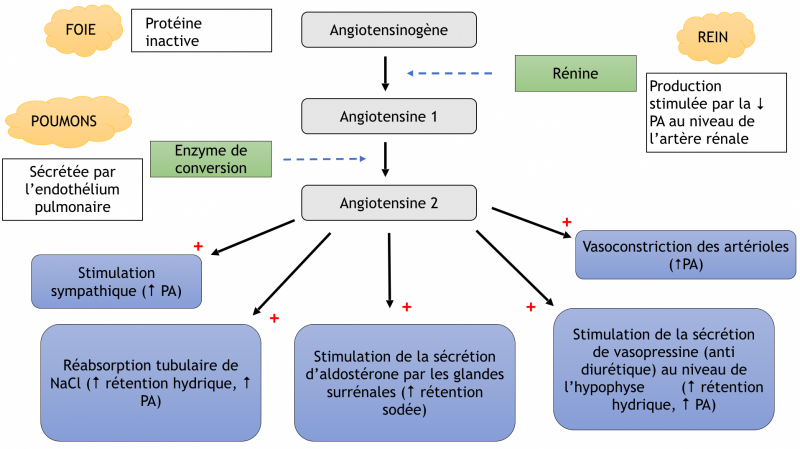
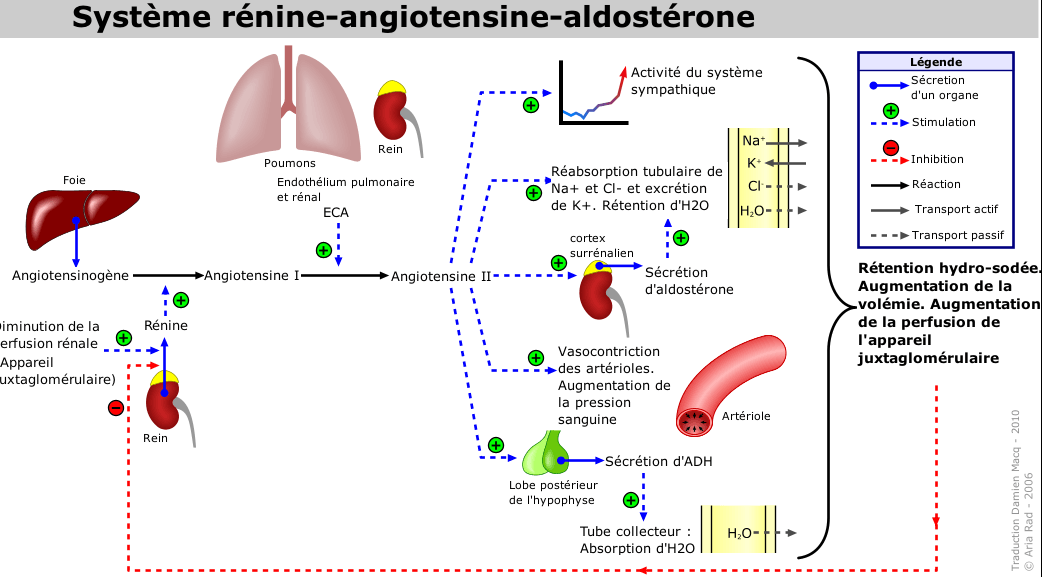
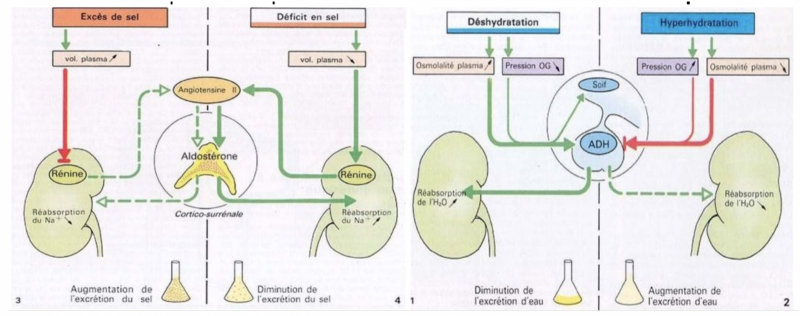
b) Système rénine angiotensine aldostérone (SRA)
- Le système rénine-angiotensine-aldostérone désigne un système hormonal localisé dans le rein et dont le rôle est de maintenir l’homéostasie hydrosodée.
- Ce système joue un rôle prépondérant dans la régulation de la pression artérielle. En particulier par l’action de l’angiotensine II, un peptide formé suite à une cascade de réactions enzymatiques
- La rénine circulante provenant des cellules juxta‐glomérulaires rénales agit sur l’angiotensinogène produit par le foie pour produire de l’angiotensine I.
- L'angiotensine I est convertie à son tour en angiotensine II par l’enzyme de conversion de l’angiotensine endothéliale pulmonaire et circulante.
- L’angiotensine II est alors distribuée dans les organes via le courant sanguin et induit des réponses physiologiques
c) Enzyme de conversion de l'angiotensine (ECA)
- Elle est présente principalement sur la surface membranaire des cellules endothéliales, en particulier du lit vasculaire pulmonaire, mais peut être retrouvée dans le plasma.
- Il s’agit d’une enzyme non spécifique, dont les substrats principaux sont l’angiotensine I et la bradykinine (d’action vasodilatrice).
- L’ECA a pour rôle physiologique de contribuer de façon majoritaire à la clairance plasmatique de l’angiotensine I.
- Les effets de l’angiotensine II s’exercent sur des récepteurs transmembranaires couplés à des protéines G.
- Les deux sous‐types de récepteurs sont les récepteurs AT1 (forte affinité) et AT2 (faible affinité).
d) Effets physiologiques
- L’effet principal du système rénine‐angiotensine est d’assurer la régulation de la pression artérielle
- L’angiotensine II a un effet vasoconstricteur très puissant.
e) Les mécanismes responsables de l’augmentation des résistances artérielles périphériques induite par l’angiotensine II sont :
- Une vasoconstriction directe, générale, mais plus puissante au niveau rénal,
- Une augmentation de la neurotransmission adrénergique,
- Une augmentation des décharges sympathiques liée à un effet direct sur le système nerveux central,
- Une libération d’adrénaline par la médullosurrénale
3) Régulation à long terme
Elle est représentée par la natriurèse et l’hormone anti-diurétique
a) Natriurèse de pression
- La régulation à long terme de la volémie se fait par le phénomène dit de natriurèse de pression qui correspond à une excrétion d’ions sodium par le rein en cas de surcharge de pression.
- Toute augmentation de la pression artérielle est suivie d’une augmentation de l’excrétion de sodium par le rein.
- Cette augmentation de l’excrétion de sodium a pour effet de réduire la volémie donc le débit cardiaque et donc la pression artérielle.
- Cette augmentation de l’excrétion de sodium dure tant que la pression n’est pas revenue à son niveau initial.
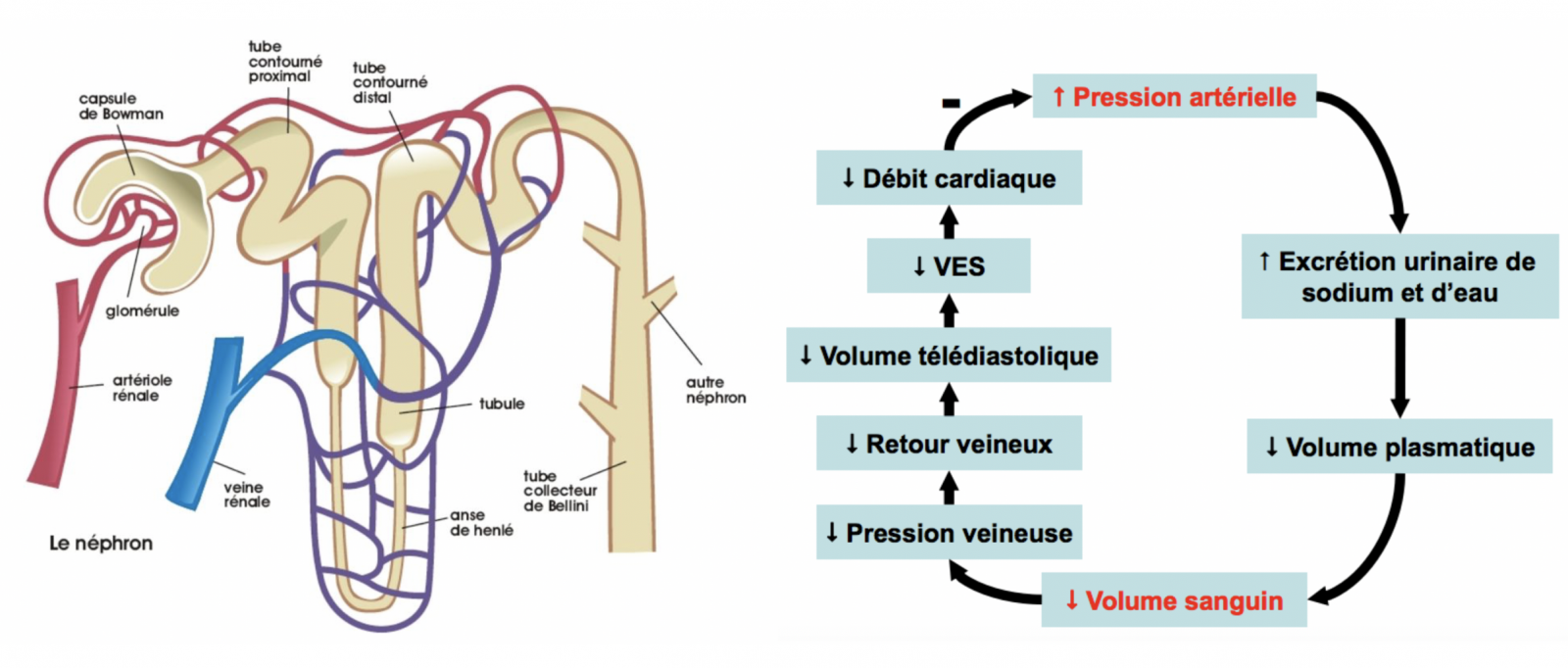
- La natriurèse de pression est régulée par la sécrétion d’aldostérone. Celle-ci est dépendante de la sécrétion de rénine par action de l’angiotensine II sur la cortico-surrénale.
- Elle a pour effet la réabsorption de sodium au niveau tubulaire entraînant par effet osmotique un mouvement d’eau en cas d’hyponatrémie.
- A l’inverse, en cas d’hypernatrémie une diminution de la sécrétion d’aldostérone par la cortico-surrénale est responsable d’une augmentation de l’excrétion tubulaire de sodium.
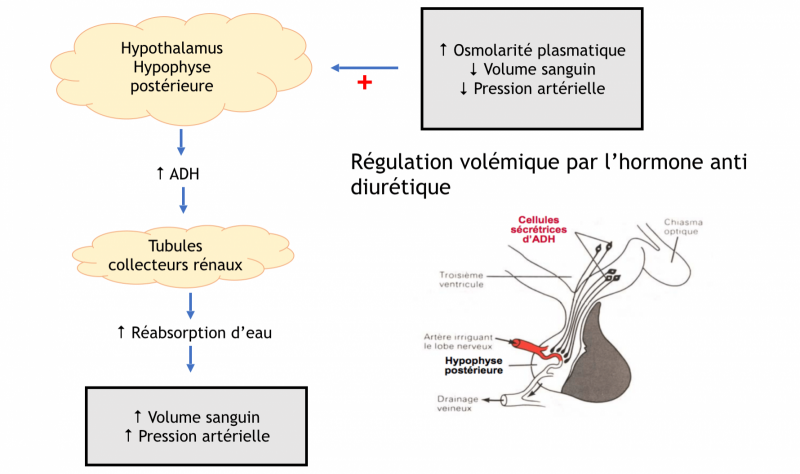
b) Hormone anti-diurétique
- Elle est synthétisée par les noyaux supra-optiques et paraventriculaires de l'hypothalamus.
- Elle est libérée dans le sang au niveau de l’hypophyse postérieure (ou neurohypophyse) lors de la stimulation des neurones hypothalamiques.
- La sécrétion d’ADH est régulée par les variations de l’osmolarité plasmatique (de l’ordre de 1 %) et du volume plasmatique (entre 10 à 15 %).
- L’ADH agit sur les cellules principales du canal collecteur (rénal) par fixation à ses récepteurs spécifiques V2 à leur pôle basal. Cette fixation entraîne l’expression à la membrane apicale de canaux à eau, les aquaporines de type 2. L’ADH permet ainsi de faire varier finement la perméabilité du canal collecteur à l’eau.
- Si la concentration en eau diminue : DIMINUTION DU VOLUME SANGUIN = DIMINUTION DE LA PA = DIMINUTION DU VOLUME URINAIRE → SÉCRÉTION DE L’ADH
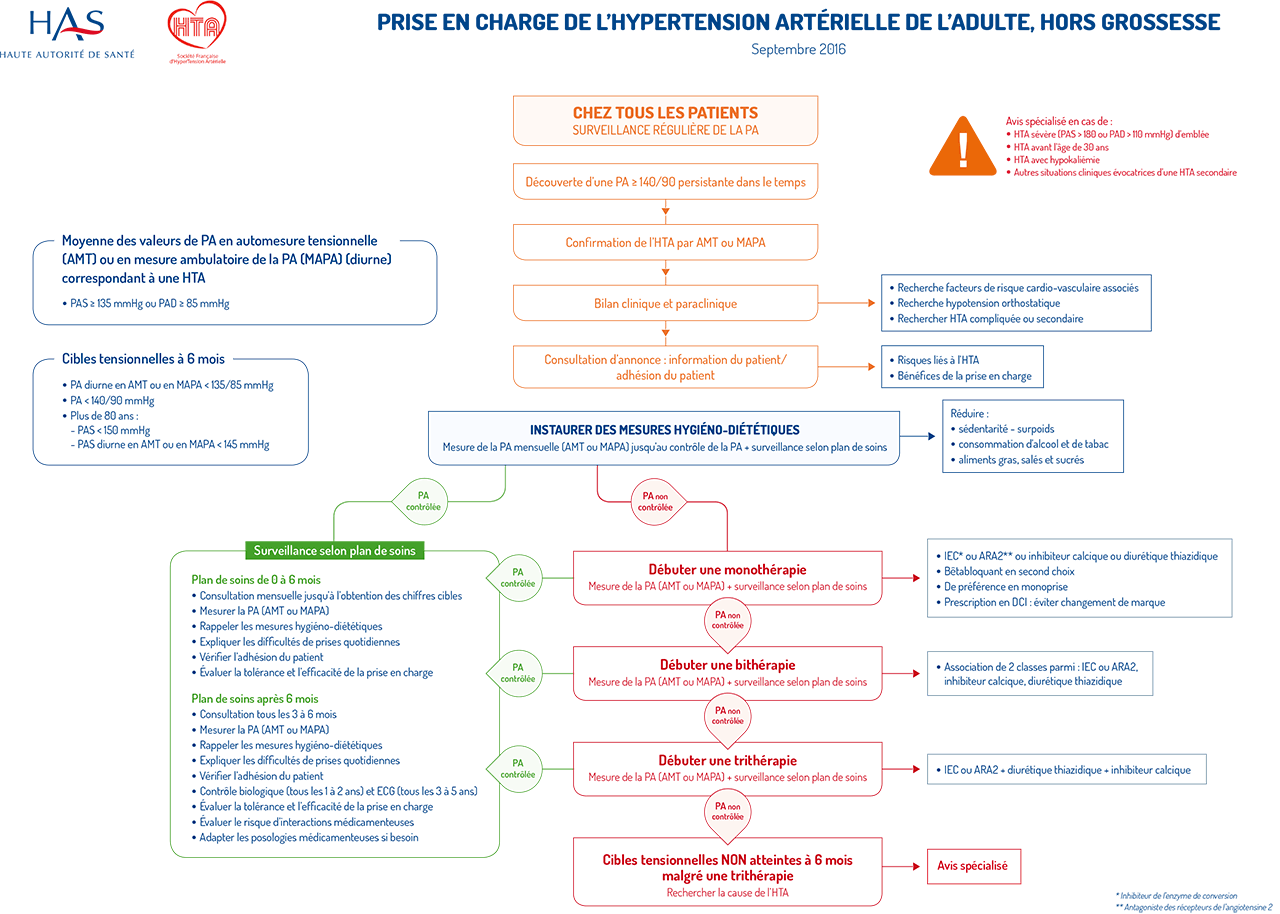
DÉPISTER ET CONFIRMER L’HTA
L’évaluation initiale d’un patient hypertendu a pour objectifs :
- de dépister et confirmer l’HTA
- d'établir une consultation d’information et annonce
- de réaliser un bilan initiale systématique
- de dépister une HTA secondaire et/ou des facteurs aggravants
- d'évaluer le risque cardio-vasculaire (RCV) par : la recherche d’autres facteurs de risque cardiovasculaire, d’une atteinte des organes cibles et de pathologies associées.
A) Dépistage de l’hypertension artérielle
1) Modalités du dépistage :
-
L’hypertension est en général asymptomatique. Vu sa haute prévalence dans la population, il est indispensable de la rechercher surtout si les patients présentent d’autres facteurs de risque cardiovasculaires ou ont eu des problèmes cardiaques ou vasculaires.
-
Il est recommandé que le médecin généraliste mesure régulièrement la PA de ses patients afin de dépister précocement l’apparition d’une HTA et surveiller l’évolution des chiffres tensionnels chez un patient hypertendu. D’autres professionnels de santé sont encouragés à participer à ce dépistage et à cette surveillance en mesurant la PA des patients : médecins spécialistes, médecins de santé au travail, pharmaciens d’officine, infirmiers. 1
-
La mesure de la PA doit être répétée au moins tous les 5 ans si la PA est dite optimale, tous les 3 ans si la PA est normale, et tous les ans si la PA est normale-haute (I,C). Chez les patients de plus de 50 ans, un dépistage plus fréquent de la pression artérielle au cabinet doit être envisagé (IIa, C).1
-
La constatation de chiffres de PA ≥ 140/90 mmHg par ces professionnels de santé nécessite que le patient soit orienté vers son médecin traitant.
2) Technique de mesure de la PA au cabinet médical:
Afin d’assurer un maximum de reproductibilité la mesure doit être standardisée :
-
Utiliser de préférence un appareil au bras, électronique et validé. (liste des appareils validés sur ANSM)
-
Effectuer les mesures dans un environnement calme et sans parler, chez un patient en position assise ou allongée, au repos durant au moins 3 à 5 min avant prise tensionnelle.
-
Lors de la première consultation, il est recommandé de mesurer la tension artérielle (TA) au minimum aux deux bras. Il faut prendre en compte la mesure la plus élevée. S’il existe une différence persistante et significative de la pression artérielle systolique entre les deux bras supérieure à 15 mmHg alors il y a une augmentation du risque cardiovasculaire, le plus souvent du à une maladie vasculaire athéromateuse.
-
À chaque consultation, trois mesures de PA doivent être enregistrées, espacées de 1 à 2 minutes, et des mesures supplémentaires doivent être effectuées si les deux premières lectures diffèrent de > 10 mmHg (I,C). La valeur la plus élevée est retenue.1
-
Brassard adapté à la taille du bras, au niveau du cœur, avec appui du dos et du bras pour éviter la contraction du muscle pendant la prise tensionnelle.
-
Chez tous les patients la recherche de l’hypotension orthostatique devrait être réalisée par la mesure de la pression artérielle à une minute et trois minutes après être passés de la position allongée à la position debout.
-
Idéalement, il faut prendre également la fréquence cardiaque et le pouls à la recherche d’une arythmie.
B) Confirmation diagnostique de l’HTA
1) La confirmation du diagnostic est la règle
a) Au cabinet :
-
Le diagnostic devra être confirmé par plusieurs prises de mesures au cabinet lors de consultations différentes.
-
L'HTA est définie de manière consensuelle comme une PA ≥ 140/90 mmHg mesurée en consultation et persistante dans le temps.
-
Le diagnostic peut être posé dès la première consultation en cas d’HTA sévère d’emblée (≥ 180 mmHg de PAS ou 110 mmHg de PAD).
b) Au domicile :
-
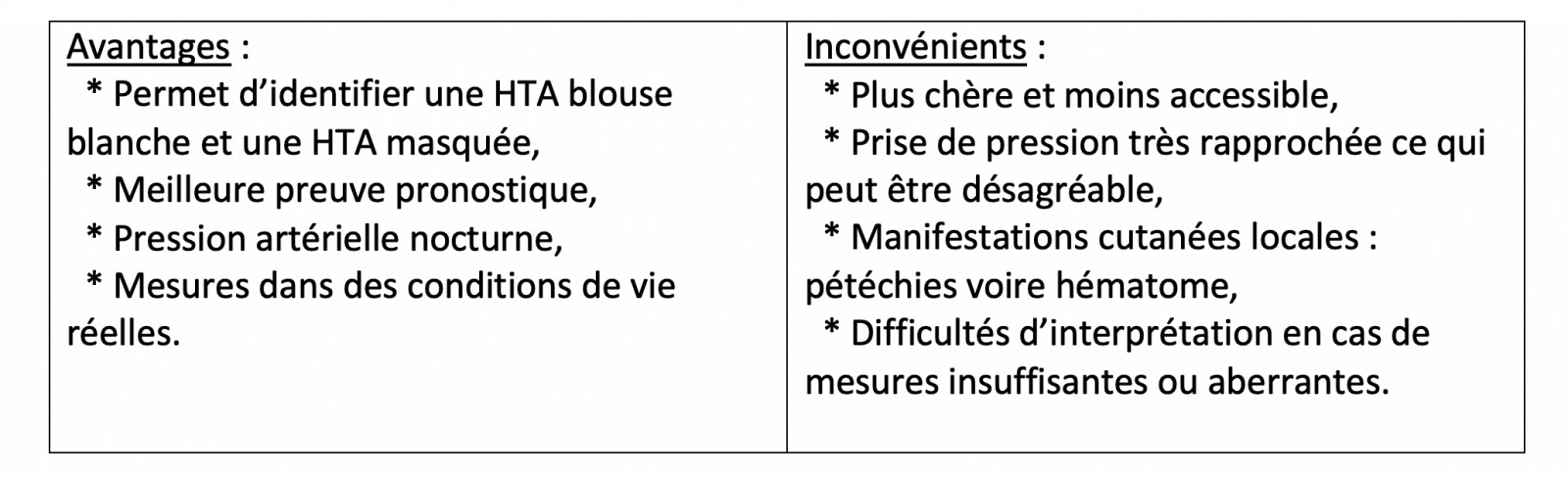
Sauf HTA sévère (grade 3 : PAs ≥ 180 mmHg et/ou PAd ≥ 110 mmHg), les dernières recommandations de la Société Française d'HTA insistent sur la nécessité de réaliser désormais une mesure ambulatoire de la PA (MAPA) ou une auto-mesure tensionnelle (AMT) à domicile afin de diagnostiquer de manière certaine l'HTA et de s'affranchir de l'effet « blouse blanche ».
-
L’AMT est plus adaptée aux soins primaires et permet l’implication du patient dans sa prise en charge, cependant, la MAPA apporte des informations complémentaires dans certaines situations (exploration d’une variabilité tensionnelle importante, suspicion d’absence de baisse tensionnelle nocturne ou d’une dysautonomie, etc.).1

2) Méthodes de mesure de la PA
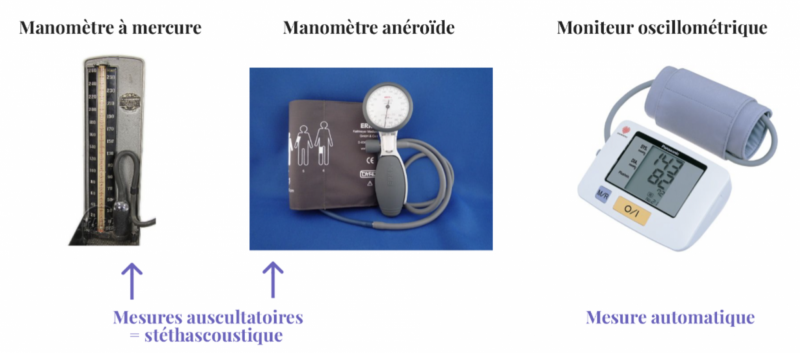
a) Méthode stéthascoustique ou auscultatoire
-
Méthode historique avec l’emploi d’un sphygmomanomètre à mercure équipé d’un brassard huméral.
-
Le brassard est mis en place sur un bras sans vêtement après repérage par palpation de l’artère humérale.
-
Le bord inférieur du brassard est situé au moins à 2,5 cm (soit deux travers de doigt) au-dessus de la fossette anté-cubitale. Le pavillon du stéthoscope ne doit pas toucher le brassard, afin d’éviter la perception de bruits parasites, et encore moins être glissé au-dessous. Il doit être posé sur le battement artériel huméral en appuyant le moins possible.
-
L’usage du sphygmomanomètre à mercure demande quelques précautions : colonne à mercure verticale ; pas de dépôt de mercure le long de la colonne ; niveau du mercure au zéro avant gonflage. L’observateur doit être entrainé pour bien entendre les bruits faibles et avoir une bonne acuité visuelle pour lire précisément le niveau du mercure sur le tube gradué de la colonne.
-
Les appareils à mercure, de moins en moins utilisés, sont appelés à disparaître pour des raisons d’ordre écologique (dangerosité du mercure) au profit de la méthode oscillométrique.
b) Méthode sphygmomanométrique
-
Les sphygmomanométres anéroïdes sont quant à eux moins utilisés en raison du risque de dérèglement progressif (les étalonner très régulièrement).
-
Plusieurs enquêtes, menées en ville comme en milieu hospitalier, montrent la trop grande fréquence d’un entretien insuffisant du matériel, source d’erreurs d’appréciation du niveau tensionnel mesuré par les sphygmomanomètres défectueux.
c) Méthode oscillométrique
-
Elle est de plus en plus utilisée tant en pratique courante que dans le cadre des essais cliniques. La liste des appareils validés est fournie par l’ANSM. (liste des appareils validés sur ANSM)
-
Les appareils dont on se sert en milieu hospitalier devraient avoir fait l’objet d’une validation, ce qui n’est pas toujours le cas.
-
Lors du dégonflage du brassard, un capteur mesure l’oscillation de plus grande amplitude (qui correspond à la PA moyenne) et recalcule, à partir d’un algorithme, les PA systolique (PAS) et diastolique (PAD).
-
Ces appareils électroniques sont semi-automatiques. Comme pour les autres appareils, ils nécessitent une vérification périodique et une recalibration éventuelle.
-
Ces appareils ne sont plus fiables en cas d’arythmie ou pour une circonférence de bras > 32 cm.
3) Mesures à domicile
-
La mesure en dehors du cabinet reflète de manière plus précise la pression artérielle du patient et la charge tensionnelle à laquelle il est soumis dans ses conditions de vie réelles.
-
De ce fait la pression artérielle mesurée en ambulatoire ou à domicile est mieux corrélée à l’atteinte des organes cibles(microalbuminurie, hypertrophie ventriculaire gauche) et prédit mieux le risque de décès cardio vasculaire que la pression de consultation.
-
Les résultats donnés par les méthodes ambulatoires peuvent diverger de la pression de consultation, identifiant ainsi l’hypertension blouse-blanche et l’hypertension masquée.
-
Par ailleurs, la mesure en ambulatoire permet de dépister les patients dont la PA ne diminue pas la nuit (sujets non dippers) ; ils seraient à plus grand risque cardiovasculaire.
-
Les mesures en dehors du cabinet comprennent : Auto Mesure de la Tension (AMT) et Mesure Ambulatoire de la Pression Artérielle (MAPA)
Il est recommandé de réaliser des mesures en dehors du milieu médical :
-
avant de débuter un traitement antihypertenseur (Classe 1, Niveau A) afin de confirmer le diagnostic.
-
avant de modifier la posologie du traitement antihypertenseur (Classe 1, Niveau B).
-
en cas de suspicion d’HTA résistante pour éliminer un effet blouse blanche (Classe 1,Niveau A).
-
avant une consultation dans le cadre du suivi de l’hypertension artérielle traitée (Classe 1, Niveau B).
-
dans le suivi des patients ayant une HTA blouse blanche pour dépister l’apparition d’une HTA permanente (Classe 1, Niveau B).1
a) Automesure tensionnelle (AMT)
-
Il est suggéré de préférer l’automesure à la MAPA pour des raisons pratiques (plus adaptée en soins primaires et favorise l’implication du patient dans sa prise en charge) sauf indications spécifiques (Classe 2, Niveau C).
-
Il est suggéré d’utiliser l’automesure en sollicitant des aides ou des supports (Classe 2, Niveau B).1
-
Il est souhaitable d’interroger systématiquement les patients sur leur équipement (qui doit être validé), leur pratique et leurs résultats. De fait, l’automesure fait partie intégrante de l’éducation thérapeutique, notamment en vue d’améliorer l’observance.
-
Le patient doit être éduqué par son médecin ou par un professionnel de santé entraîné.
-
L’interprétation de l’automesure demeure un acte médical.
+ L’éducation à la technique de mesure est indispensable et doit porter sur :
-
La signification des termes «systolique» et «diastolique», les définitions de la pression artérielle normale et de l’hypertension.
-
Utiliser un appareil validé et de préférence avec un brassard huméral.
-
Former le patient à la technique de l’automesure tensionnelle (et si besoin son entourage).
-
Prendre les mesures en position assise, au repos avec l’avant-bras posé sur la table, le poing non serré et le brassard à hauteur du cœur.
-
Effectuer 3 mesures le matin avant le petit déjeuner et la prise de médicaments, 3 mesures avant le coucher, 3 jours de suite (« règle des 3 »), en espaçant les mesures de quelques minutes.1
-
Etre dans un environnement calme depuis au moins 5 min, ne pas avoir pris d’excitants (tabac, café) juste avant la prise tensionnelle, avoir un brassard adapté à la taille de son bras.
-
La pression artérielle retenue est la moyenne d’au moins 12 mesures de pressions prises pendant au moins trois jours consécutifs avant la visite médicale.
-
Les valeurs de pression cibles à atteindre sous traitement.
-
La restitution des résultats des mesures au médecin.
-
Il est recommandé de remettre au patient une documentation. Des outils d’enseignement conformes aux recommandations et testés auprès des patients (livrets, vidéos, didacticiels, formulaire de restitution des résultats avec calcul automatique des moyennes) sont disponibles sur le site Internet www.automesure.com.
-
Il faut conseiller au patient d’enregistrer, d’imprimer ou de noter toutes les mesures faites, sans sélection, et d’en calculer la moyenne.
- Les pressions sont généralement plus basses qu’en cabinet ce qui conduit à un seuil plus bas pour le diagnostic d’hypertension : le diagnostic d’HTA est retenu pour des valeurs moyennes de PAS ≥ 135 ou PAD ≥ 85 mmHg.


b) Mesure Ambulatoire de PA (MAPA)
-
Cette technique nécessite la mise en place d’un boitier avec brassard huméral.
-
La pose de l’appareil peut être faite par un technicien ou une infirmière après une formation, mais l’analyse et l’interprétation restent du domaine du médecin.
-
Installer le brassard au bras opposé au côté dominant et utiliser un brassard de taille adaptée au bras du sujet. Rappelons que la méthode est déconseillée chez les arythmiques.
-
Les mesures doivent être programmées toutes les quinze minutes dans la journée et toutes les vingt à trente minutes la nuit.
-
Les données enregistrées dans le boitier sont ensuite analysées par un programme informatique pour déterminer séparément les valeurs moyennes diurnes, nocturnes et des 24 heures.
+ Indications spécifiques de la MAPA :
-
Appréciation du cycle nycthéméral.
-
Devant la constatation d’une PA normale et d’une atteinte des organes cibles.
-
Patients atteints d’un syndrome d’apnées du sommeil
-
HTA résistante.
-
Différence marquée entre les mesures de PA au cabinet et les auto-mesures.
-
Dans les cas où l’automesure n’est pas réalisable
-
Appréciation des variations tensionnelles en cas de symptômes évoquant des poussées tensionnelles ou, à l’inverse en cas de suspicion d’hypotension artérielle.
+ De même que pour la mesure à domicile, l’information et l’éducation sont primordiales pour les mesures en ambulatoires. Il faut expliquer au patient :
-
La fréquence des mesures,
-
Ne pas bouger le bras pendant la mesure,
-
Continuer ses activités normalement en dehors des prises tensionnelles,
-
Noter ses activités (sport, repas),
-
Noter ses heures de coucher et lever,
-
Noter l’heure des prises des médicaments et leur type.
+ Les seuils de PAs et PAd définissant une HTA par la MAPA sont plus bas que ceux fixés pour la mesure au cabinet médical. On considère qu'il existe une HTA si :
-
MAPA moyenne des 24 heures ≥ 130 et/ou 80 mmHg
-
MAPA éveil (diurne) ≥ 135 et/ou 85mmHg
-
MAPA sommeil ≥ 120 et/ou 70 mmHg

4) HTA blouse blanche :
-
Elle se définit par la présence d’une HTA lors de la prise en cabinet alors que la tension est normale en ambulatoire / à domicile.
-
La prévalence de l’HTA blouse-blanche varie entre 20 à 30 % en population générale. On la trouve surtout chez les personnes âgées, les femmes et les non fumeurs.
-
L’HTA blouse blanche ne requiert habituellement pas le recours à un traitement antihypertenseur.
-
Chez ces patients, le risque d’évoluer vers une HTA permanente est supérieur à celui de la population générale. Il est donc recommandé de surveiller étroitement leur pression artérielle les 3-6 premiers mois au début, puis tous les ans.
-
En cas de facteur de risque il y a un intérêt à appliquer des mesures hygiéno-diététique.
-
Le pronostic cardiovasculaire de l’HTA blouse-blanche est proche de celui des sujets normotendus.
5) HTA masquée :
-
Présence d’une hypertension artérielle quand la mesure est prise à domicile ou en ambulatoire mais normale lorsqu’elle est prise en cabinet.
-
La prévalence de l’HTA masquée est de l’ordre de 10 à 20 % en population générale étiquetée «normotendue» par la mesure clinique. Elle atteint 50 % chez les sujets traités pour hypertension (prise de traitement avant consultation).
-
Surtout chez les jeunes, fumeurs, hommes, alcoolique.
-
Il est suggéré de considérer chez l’hypertendu traité une HTA masquée comme une HTA non contrôlée, et d’adapter le traitement anti- hypertenseur en conséquence (Classe 2, Niveau C).1
-
L’HTA masquée est associée à une plus grande fréquence des autres facteurs de risque cardiovasculaire et d’atteinte des organes cibles.
C) Consultation d’information et annonce
-
La prise en charge d’un patient hypertendu nécessite une information et un temps éducatif qui se font au mieux dans le cadre d’une consultation dédiée et valorisée.
-
Cette consultation permet d’informer le patient des risques liés à l'HTA, des bénéfices démontrés du traitement antihypertenseur, de fixer les objectifs du traitement, et d’établir un plan de soins. La décision médicale partagée entre le médecin et son patient favorise l’adhésion du patient à sa prise en charge.1
-
Il est recommandé que des mesures hygiéno-diététiques soient initiées dès cette consultation. En fonction du profil du patient, de la sévérité de son HTA, de ses préférences et de son adhésion à ces mesures, le délai de mise en route du traitement médicamenteux sera adapté pour atteindre l’objectif d’une PA contrôlée à 6 mois.
-
Au cours des 6 premiers mois, des consultations médicales mensuelles sont recommandées jusqu’à obtention du contrôle tensionnel pour évaluer la tolérance et l’efficacité du traitement, renforcer l’éducation et parfaire l’information du patient.1
-
De nombreuses brochures, vidéo ou sites internet ainsi que des témoignages permettent une information du patient. Il ne faut pas hésiter à y avoir recours et à donner l’occasion au patient de poser ses questions : Exemple de clip vidéo éducation réalisé par le club des jeunes hypertensiologues sur la diapositive suivante
-
L’investissement du patient dans sa maladie est primordiale dans le cas de cette maladie chronique.
RÉALISER UN BILAN INITIAL SYSTÉMATIQUE
Les examens complémentaires recommandés dans le cadre du bilan initial :1

Il sera complété par :
-
Recherche du rapport albumine/créatinine urinaire en cas de protéinurie négative chez le patient diabétique et hypertendu.
-
Par une recherche des troubles cognitifs chez le patient de plus de 75 ans par la réalisation du mini mental state examination (MMSE).
-
La découverte de trouble cognitif devra faire réaliser un bilan adapté.
DÉPISTER UNE HTA SECONDAIRE ET/OU DES FACTEURS AGGRAVANTS
A) Epidémiologie et définition
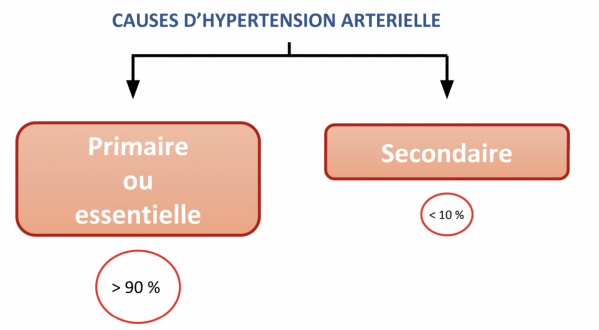
- Elle représente 5 à 10 % des patients hypertendus.
- Elle est due à une cause identifiable et donc potentiellement réversible.
- Le dépistage d’une hypertension artérielle secondaire chez tous les patients hypertendus n’est pas applicable en pratique quotidienne et serait beaucoup trop coûteux. En revanche, certains éléments doivent faire suspecter une hypertension artérielle secondaire.
B) Eléments d’orientation
Une HTA secondaire doit être recherchée devant les éléments suivants :

Signes cliniques évocateurs d'une HTA secondaire :
- ATCD personnels et familiaux de maladie rénale ou cardio-vasculaire.
- Prise de toxique, médicaments, alcool, ou consommation abondante de glycyrrhizine (réglisse, pastis sans alcool)
- Intoxication alcoolique (L’effet de l’alcool sur la pression artérielle est dose-dépendant)1 et tabagique (Chaque cigarette entraine, chez le fumeur, une élévation de la pression artérielle durant une période de 20 à 40 minutes)1
- Recherche d’hyperaldostéronisme : hypokaliémie évocatrice
- Recherche phéochromocytome : triade de Ménard (Céphalées + sueurs + palpitations).
- Recherche de signes cutanés de neurofibromatose (phéochromocytome) : taches café au lait, neurofibromes, lentigines (taches de rousseur) dans les aisselles et les creux inguinaux, gliome du chiasma optique, nodules iriens de Lisch.
- Recherche d'une cause endocrinienne.
- Recherche d'un SAHOS (syndrome d’apnées-hypopnées obstructives du sommeil).
- Recherche d'un souffle lombaire à la recherche d’une sténose artérielle rénale.
- Recherche d'un souffle cardiaque à l'auscultation et comparaison du pouls radial avec le fémoral, de la tension artérielle aux membres supérieurs et inférieurs pour détecter la différence radio-fémoral: coarctation aortique, maladie aortique.
C) Principales étiologies
- Prise de toxique et médicaments
- Néphropathies parenchymateuses
- HTA rénovasculaires : athérosclérose rénale et dysplasie fibromusculaire
- Syndrome d’apnées du sommeil
- Hyperaldostéronisme primaire = syndrome de Conn
- Phéochromocytome
- Autres causes endocriniennes : Syndrome de Cushing, hyperparathyroïdie, hyperthyroïdie, hypothyroïdie
- Coarctation de l’aorte
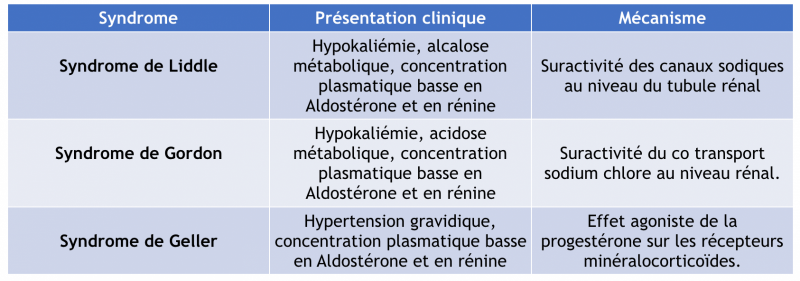
- Causes génétiques rares : syndrome de Liddle, syndrome de Gordon, syndrome de Geller
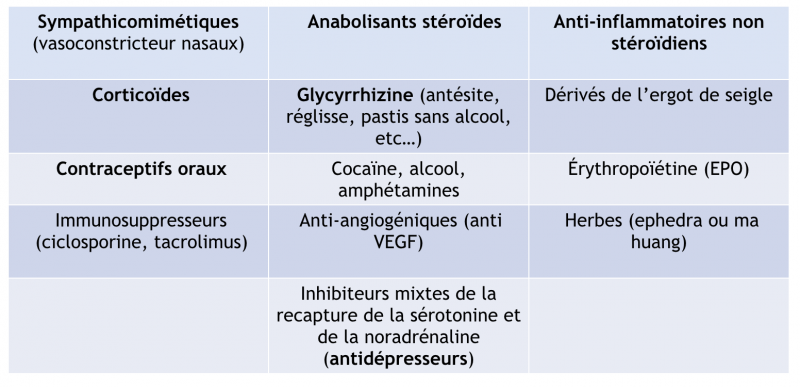
1) Médicaments et toxiques
Leur consommation doit être recherchée systématiquement. Elle peut être à l’origine d’une HTA ou aggraver une HTA essentielle.
2) Cause génétique
- Souvent dans le cadre d’antécédent familiaux et secondaire à une mutation monogénique
- Elles sont rares mais peuvent nécessiter un traitement spécifique.
- Leur recherche peut être proposée dans des centres spécialisés devant des tableaux évocateur mais n’est pas recommandée en routine.
3) Néphropathies parenchymateuses
- Fréquence : > 5 à 10 %, première cause d'HTA secondaire
- Causes : glomérulopathies chroniques (notamment diabétique) et polykystose rénale représentent les causes les plus fréquentes d’HTA secondaire.
- Eléments de présomption : très souvent asymptomatiques, masses abdominale, diabète, hématurie, protéinurie, anémie.
- Moyens d’explorations : bilan biologique rénal complet (créatininémie, clairance de la créatinine mesurée ou calculée, albuminurie, micro albuminurie, protéinurie …) et échographie abdominale (taille des reins, contour, épaisseur corticale, obstacle sur les voies excrétrices ou tumeurs, recherche de kyste).
4) Hypertension réno-vasculaire
- Fréquence : 5%
- Causes : secondaire à une sténose athéromateuse des artères rénales ou à une dysplasie fibromusculaire artérielle.
- Eléments de présomption : Patient présentant une artériopathie oblitérante des membres inférieurs (patients Agés), sexe féminin pour la dysplasie, fumeurs, diabétiques, histoire d’AOP flash, thrill vasculaire abdominal à l’auscultation. La très bonne réponse au traitement par IEC ou ARA 2 peut orienter également.
-
Moyens d'exploration :
-
Echographie rénale : une différence de plus de 1,5 cm entre les deux reins est retrouvée dans 60–70 % des cas. -
Echo-doppler des artères rénales : le doppler couleur permet le diagnostic de sténose de l’artère rénale et détermine un index de résistance utile dans la discussion d’une éventuelle angioplastie.
-
Scanner ou angio IRM des artères rénales : confirme le diagnostic
-
Artériographie : reste le gold standard, elle n’est réalisée que dans l’idée de pratiquer une angioplastie.
-
- Traitement : Traitement médicamenteux de l'HTA +/_ revascularisation par angioplastie avec pose de stent.
5) Syndrome d’apnée du sommeil
- Fréquence : 30% des hypertendus ont un SAS et 60% des patients souffrant d’un SAS ont une hypertension.
- Origine : Le SAOS est lié à la présence d’une obstruction intermittente et répétée des voies aériennes supérieures (obésité, rétrognathie, macroglossie ..) pendant le sommeil ce qui entraine des épisodes répétés de collapsus complets (apnées) ou incomplets (hypopnées). Le SAS est associé à un risque accru d’accidents cardiovasculaires, en particulier coronarien.
- Eléments de présomption : Le SAS est évoqué devant une obésité, des ronflements sévères et quotidiens, une sensation d’étouffement ou de suffocation pendant le sommeil, des éveils nocturnes fréquents, un sommeil non réparateur, des difficultés de concentration, une nycturie (plus d’une miction par nuit), une somnolence diurne, des céphalées matinales, une HTA avec disparition de la chute tensionnelle nocturne (non dippers).
- Diagnostic : Polysomnographie avec mesure de l’index d’apnées et hypopnées (IAH : nombre d’apnées et d’hypopnées par heure de sommeil) ≥ 5 . La sévérité du SAOS est basée sur l'IAH. On parle de SAOS sévère pour un IAH ≥ 30.
- Traitement : Pression positive continue nocturne, mesures hygiéno diététiques, orthèses mandibulaires...
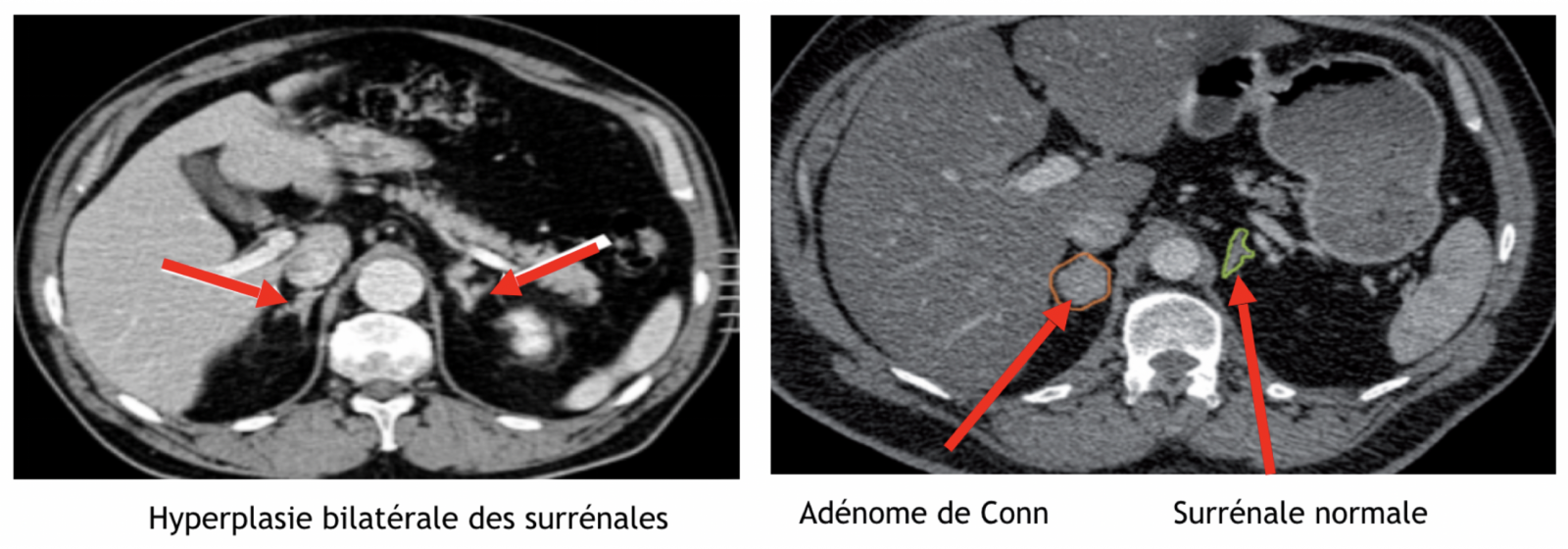
6) Hyperaldostéronisme primaire ou syndrome de Conn
- Fréquence : environ 1 % des HTA.
- Origine : sécrétion inappropriée d'aldostérone par les corticosurrénales, secondaire soit à un adénome de Conn (30%) soit à une hyperplasie bilatérale des surrénales (70%) soit à un corticosurrénalome (rare).
- Eléments de présomption : hypokaliémie avec élévation de la réserve alcaline > 30 mmol/l, accompagnée ou non de signes cliniques car souvent a- ou pauci-symptomatique (asthénie, faiblesse ou crampes musculaires, polyurie ou polydipsie), hyperkaliurèse.
- Diagnostic : (adresser le patient à l’endocrinologue) : L'arrêt de tout traitement anti-hypertenseur ayant une action sur le système rénine angiotensine-aldostérone (IEC, ARA 2, diurétiques et béta bloquants) doit être réalisé depuis au moins 15 jours et des anti aldostérones depuis 6 semaines pour la réalisation de dosages hormonaux :
- Aldostérone et rénine plasmatiques : après une heure d’orthostatisme actif et après une heure couché (rapport aldostérone/rénine augmenté)
- Aldostéronurie et créatininurie sur 24 heures
- Kaliémie (hypokaliémie)
- Imagerie : par réalisation d’un scanner abdominal essentiellement, possibilité de réalisation d’un cathétérisme des veines surrénales (rare).
- Traitement : Chirurgical en cas d’origine tumorale ou médical de première intention par spironolactone si hyperplasie bilatérale.
7) Phéochromocytome
- Fréquence : très rare, environ 0,1 %.
- Origine : sécrétion anormale d'adrénaline et/ou de noradrénaline par la médullosurrénale. Plusieurs affections familiales sont associées au phéochromocytome devant faire proposer aux patients et à leur famille des tests génétiques (néoplasie endocrine multiple de type 2, maladie de Von Hippel-Lindau, neurofibromatose de type 1, paragangliomes familiaux).
- Eléments de présomption : triade classique de Ménard associant céphalées, sueurs, palpitations. Egalement : crises hypertensives spontanées ou déclenchées, HTA permanente, hypotension orthostatique, perte de poids, hyperglycémie, complications neurologiques ou vasculaires.
- Diagnostic : il passe par un bilan hormonal qui pourra être réalisé par le spécialiste : Dosage des dérivés méthoxylés de l’adrénaline et de la noradrénaline dans les urines sur 24 heures ou plasmatiques, dosage des catécholamines dans les urines. Parallèlement enregistrement de la PA sur 24 heures pour s'assurer de la présence de valeurs de pression artérielle élevées ou de poussées tensionnelles.
- Localisation de la tumeur : échographie abdominale, scanner ou IRM surrénalien, scintigraphie à la méta-iodo-benzyl -guanidine (pour les phéochromocytomes extra surrénaliens et localiser d’éventuelles métastases)
- Traitement : Chirurgical (tumorectomie) avec préparation préopératoire (alpha-bétabloquants, correction de l’hypovolémie) qui permet une guérison définitive en cas de tumeur bénigne. Souvent associé à un traitement médical symptomatique des accès hypertensifs.
- Aucun élément clinique ou paraclinique (histologie) ne permet d'affirmer le caractère bénin de la tumeur.
- Une surveillance clinique (pression artérielle) et paraclinique (dérivés méthoxylés) systématique, au moins annuelle s'impose donc devant le risque de métastases et de récidive à distance.
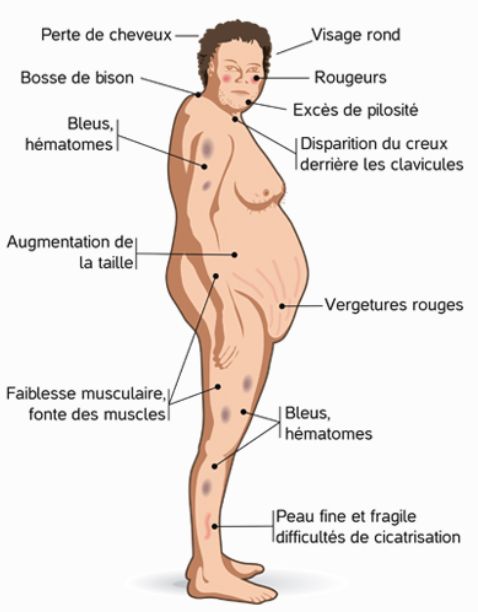
8) Syndrome de Cushing
- Fréquence : 0,5 % des HTA
- Origine : Hypersécrétion de corticostéroïdes ou traitement par corticoïdes au long cours.
- Elément de présomption : le diagnostic est évoqué sur les données de la clinique avec obésité, facio-tronculaire, érythrose du visage, acné, vergetures pourpres, amyotrophie, ostéoporose, élévation de la glycémie, irritabilité, dépression…
- Mode d'exploration : dosages du cortisol plasmatique, du cortisol libre urinaire.
- Traitement : chirurgie en fonction de l'origine centrale ou périphérique de la lésion, arrêt du traitement si iatrogène.
- La prévention de l’insuffisance surrénalienne lors d’une origine iatrogène doit faire appel à un protocole de sevrage progressif de la corticothérapie et à des médicaments relais si la cause de la prescription initiale n’est pas traitée (lorsque cela est possible).
- S’y associent des troubles métaboliques variés (HTA, diabète, thrombose veineuse, ostéoporose, fractures inopinées, complications infectieuses…).
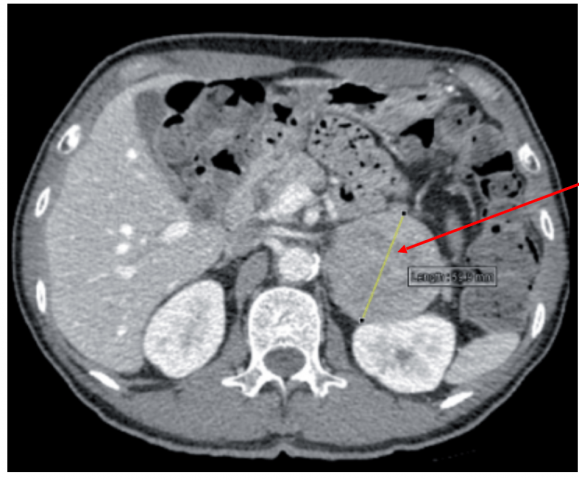
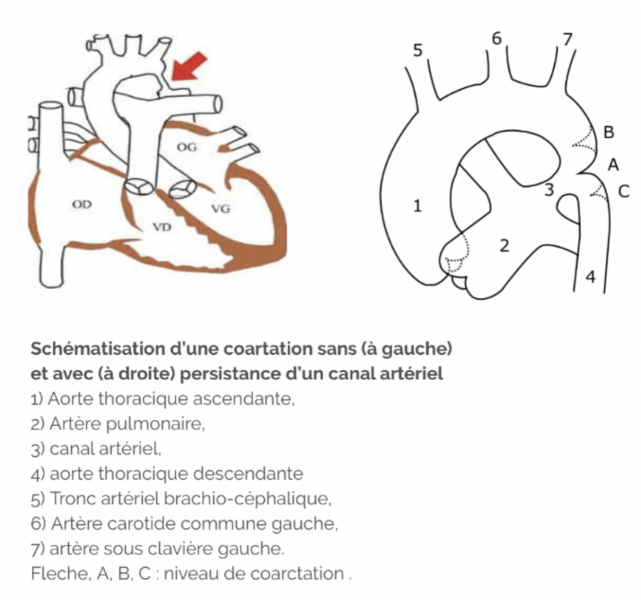
9) Coarctation de l’aorte
- Fréquence : < 1% , c’est une pathologie rare devant être évoquée en cas d’HTA chez l’enfant ou l’adolescent. Elle correspondant à un rétrécissement congénital de l’aorte thoracique au début de sa portion descendante.
- Clinique : abolition ou diminution des pouls fémoraux, souffle systolique para-sternal gauche et dans le dos , des encoches costales sur la radiographie thoracique, une HTA aux membres supérieurs (surtout systolique) et une hypotension aux membres inférieurs.
- Diagnostic : échographie et angio IRM cardiaques.
- Traitement : chirurgical ou endoluminal (dilatation avec pose d’une endoprothèse) avec une guérison dans plus de 75 % des cas.
ÉVALUER LE RISQUE CARDIOVASCULAIRE
A) Rechercher les facteurs de risque cardio-vasculaire
- Un facteur de risque cardiovasculaire (FdR CV) peut être défini comme un état clinique ou biologique qui augmente le risque de survenue (= d'incidence) d'un événement cardiovasculaire donné.
- L’hypertension artérielle apparaît rarement isolément et elle est souvent associée à d’autres facteurs de risque cardio-vasculaire (RCV).
- L’hypertension artérielle est un facteur de risque de toutes les complications de l'athérome (coronaire, membres inférieurs), mais tout particulièrement des accidents vasculaires cérébraux (85% sont hypertendus).
- Avant 55 ans, le RCV est corrélé à la PAs et après 60 ans le RCV est surtout corrélé à la PAs (et donc à la pression artérielle pulsée = PAs-PAd)


B) Évaluer le risque cardio-vasculaire par l'outil SCORE (Systematic Coronary Risk Estimation)
- Le risque cardio-vasculaire (RCV) est la probabilité de survenue chez une personne d’un événement cardio-vasculaire majeur (décès cardio-vasculaire, infarctus, AVC) sur une période donnée (par exemple : à 5 ans, à 10 ans).1
- Le calcul du RCV global n'a d'intérêt qu'en prévention primaire car, en prévention secondaire, les patients sont par définition à très haut risque cardiovasculaire.
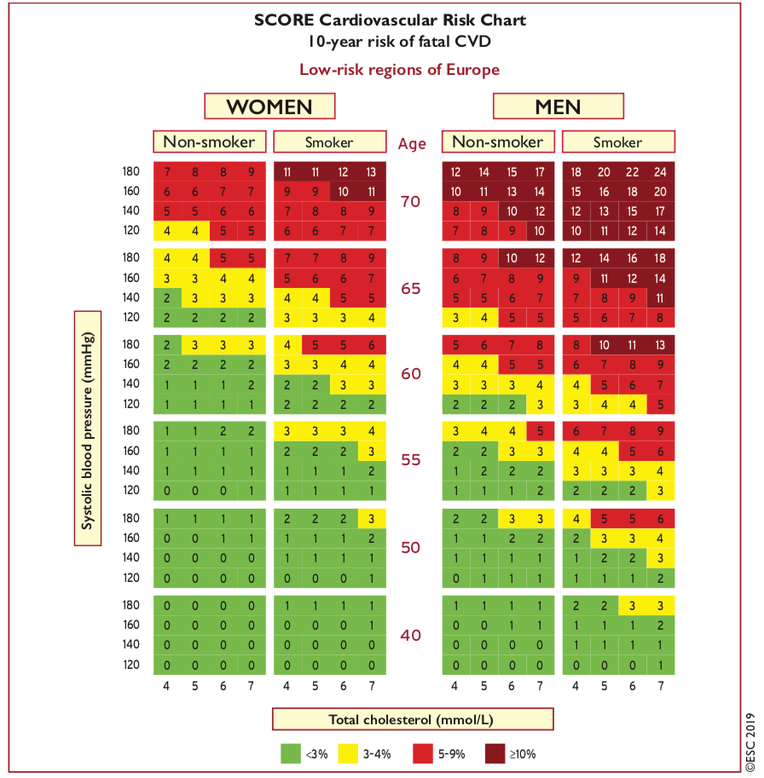
- Les dernières recommandations 2016 de l'ESC et 2017 de l'HAS préconisent l'utilisation systématique de l'outil SCORE (Systematic Coronary Risk Estimation) qui permet d'évaluer le risque de mortalité cardio-vasculaire à 10 ans.
- Le Systematic Coronary Risk Evaluation (SCORE) a été développé sur la base d’études de cohorte européennes de plus de 200 000 Européens de 11 nations (dont la France) en se basant sur le genre, l’âge, le statut diabétique, le tabagisme, le cholestérol total, le HDL et la pression artérielle.. Il est adapté aux patients Européens, contrairement au score de Framingham (patients US).
- L’outil SCORE peut être modélisé selon les caractéristiques propres à un pays, ce qui a déjà été fait pour un certain nombre de pays européens.
- Il permet de sensibiliser le patient à son pronostic à 10 ans. Il sensibilise également le patient au bénéfice du contrôle de l'HTA, de l'amélioration du bilan lipidique, de l'arrêt du tabac…
- L’intérêt de ces modèles est de permettre au praticien d’apprécier le profil de risque du patient dans sa globalité plutôt que de traiter un risque isolément. Les facteurs de risque ont des effets cumulatifs et un patient présentant plusieurs facteurs de risque modérés peut être plus à risque de développer une maladie cardio-vasculaire qu’un patient présentant un seul facteur de risque élevé.
- Considérant que certains facteurs de risque sont potentiellement modifiables, un aspect important de la prise en charge résultant de l’évaluation du RCV est de déterminer lesquels peuvent être traités et dans quel ordre.
Le SCORE ne s’applique pas :1
- aux patients de moins de 40 ans pour les hommes et de moins de 50 ans pour les femmes.
- aux patients de plus de 70 ans.
- aux patients hypertendus sévères (PA ≥ 180/110 mm Hg), ou atteints d’hypercholestérolémie familiale.
- aux patients diabétiques, ou insuffisants rénaux chroniques modérés à sévères, ou atteints d’une maladie cardio-vasculaire documentée (prévention secondaire) qui sont considérés d’emblée comme à niveau de risque cardio-vasculaire élevé ou très élevé selon la classification européenne du risque CV.
Il est rappelé que dans certains cas, le risque peut être plus élevé que celui calculé par le modèle :
- chez les patients très sédentaires ou présentant une obésité, le risque lié au surpoids étant plus important chez les patients jeunes,
- en cas de situation sociale très défavorisée ou chez les patients appartenant à une minorité nationale,
- chez les patients présentant une glycémie à jeun élevée et/ou une tolérance au glucose anormale sans diabète avéré,
- chez les patients ayant une élévation des triglycérides, du fibrinogène, de l’apoproteine B, du niveau de lipoprotéine et de la protéine C réactive,
- chez les patients ayant un antécédent familial de maladie cardio-vasculaire précoce (avant 55 ans chez les hommes et 65 ans chez les femmes).
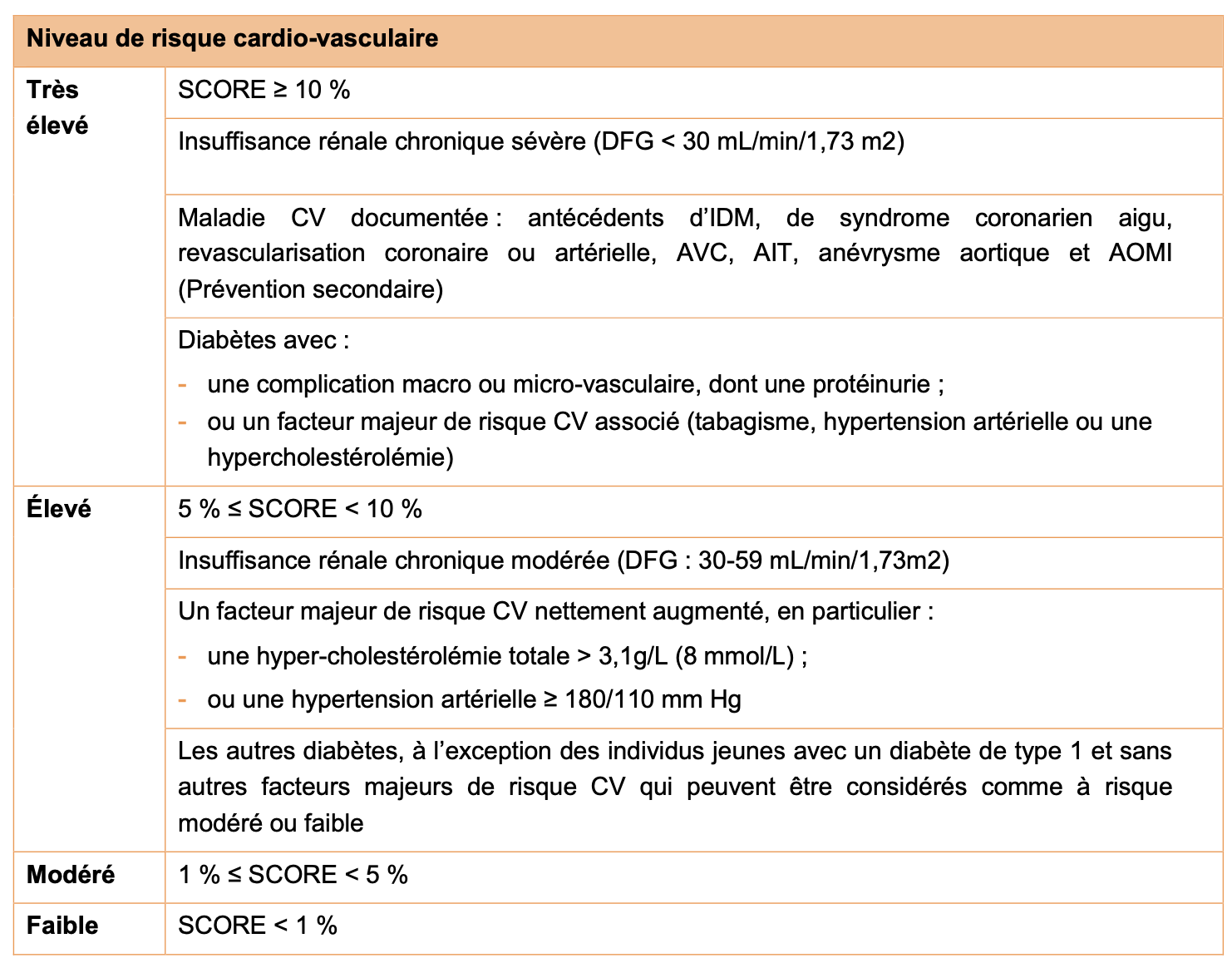
C) Classification du risque cardio-vasculaire modifiée
D) Evaluation de l’atteinte d’organes cibles liée à l’HTA
- Le terme « atteinte d'organes cibles » est défini par une atteinte paraclinique ou infraclinique secondaire à l'HTA.
- L'évaluation comprend une partie clinique et une partie paraclinique et vise à diagnostiquer les maladies associés au patient à risque vasculaire élevé et à faire le bilan des lésions de l’hypertension artérielle.
- Les atteintes d’organes sont liées à des changements fonctionnels et structuraux des artères et des organes cibles (cœur, cerveau, rein, yeux, vaisseaux) causées par une augmentation de la pression artérielle et sont un marqueur de maladie cardio-vasculaire encore au stade asymptomatique.
- Cette évaluation est recommandée par la société européenne de cardiologie afin de déterminer le RCV global du patient et quantifier l’ «HTA maladie» qui se défini comme le retentissement global de l’élévation de pression.
- L’évaluation des lésions asymptomatiques d’organe secondaire à l’HTA est également une recommandation de l’HAS lors du bilan initial de découverte de l’HTA. En effet l’inclusion des atteintes d’organes liées à l’HTA aide à identifier les patients hypertendus à haut risque ou à très haut risque CV qui pourraient sinon être mal classés comme présentant un niveau de risque inférieur par le système SCORE.
- Les atteintes d’organes liées à l’HTA sont fréquentes chez les hypertendus chroniques et les HTA sévères mais se voient également dans les HTA moins sévères et lors du diagnostic initial.
- Le risque cardio vasculaire augmente en présence d’atteintes d’organes liées à l’HTA et d’autant plus que le nombre d’organes touchés est important.
- Certaines atteintes d’organes sont réversibles après initiation d’un traitement et contrôle tensionnel surtout si introduit précocement mais d’autres sont irréversibles malgré un traitement optimal d’où l’intérêt de les détecter le plus tôt possible.
- Le caractère réversible des lésions donne au traitement anti hypertenseur son caractère primordial pour retarder la progression des atteintes d’organes liées à l’hypertension et diminuer le risque cardiovasculaire chez ces patients.

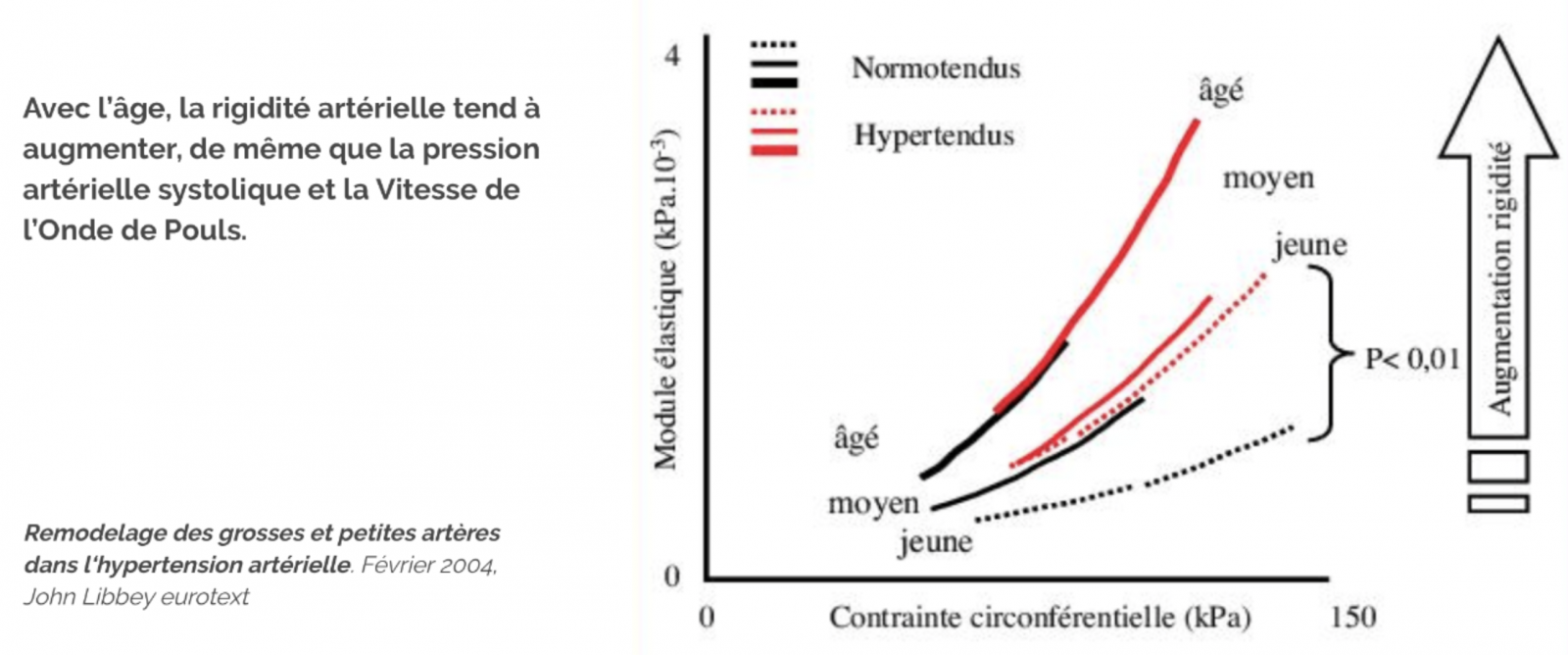
1) Rigidité artérielle 1
- La détermination de la rigidité aortique par la mesure de la vitesse de l’onde de pouls carotido-fémorale (VOPcf) a été inscrite dès 2007 sur la liste des mesures qui devraient être réalisées chez l’hypertendu pour détecter une atteinte des organes cibles.
- La mesure de la VOPcf devrait faire partie de l’évaluation du risque cardiovasculaire (CV) global, en permettant de détecter une atteinte du système artériel en tant qu’organe cible de l’HTA.
- Elle est inscrite dans les recommandations européennes mais ne peut être réalisée en pratique courante.
- La rigidité artérielle représente la capacité qu’ont les gros troncs artériels proximaux d’amortir la pulsatilité artérielle qui existe au niveau de l’aorte ascendante et de la transformer en un débit continu au niveau des artérioles, (effet windkessel) de manière à protéger les organes cibles de l’hyperpulsatilité.
- Cette recherche se réalise seulement en centre spécialisé mais sa compréhension est essentielle dans la physiopathologie de la maladie hypertensive.
- Le remodelage des petites artères et leurs raréfactions entraînent une augmentation de la pression artérielle moyenne, qui accroît la rigidité des artères de large calibre et, en conséquence, la pression centrale, avec des dommages sur les organes nobles (cœur, rein et cerveau).
- La rigidité des grosses artères impose des pressions accrues sur le cœur (augmentation de l’onde de retour et de la postcharge).
- En effet, les artères assurent un double rôle : la transmission du sang vers la périphérie et l’amortissement du choc pulsatile.
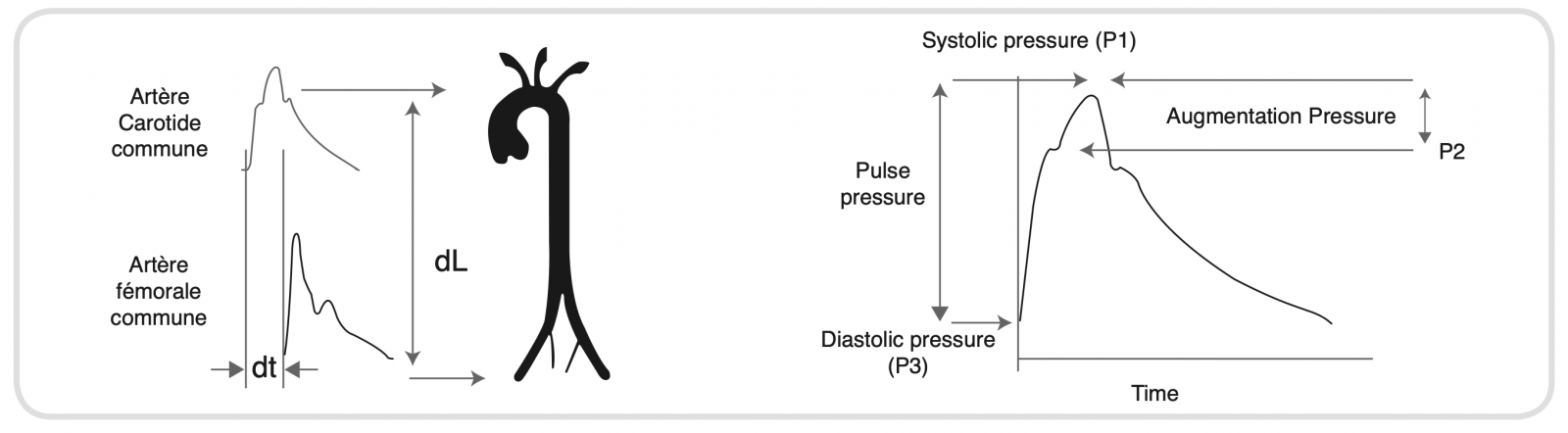
Qu’est ce que l’onde de pouls ?
- C’est l’onde de déformation de la paroi artérielle suite à l’ébranlement sanguin dans l’aorte ascendante lors du choc d’éjection ventriculaire cardiaque.
- L’onde de pouls provoque une déformation mesurable de la paroi artérielle (elle est perpendiculaire à l’axe de l’artère). Elle se propage ensuite le long de l’artère.
- La propagation de cette onde est dépendante des propriétés visco-élastiques du milieu dans lequel elle évolue : plus la paroi est rigide, plus l’onde se propage vite.
- La capacité élastique du tissu artériel permet de restituer l’énergie emmagasinée pendant la phase systolique (compliance) lors de la phase diastolique (élastance) permettant ainsi de maintenir un débit continu même en diastole. C’est l’effet Windkessel.
- Il résulte de la perte de la fonction d’amortissement une rigidité majorée qui entraîne une onde retour plus rapide. Par conséquent, la pression systolique est amplifiée par cette onde retour qui vient plus précocement s’ajouter à l’onde de pression initiale, ce qui oblige à un travail cardiaque supplémentaire pour propulser le sang (postcharge).
- Par ailleurs les à-coups tensionnels dus à la rigidité artérielle et à la perte de la compliance des parois artérielles est un facteur de dommage tissulaire pour les organes cibles.
- L’augmentation de PA augmentant le remodelage artériel, augmentant lui-même la PA.
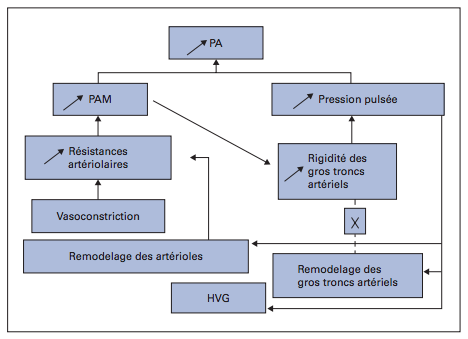
Comment mesurer la vitesse de l’onde de pouls ?
- Plusieurs méthodes ont été développées afin de mesurer, de façon non invasive, la compliance artérielle.
- Les méthodes classiques utilisent des capteurs de pression posés en deux points distants d’un segment artériel. Ils détectent le temps du transit entre ces 2 points, la vitesse étant égale à la distance (D) qui les sépare divisée par le temps de transit de l’onde (dt).
- La distance est mesurée sur la surface du corps entre le point carotidien et le point fémoral, elle ne reflète pas parfaitement la réalité de la taille du segment artériel considéré.
- Elle est réalisée par un appareillage dédié en centre spécialisé.
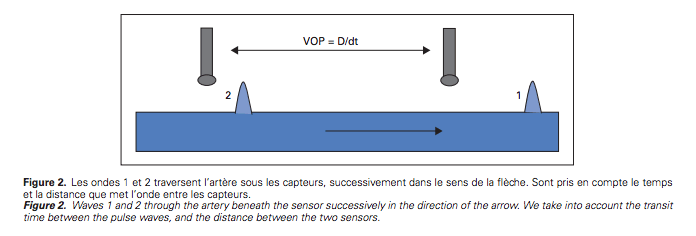
Conditions de mesure applicables à toutes les méthodes de mesure de la rigidité artérielle

Les recommandations européennes de 2018 définissent le seuil de 10 m/s au-delà duquel le risque cardiovasculaire est anormalement élevé.
2) Hypertrophie du ventricule gauche
- Le cœur est un des principaux organes cibles, et une des premières conséquences de l'élévation de la pression artérielle (PA) est l'hypertrophie ventriculaire gauche (HVG).1
- L'HVG correspond à une augmentation de la masse musculaire ventriculaire gauche due à l’hypertrophie des cellules myocardique et non à leur multiplication.
- Elle se définit par un épaississement concentrique de la paroi du ventricule gauche (En général, la distribution de l’HVG est plus homogène dans l’HTA) secondaire à l’élévation de postcharge et aux stimuli catécholaminergiques. Le ventricule gauche, afin de lutter contre la pression résistive générée lors de l’HTA, va s’épaissir afin d’augmenter sa force contractile.
- L’HTA reste la cause la plus fréquente d’HVG, et celle-ci est retrouvée chez 30 % des hypertendus. Elle est responsable d’un remodelage puis d’une hypertrophie concentrique par augmentation de la postcharge du VG. La distinction avec une CMH est cruciale mais pas toujours évidente.1 L’anamnèse d’une HTA mal contrôlée de longue date reste l’élément le plus important, de même que la diminution de la masse sous traitement anti-HTA, par ailleurs signe de bon pronostic. L’hypertrophie du ventricule droit est aussi peu fréquente.
Les principales complications sont celles liées à l’hypertrophie du ventricule gauche avec l’insuffisance cardiaque diastolique, le risque accru coronaire, le risque d’arythmie, la mort subite :
- Conséquences hémodynamiques : l’HVG entraîne une altération de la relaxation ventriculaires, phénomène actif consommateur d’énergie, et une augmentation de la rigidité ventriculaire gauche, phénomène passif diastolique. Ces deux anomalies se conjuguent pour diminuer le remplissage ventriculaire gauche. Cet état fait le lit de l’insuffisance cardiaque diastolique (à fraction ventriculaire gauche conservée).. L’altération de la performance contractile est au contraire tardive, le plus souvent associée à une pathologie coronarienne.
- Conséquences coronariennes : L’HVG a pour conséquence une augmentation de la pression pariétale du VG qui est responsable d’anomalies de perfusion coronaire. L’augmentation de la masse et de l’épaisseur du ventricule gauche le rend également plus sensible aux variations d’apport d’oxygène ce qui peut être à l’origine d’une authentique insuffisance coronarienne en dehors de toute atteinte athéromateuse des gros troncs coronaires.
- Conséquences rythmiques : l’altération du remplissage ventriculaire gauche liée à l’HVG entraîne une dilatation de l’oreille gauche à l’origine de fréquents troubles du rythme, notamment de la fibrillation auriculaire. Plus rarement, l’HVG peut être à l’origine de troubles du rythme ventriculaires voir de mort subite.1
La découverte d’une anomalie cardiaque à l’interrogatoire, à l’examen physique ou à l’ECG nécessite de demander un avis spécialisé d’un cardiologique qui pourra préconiser la réalisation d’examen complémentaires.
a) Signes ECG
- La réalisation d’un ECG est systématique à la recherche de signe d’hypertrophie ventriculaire lors du bilan initial. Elle recherche également une FA, fréquente en cas d'HTA.
- L’indice de Sokolow ≥ 35 mmHg oriente vers le diagnostic (amplitude de l’onde S en V1 + amplitude de l’onde R en V5).
- Les ondes T négatives dans les dérivations latérales D1 aVL, V5, V6 par anomalies secondaires de la repolarisation.
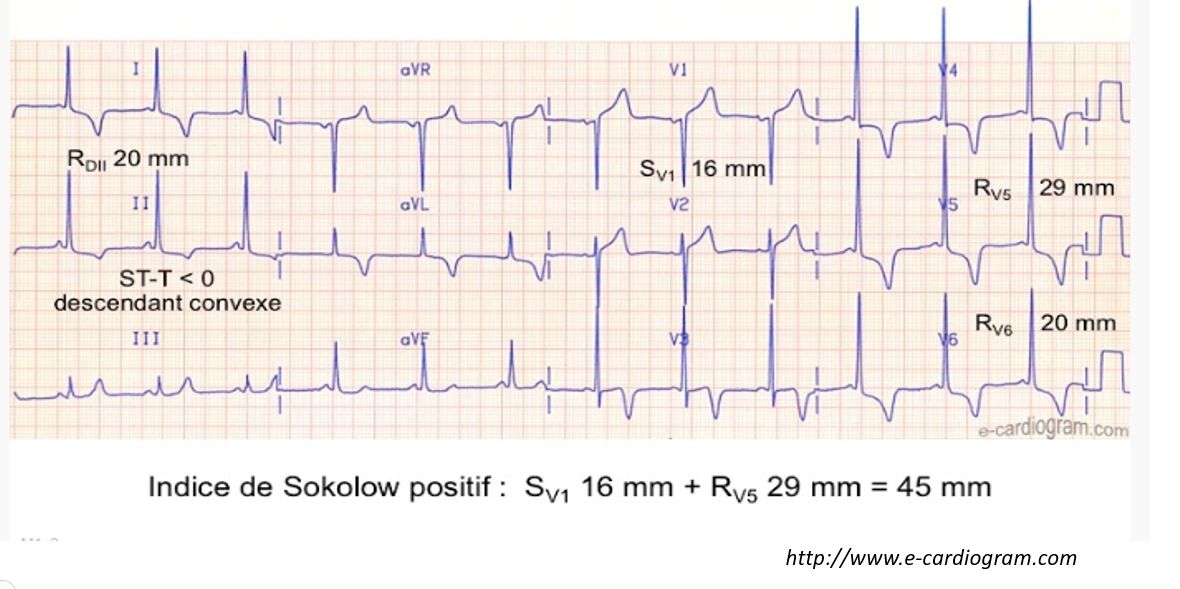
b) Signes Echocardiographiques
- L’échocardiographie est recommandée lorsque des signes évocateurs à l’ECG sont présents. Cette attitude s’applique pour les recommandations françaises et européennes.
- L’échocardiographie est un outil important dans la démarche diagnostique lors de la découverte d’une hypertrophie ventriculaire gauche à l'ECG, permettant dans certains cas de distinguer entre les différentes étiologies (cardiomyopathies hypertrophiques, hypertrophie secondaire à des conditions de charge élevées ou à l’entraînement sportif intensif, bourrelet basoseptal de la personne âgée) ou alors d’orienter les examens complémentaires
- La mesure de l’épaisseur des parois ventriculaires gauches se fait par convention en mode 2D ou TM, en vue parasternale long ou court axe au niveau de la pointe des feuillets mitraux.
- Le calcul de la masse, effectuée par convention selon la méthode linéaire, permet de juger de la sévérité de l’hypertrophie ventriculaire gauche et de classifier la géométrie en concentrique ou excentrique.
- L’épaisseur du septum ventriculaire ou de la paroi postérieure du ventricule gauche de plus de 11 mm est évocatrice. L’épaisseur de paroi dépasse rarement les 15 mm (exception chez les sujets noirs).1
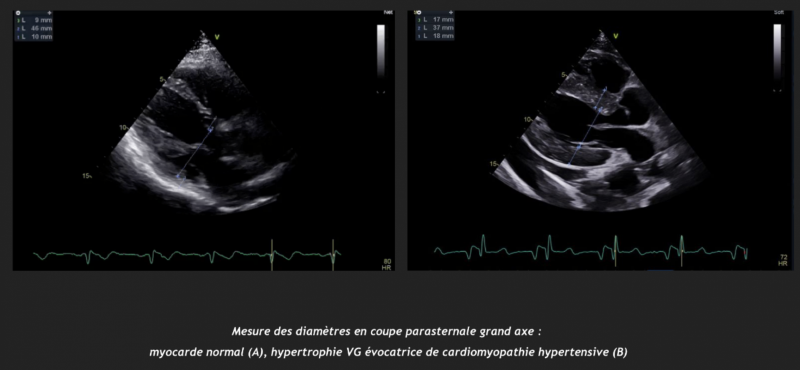
3) Microalbuminurie
- Chaque jour, 10 à 15 kg de protéines sériques traversent le rein, mais seulement 100 à 150 mg sont excrétés dans l’urine des 24 heures.
- La paroi du capillaire glomérulaire s’oppose en effet à la filtration de la majorité des protéines, et le tubule proximal réabsorbe la grande majorité des protéines physiologiquement filtrées en raison de leur faible poids moléculaire.
- Dans les conditions physiologiques, on peut observer une albuminurie toujours inférieure à 15-30 mg/j.
- La présence d’une microalbuminurie > 30mg / jour est le témoin d’une atteinte glomérulaire.
- Elle est fréquente lors de la néphropathie hypertensive et dans la néphropathie diabétique.
- La mesure du ratio albuminurie / créatinurie traduit le diagnostic précoce et quantifie le degré d’atteinte glomérulaire.
- Elle est recommandée systématiquement par les recommandations européennes et uniquement chez le patient diabétique pour l’HAS. La recherche de la protéinurie est par contre elle systématique.
- La microalbumine échappe à la détection par les bandelettes réactives simples. Elle peut être mesurée quantitativement par de nombreuses techniques dont la néphélémétrie, la turbidimétrie ou la radio-immunologie.
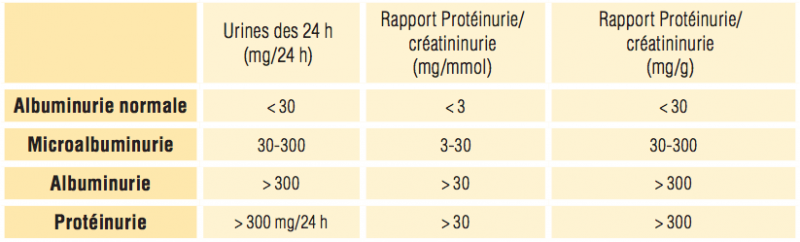
Comment la mesurer ? Différentes méthodes d’évaluation de la microalbumine sont possibles :
- le recueil des urines de 24 heures est la méthode de référence,
- le prélèvement minuté à partir d’une courte période de temps est possible,
- le prélèvement sur échantillon : il doit alors être effectué sur les premières urines du matin,
- ratio microalbumine/créatinine : pour compenser la variabilité d’une mesure de concentration d’albumine sur un échantillon, il a été proposé de la rapporter à la concentration de créatinine urinaire,
- La détermination de la microalbuminurie est inutile si l’albuminurie est déjà mise en évidence par des méthodes classiques moins sensibles (bandelettes) ou s’il y a infection urinaire.
4) Insuffisance rénale
Le rein peut être le responsable (HTA secondaires d'origine rénale) ou la victime de l'hypertension artérielle :
- L'athérome, dont l'HTA est un facteur de risque majeur, peut toucher les artères rénales responsables d'une HTA réno-vasculaire qui aggrave l'HTA.
- Surtout, l'HTA est responsable dans plus de 1/3 des cas d'une néphro-angiosclérose par atteinte des artérioles (hypertrophie, hyperplasie et fibrose de la média) qui, dans 10 à 20% des cas, conduit à une insuffisance rénale chronique, qui elle-même aggrave l'HTA.

- L’insuffisance rénale chronique (IRC) est définie par la diminution irréversible du débit de filtration glomérulaire (DFG) qui est le meilleur indicateur du fonctionnement rénal. Elle résulte soit de l’évolution d’une maladie rénale chronique (MRC), soit de la non récupération après une agression rénale aiguë.
- Les néphropathies vasculaires et hypertensives sont les causes les plus fréquentes (25%) d’insuffisance rénale terminale.
- L’introduction des traitements hypertenseurs (IEC / ARA 2) peuvent entraîner l’augmentation de 20 % de la créatinémie.
- La recherche d’une insuffisance rénale est recommandée à la fois dans les recommandations européenne et française lors du bilan initial.
- Lors du bilan initial et au cours du suivi la découverte d’une créatinémie élevée et/ou d’une protéinurie doit être contrôlée à 1 mois. En cas de persistance un avis néphrologique doit être demandé.
- Un DFG < 60 ml/min/m² ne motive pas un avis spécialisé si l’âge est > 65 ans. Un avis spécialisé est par contre motivé en cas de DFG < 30 ml/min/m² quelque soit l’âge ou en cas de dégradation rapide (diminution de plus de 10ml/min/m² par an).
- En cas d’insuffisance rénale il faut adapter la posologie des médicaments au débit de filtration glomérulaire (DFG) estimé et d’éviter les médicaments néphrotoxiques.
- Cette démarche concerne aussi bien le pharmacien que le médecin généraliste, il est par ailleurs recommandé de préciser le DFG sur l’ordonnance du patient. L’adaptation du traitement est de la coresponsabilité du pharmacien et du prescripteur
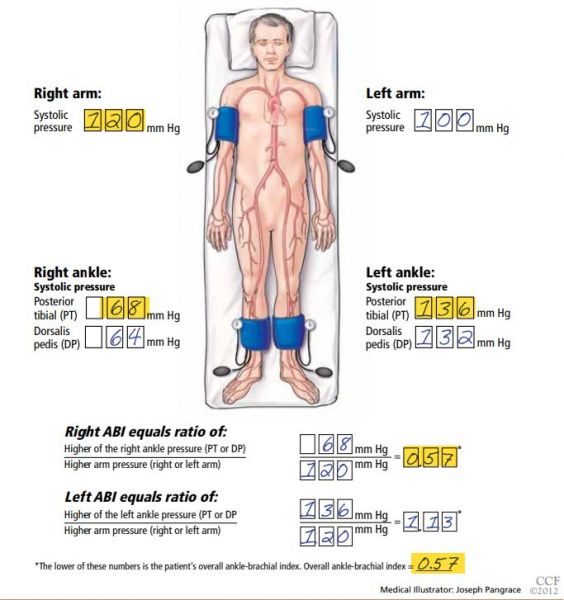
5) Index de Pression Systolique (IPS)
- L’IPS ou Index Bras-Cheville permet le diagnostic clinique de l’artériopathie oblitérante des membres inférieurs.
- Il se calcule par le rapport entre la pression artérielle systolique mesurée à la cheville et la pression artérielle systolique mesurée au niveau brachial.
- IPS = PRESSION SYSTOLIQUE À LA CHEVILLE/PRESSION SYSTOLIQUE BRACHIALE
Conditions de mesure :
- Patient au repos, détendu, en décubitus dorsal depuis 10 minutes, dans une salle non surchauffée
- Pour chaque membre inférieur, la pression la plus élevée est retenue pour le calcul.
- Pour les membres supérieurs, la pression humérale la plus élevée est retenue pour le calcul.
- On obtient alors une mesure d’index de pression systolique pour chaque membre, et on retient la valeur la plus faible à droite ou à gauche.
- L’IPS normal est compris entre 0,9 et 1,3. Un IPS inférieur à 0,90 permet de poser le diagnostic d’artériopathie oblitérante des membres inférieurs.
- La recherche de l’index de pression systolique de part son caractère facilement réalisable rentre dans les examens réalisables dans le bilan du patient à risque cardio-vasculaire.
- Sa réalisation n’est pas recommandée dans le cadre de l’HTA et faiblement recommandée par les recommandations européennes.
- NB : en l’absence de doppler la technique auscultatoire peut être réalisée.
- Vous trouverez sur cette vidéo la technique détaillée de mesure de l’IPS (3 minutes).
6) Atteinte vasculaire
Il n’y a pas de recommandation spécifique de l’HAS concernant l’évaluation de l’atteinte vasculaire au cours de l’HTA. A défaut les recommandations européennes (2013 et 2018) préconisent :
- Qu’une échographie carotidienne soit envisagée chez le patient hypertendu suspect d’arthérosclérose asymptomatique.
- L’échographie carotidienne devient par contre recommandée en cas de signe clinique (souffle carotidien) ou en cas de bilan d’AVC / AIT.
- De mesurer l’index de pression systolique (IPS) bras/cheville à la recherche d’un artériopathie des membres inférieurs (IPS < 0,9).
- D’adresser, dans la mesure du possible, le patient en centre spécialisé pour mesurer la rigidité artérielle (vitesse de l’onde de pouls).
7) Atteinte cérébrale/cognitive
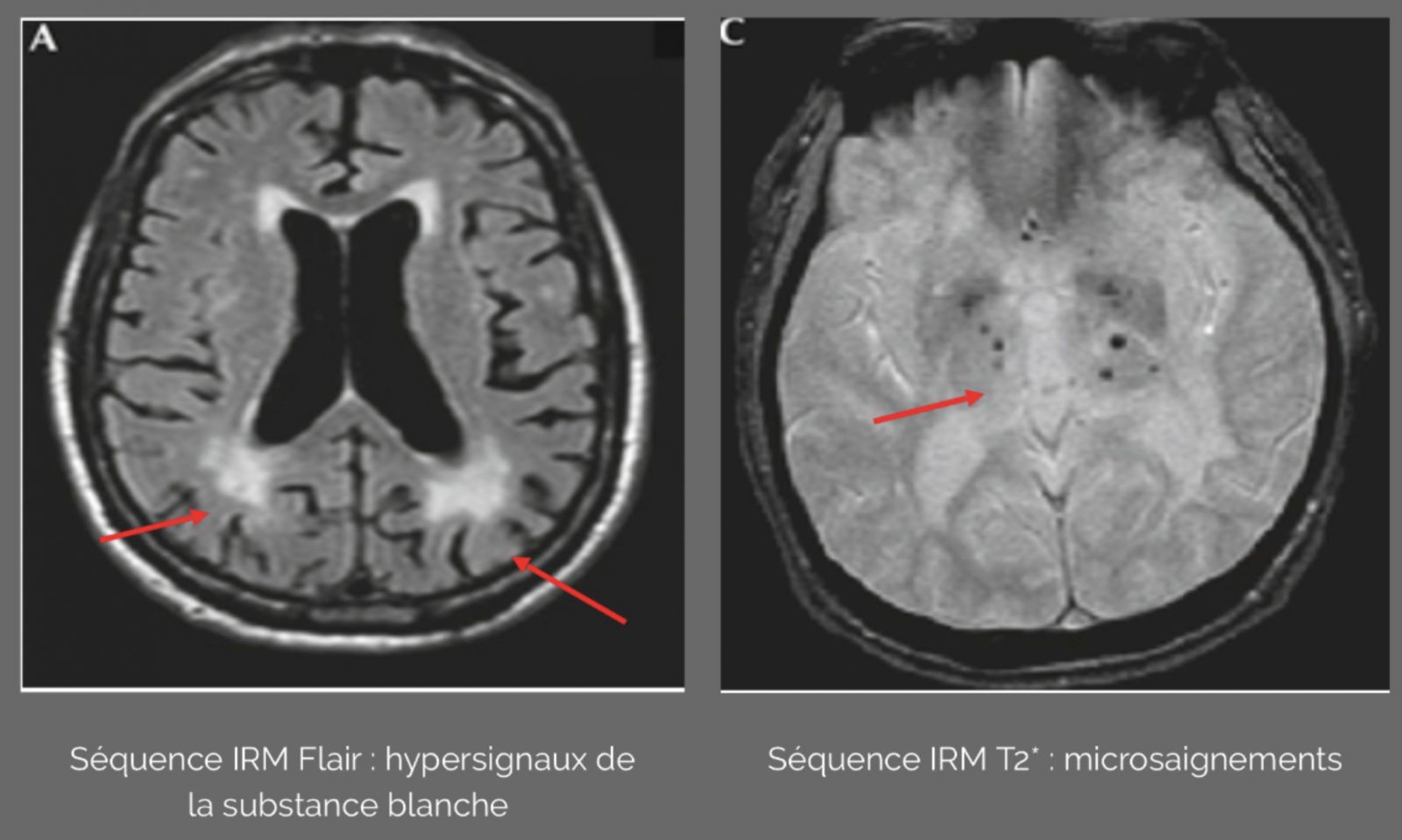
- L’hypertension artérielle augmente le risque d’atteintes cérébrales comme un accident ischémique transitoire ou un accident vasculaire cérébral. L’IRM peut détecter des lésions encore asymptomatiques comme une hyperintensité de la substance blanche, des infarctus lacunaires, des micro-saignements et une atrophie cérébrale.
- Les lésions de la substance blanche et les infarctus lacunaires sont associés à une augmentation du risque d’accident vasculaire cérébral et de déclin cognitif du à une démence dégénérative vasculaire.
- L’HAS recommande donc la réalisation d’un MMSE dès l’âge de 75 ans.
Le MMSE est un outil de dépistage des troubles cognitifs, il mesure les capacités d’orientation dans le temps et l’espace, le rappel immédiat, la mémoire verbale à court terme, le calcul, le langage et la praxi constructive :
- Il a été développé initialement pour le dépistage de la démence en milieu psychiatrique, il est maintenant validé pour la population générale.
- Un score ≤ 24 points traduit des troubles cognitifs.
- Sa réalisation prend 10 minutes.
- En cas de test MMSE non satisfaisant un bilan de démence devra être réalisé.Les recommandations européennes prévoient notamment la réalisation d’une IRM à la recherche de lésion de la substance blanche, de défect vasculaire ischémique ou de micro saignement.
- Pour plus d’information sur cette prise en charge il existe des recommandations HAS de 2011 sur le sujet.
8) Atteinte ophtalmologique
- La présence d’une rétinopathie hypertensive est un facteur prédictif de mortalité.
- Il n’y a pas de recommandation française concernant l’évaluation de l’atteinte ophtalmologique.
- A défaut les recommandations européennes prévoient la réalisation d’un fond d’œil en cas d’HTA de grade 2 ou 3 et quelque soit le grade chez le patient diabétique.
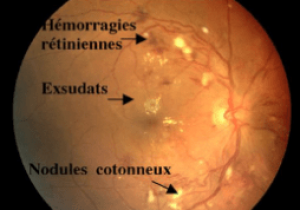
- Il recherche des hémorragies rétiniennes, des microanévrismes, des nodules cotonneux et un œdème papillaire
+ Stades de la rétinopathie hypertensive :
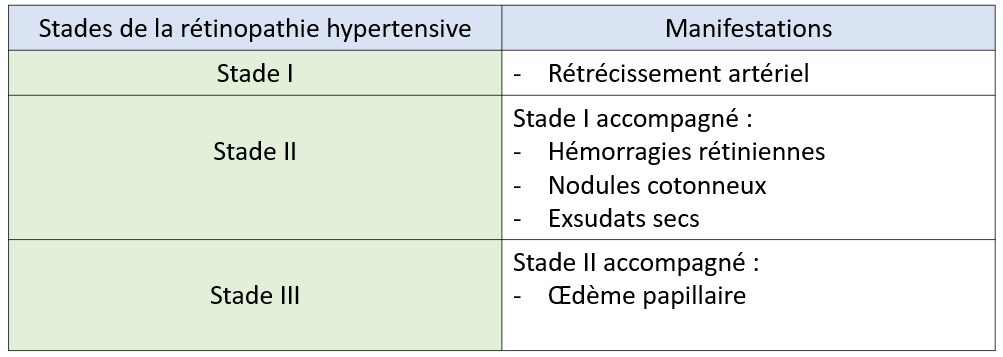
a) Stade I :
- Le premier signe ophtalmoscopique de la rétinopathie hypertensive est la diminution de calibre artériel, difficile à apprécier lorsqu'elle est diffuse.
- Elle est plus apparente lorsqu'il s'agit de vasoconstriction focale.
- Les modifications de calibre artériel sont plus faciles à apprécier sur des clichés du fond d'œil qu'à l'examen ophtalmoscopique.
- Ils sont réversibles avec le traitement de l'HTA.
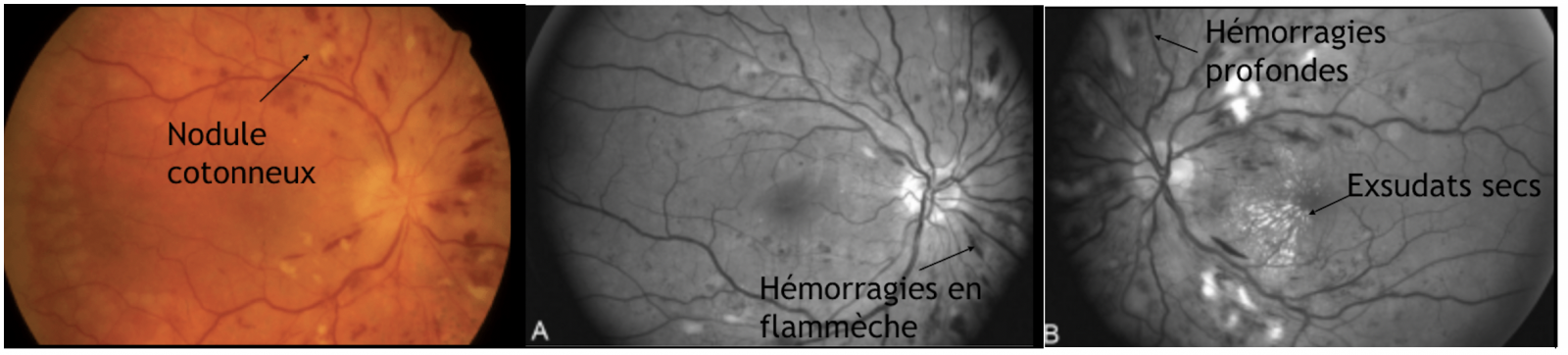
b) Stade II : En présence d'une HTA sévère, ou d'installation rapide, les capacités d'autorégulation sont dépassées :
- La barrière hémato encéphalique est rompue : Cela se traduit cliniquement par des hémorragies rétiniennes superficielles (en flammèche), un œdème maculaire associé à des exsudats secs souvent de disposition stellaire dans la région maculaire.
- L'occlusion des artérioles pré-capillaires est responsable de nodules cotonneux et d'hémorragies rétiniennes profondes (rondes).
- Les exsudats profonds («exsudats secs») sont liés à une rupture durable de la BHR et sont d'apparition plus tardive.
- Les nodules cotonneux, comme les hémorragies rétiniennes profondes, sont secondaires à des occlusions artériolaires responsables de l'accumulation dans les fibres optiques de matériel axoplasmique dont le transport actif est interrompu. Ils régressent en 3 à 4 semaines avec le traitement de l'HTA.
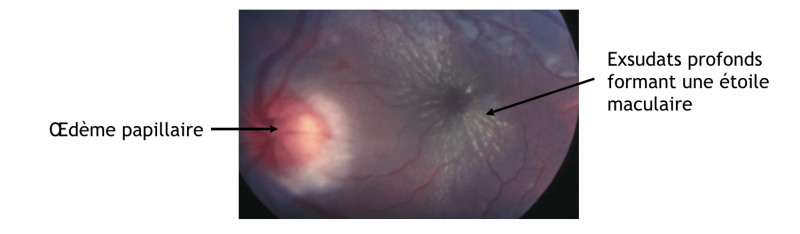
c) Stade III :
- L'œdème papillaire (OP) est l'élément principal du stade III de la classification de la rétinopathie hypertensive.
- Il est dû à une hypertension artérielle sévère ou à une élévation rapide et importante de la PA.
- La papille est hyperémiée, l'OP peut être entouré d'hémorragies en flammèches et d'exsudats secs péri papillaires ou associé à des exsudats secs maculaires formant une étoile maculaire.
- Au début, l’œdème papillaire n'entraîne pas ou peu de modifications fonctionnelles en dehors d'un agrandissement de la tache aveugle. Si l’œdème papillaire persiste, la papille devient atrophique et l'acuité visuelle chute.
COMPLICATIONS
A) Urgences hypertensives
Définition : Situation dans laquelle une hypertension sévère (grade 3) est associée à une atteinte d’organe aiguë liée à l’HTA,
Comme par exemple :
Hypertension maligne : HTA grade 3 associée à une modification du fond d’œil (hémorragies et/ou d’un œdème papillaire), une microangiopathie, une coagulation intravasculaire disséminée et plus ou moins à une encéphalopathie, une insuffisance cardiaque aiguë ou une insuffisance rénale aiguë, Hypertension sévère associée à une dissection aortique ou un infarctus du myocarde, Hypertension artérielle sévère soudaine dans le cadre d’un phéochromocytome, Hypertension sévère gravidique ou pré éclampsie (cf plus loin), Hypertension sévère associée à une hémorragie cérébrale.
A ne pas confondre avec la crise hypertensive qui se définit par une HTA de grade III isolée.
Examens paracliniques à réaliser devant une urgence hypertensive :
- Systématique : Fond d’œil, ECG, numération sanguine et bilan de coagulation, créatinine, DFG, ionogramme sanguin, LDH, haptoglobine, ratio albuminurie/ créatininurie, bandelette urinaire, test de grossesse.
- En fonction de la clinique : troponine, BNP, radiographie thoracique, échographie cardiaque, angioscanner thoracique, imagerie cérébrale, échographie rénale
Traitement :
- Administration de médicaments en intraveineux la plupart du temps,
- Mais des IEC, ARA 2 ou bétabloquants per os peuvent aussi être efficaces dans certaines situations car le système rénine angiotensine est activé par l’ischémie rénale
- Dans tous les cas, de faibles doses doivent être utilisées car ces patients peuvent être sensibles à ces agents et l’administration doit se faire en milieu hospitalier.
B) HTA maligne
Devenue rare de nos jours, son mécanisme comporte une part d’hypovolémie liée à une augmentation de la natriurèse et avec l’hyperaldostéronisme secondaire et hypokaliémie.
Le tableau d’encéphalopathie est associé à :
- Une PAD élevée > 130mmHg (et une PAS souvent > 210mmHg),
- un œdème papillaire au fond d’œil stade IV,
- Une insuffisance ventriculaire gauche,
- Une insuffisance rénale aiguë, une protéinurie abondante, une hématurie
Ce tableau est complété par des signes d’évolution plus latente :
- asthénie, amaigrissement, avec altération de l’AEG,
- Troubles digestifs, douleurs abdominales, nausées, vomissements, soif +/- déshydratation,
- Troubles neurologiques : visuels, céphalées violentes pouvant aller jusqu’aux signes de focalisation et le coma.
- On note fréquemment une Hypokaliémie et une anémie hémolytique régénérative.
Prise en charge thérapeutique
- Il y a quelques différences de prise en charge entre les recommandations européennes de 2018 et les recommandations HAS de 2016.
- Les recommandations européennes vont plus loin et sont plus fines que les reco HAS sur le sujet qui sont plus simples et plus pratiques.
- Il est fort probable que lors de la prochaine révision HAS, l’autorité de tutelle se tourne vers un certain nombre de recommandations européennes.
- Par soucis didactique nous allons donc aborder successivement les 2 modes de prise en charge.
- Dans tous les cas retenez que la prise en charge repose sur 2 piliers : les mesures hygiéno-diététiques et le traitement pharmacologique.
- Les bénéfices de la prise en charge de l’HTA sont largement prouvés et la réduction de la PAS de 10 mmHg ou de la PAD de 5mmHg est associée à une diminution :
- du risque cardiovasculaire de 20%,
- de la mortalité toutes causes de 10 à 15%,
- d’AVC de 35%,
- d’insuffisance cardiaque de 40%.
- Les bénéfices sont par ailleurs proportionnels à la réduction de pression obtenue.
- Cette figure présente les résultats d’une méta-analyse réalisée en 2016.
- Elle montre la reduction du risque d’événement cardiovasculaire (en ordonnée) en fonction de la réduction de PAS en valeur absolue (abscisse).
- Chaque cercle représente une des études, sa taille étant pondérée en fonction du nombre de patient qu’elle représente. L’analyse concerne un total 613815 patients.
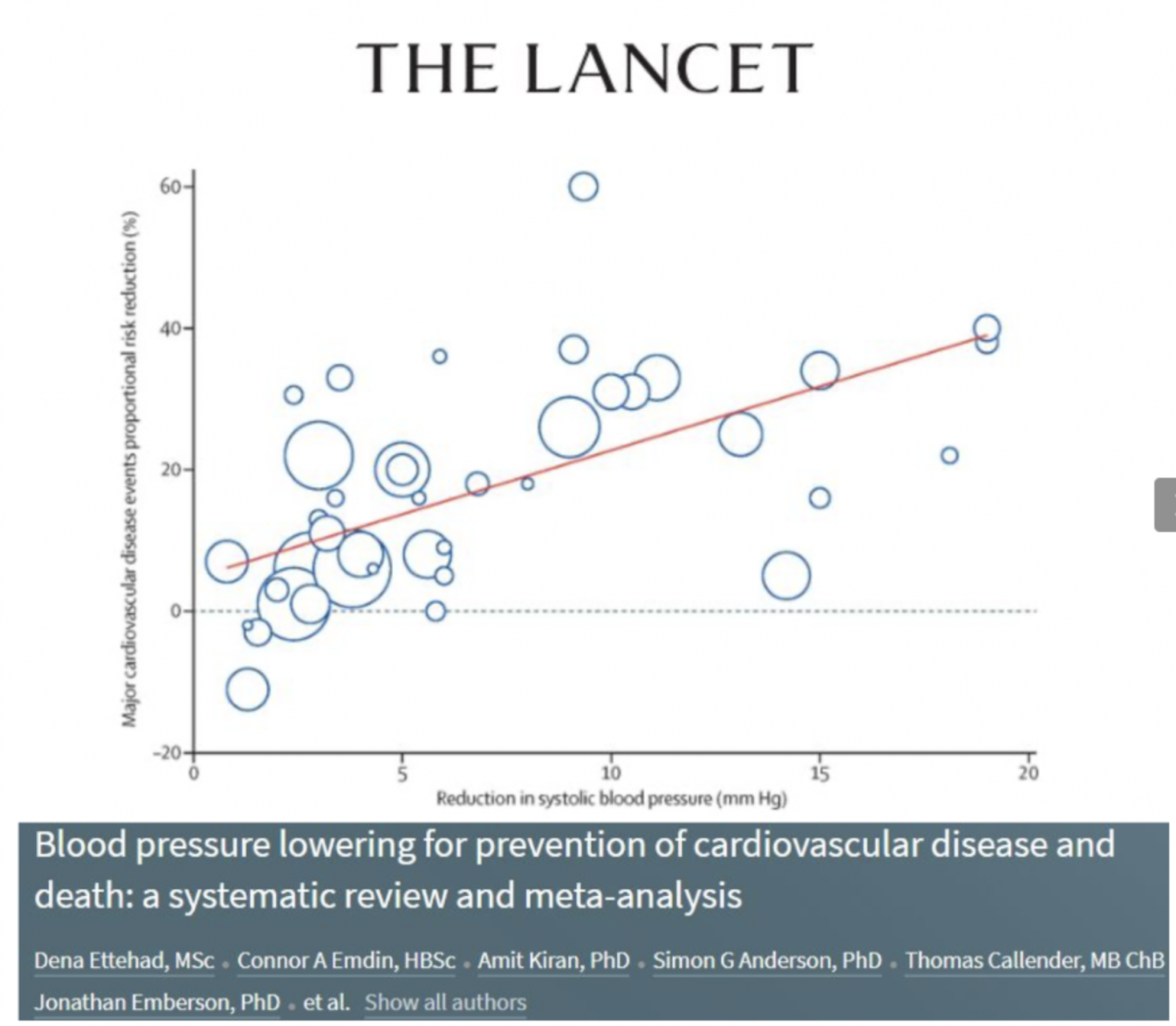
Les principales différences avec les recommandations HAS reposent sur 2 points :
- L’initiation et l’adaptation du traitement en fonction du grade de l’HTA (1, 2 ou 3) et du risque cardiovasculaire.
- Les objectifs de pression artérielle avec l’introduction de la notion de traitement « optimal ».
A) Quand initier un traitement ?
1) Patients avec PA normale haute et faible risque CV :
- La PA normale haute est définie par une PAS entre 130 - 139 et/ou une PAD entre 85 - 89 mmHg.
- Les recommandations prévoient d’introduire des mesures hygiéno-diététiques pour diminuer le risque d’évoluer vers une HTA et de diminuer le RCV.
- En revanche un traitement pharmacologique anti-HTA peut être envisagé d’emblée si le patient est à très haut risque cardiovasculaire (présence d’une maladie cardio vasculaire documentée notamment une coronaropathie).
2) Patients avec HTA de grade 1 et risque CV faible ou modéré :
- Les recommandations prévoient d’introduire des mesures hygiéno-diétiétiques pendant une période de 3 à 6 mois.
- Au bout de cette période si l’HTA persiste, il est recommandé d’introduire un traitement pharmacologique.
3) Patients avec HTA de grade 1 et risque CV élevé ou très élevé :
- Les recommandations prévoient d’introduire d’emblée un traitement pharmacologique en association à des mesures hygiéno-diétiétiques.
- Cette recommandation vaut également pour les patients présentant une HTA de grade 1 avec une atteinte d’organe hypertensive (cf partie III) quelque soit le niveau de risque CV.
- Patients de plus de 65 ans et de moins de 80 ans avec HTA de grade 1 : Les recommandations prévoient d’introduire d’emblée un traitement pharmacologique en association à des mesures hygiéno-diétiétiques.
- Le traitement est ajusté afin de parvenir à la dose minimale efficace et d’assurer sa tolérance.
4) Patients de plus de 80 ans avec HTA de grade 1 :
- Les recommandations prévoient d’introduire des mesures hygiéno-diététiques mais de ne pas introduire de traitement pharmacologique d’emblée. Celui-ci pourra être introduit après une période MHD de 3 à 6 mois en fonction de l’état général du patient et des ses risques cardio vasculaires.
- Le traitement est ajusté afin de parvenir à la dose minimale efficace et d’assurer sa tolérance.
5) Patients avec HTA de grade 2 ou 3 :
- Les recommandations prévoient d’introduire d’emblée un traitement pharmacologique en association à des mesures hygiéno-diétiétiques quelque soit l’âge du patient (même si > 80 ans) ou son risque cardiovasculaire.
- Les objectifs tensionnels seront évalués à 3 mois.
.png)
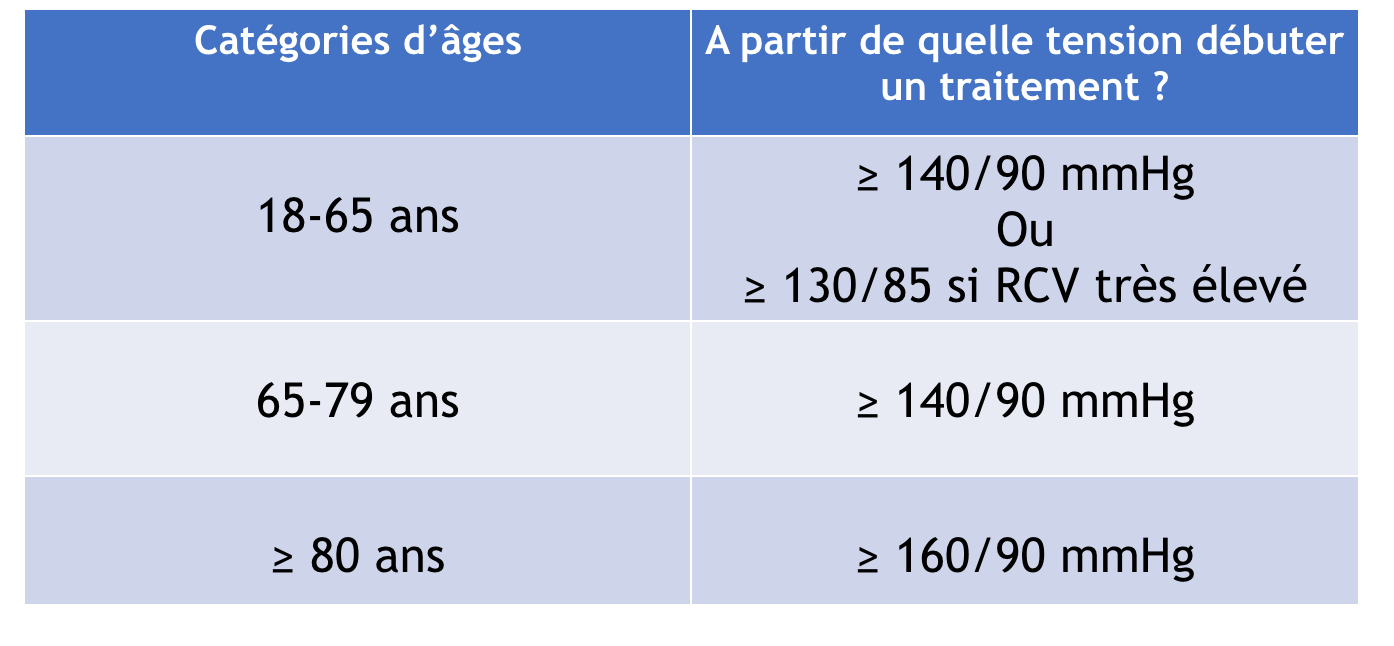
B) Quels sont les objectifs du traitement ?
Les objectifs se divisent en 2 phases :
- Obtention d’une PAS < 140 mmHg et d’une PAD < 90mmHg
- En cas de bonne tolérance au traitement il est recommandé pour les patient de moins de 65 ans de viser des objectifs < 130mmHg et PAD < 80 mmHg (traitement optimal) quelque soit leur comorbidité. En dessous de 120 mmHg de PAS le risque devient supérieur au bénéfice, il n’est donc pas recommandé de viser cet objectif. Une surveillance étroite des effets secondaires est préconisée (notamment de l’hypotension orthostatique).
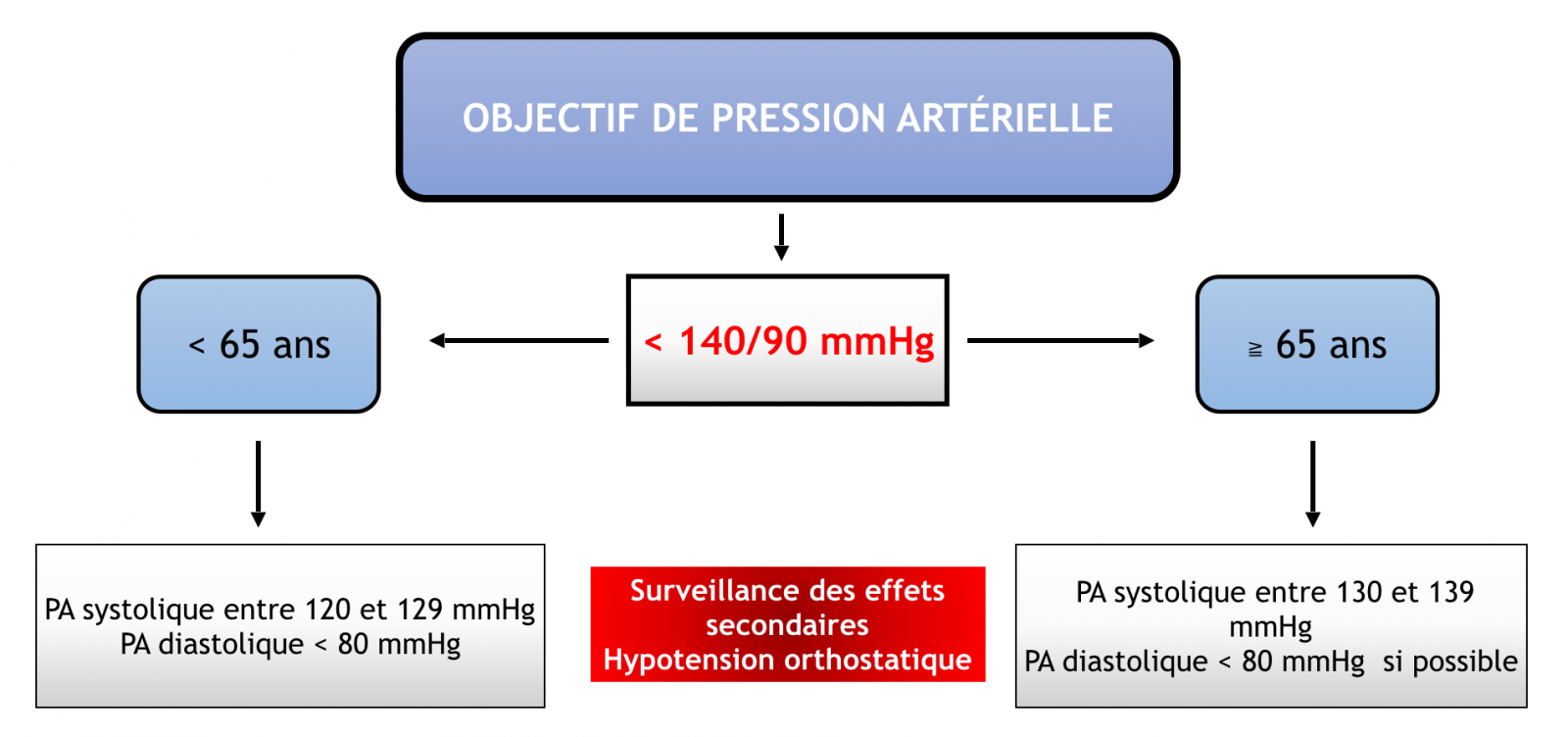
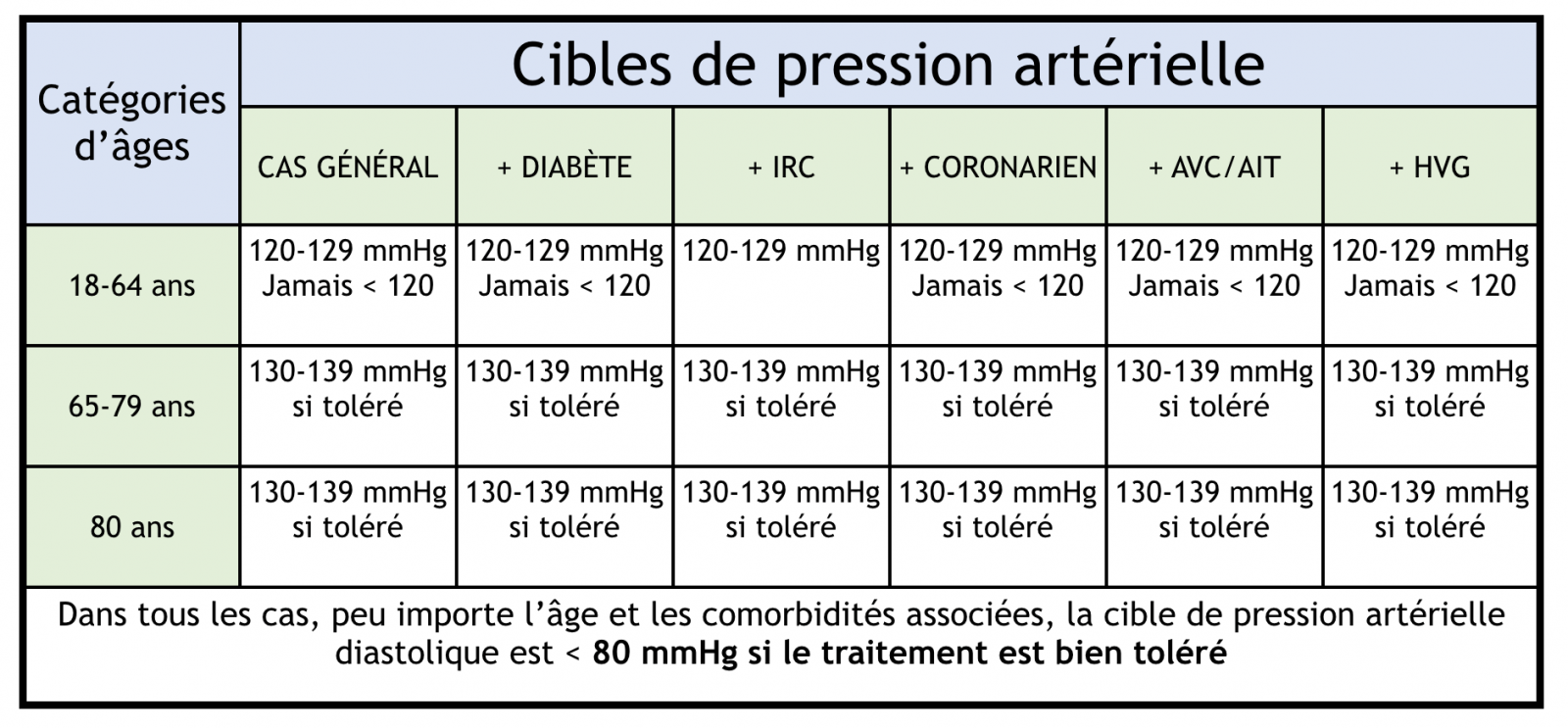
C) Quelles sont les modalités du traitement ?
Le traitement se base sur 2 piliers essentiels :
- Les mesures hygiéno-diététiques (MHD)
- Le traitement pharmacologique
1) Traitement non pharmacologique (MHD)
- Pour rappel, elles sont à introduire dès que la pression artérielle est normale haute.
- Les MHD regroupent des recommandations visant à changer en profondeur le mode de vie et ne doivent pas se focaliser sur un seul aspect (alimentation, alcool, tabac ou sédentarité).
- C’est une prise en charge globale.
Les objectifs sont les suivants :
- Restriction sodée < 5 grammes de sel/jour,
- Diminuer la consommation d’alcool : < 14 verres/semaine chez l’homme et < 8 verres/semaine chez la femme,
- Augmenter la consommation de légumes, fruits, poissons, acides gras insaturés et de produits laitiers faibles en matières grasses.
- Diminuer la consommation de viandes rouge,
- Diminution du poids (avec comme objectif d’IMC entre 20 et 25 kg/m2)
- Exercice physique régulier (au moins 30 minutes par jour, 5 à 7 jours par semaine),
- Arrêt du tabac avec accompagnement spécifique.
2) Traitement pharmacologique
Le traitement pharmacologique repose essentiellement sur 5 classes médicamenteuses :
- Inhibiteurs de l’enzyme de conversion (IEC),
- Antagonistes des récepteurs de l’angiotensine 2 (ARA2),
- Inhibiteurs calciques : dihydropyridines, verapamil, diltiazem, (ICa),
- Bétabloquants (BB),
- Diurétiques thiazidiques : hydrochlorothiazide, indapamide, (TZD).
- Ces familles de molécules ont démontré leur efficacité dans le traitement de la maladie hypertensive.
- Leur ordre d’introduction et leur association dépendront des spécificités du patient.
Deux règles de base concernant les traitements de l’HTA :
- Ne pas associer un IEC et un ARA 2 car pas de bénéfice et augmentation des effets secondaires rénaux.
- Les diurétiques thiazidiques sont inefficaces lorsque le DFG est < 30 mL/min. Dans ce cas on peut les remplacer par des diurétiques de l’anse comme le furosémide.
Autres médicaments peuvent également être utilisés dans le traitement de l’HTA mais ne rentrent pas dans les prescriptions de premières intentions :
- Alphabloquants
- Spironolactone (diurétique épargneur de potassium)
c) Stratégies thérapeutiques
- En première ligne, pour la plupart des patients, il est recommandé de commencer d’emblée par une bithérapie (en un seul comprimé) comprenant l’association d’un (1) IEC ou d’un ARA 2 avec un inhibiteur calcique ou un diurétique.
- Cette bithérapie d’emblée permet d’améliorer la rapidité et l’efficacité du contrôle tensionnel.
- Les bétabloquants ne sont donc pas recommandés en première ligne chez le patient tout venant (moins d’efficacité, plus d’effet secondaire).
a) Il est recommandé d’utiliser les bétabloquants en association de première ligne avec les autres classes citées ci-dessus dans certaines indications spécifiques :
- angor,
- nécessité de contrôler la fréquence cardiaque,
- post infarctus du myocarde,
- insuffisance cardiaque avec fraction d’éjection préservée,
- chez les patientes jeunes avec désir de grossesse ou en cours en alternative des IEC ou ARA2.
b) La monothérapie est recommandée en première ligne :
- chez les patients présentant une hypertension de grade 1 avec faible risque cardio vasculaire,
- chez les patients avec une tension normale haute mais un très haut risque cardio vasculaire,
- chez les patients fragiles (> 80 ans).
- Les molécules de choix seront les IEC ou les ARA-2
c) En deuxième ligne :
- Si la pression artérielle n’est pas contrôlée par une bithérapie il est recommandé d’associer un IEC ou un ARA2 avec un diurétique et un inhibiteur calcique.
- Le traitement bloquant le système rénine angiotensine aldostérone (SRAA) restant la pierre angulaire du traitement.
- Il sera préféré les formes combinées de 3 médicaments permettant la prise d’un seul comprimé.
d) En troisième ligne :
- Si la trithérapie ne suffit pas à contrôler la pression artérielle alors on est dans le cas d’une hypertension artérielle résistante (après avoir éliminé un défaut d’observance et une hypertension artérielle secondaire).
- Il faut associer à la trithérapie précédente, une faible dose de spironolactone (comme l’amiloride). Si cette molécule est mal tolérée, il faudra préférer un diurétique de l’anse, un alphabloquant ou un bétabloquant.
e) Autres thérapeutiques :
- Stimulation des barorécepteurs carotidiens (pacemaker ou stent),
- Dénervation rénale,
- Création d’une fistule artérioveineuse.
- Ces techniques ne sont pas indiquées dans le traitement de routine de l’HTA en dehors des essais cliniques ou des centres spécialisés.
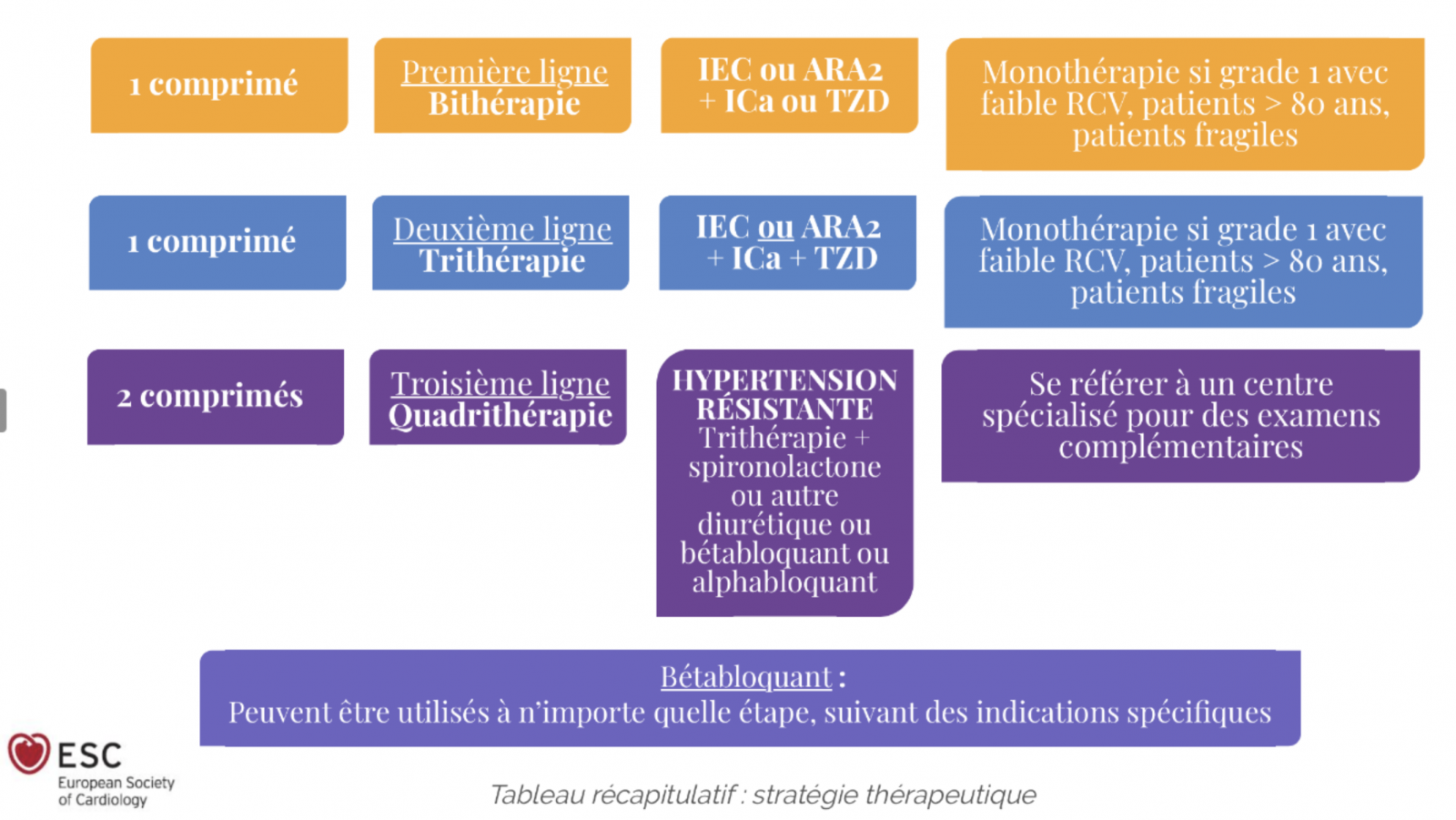
D) Prise en charge selon les recommandations HAS
- Les recommandations françaises peuvent paraitre plus simples car elles uniformisent la prise en charge et les objectifs pour presque tous les types de patient.
- Elles évoquent également la possibilité d’un traitement supra-optimal (avec des objectifs plus strict que < 140 / 90 mmHg) sans pour autant le recommander formellement.
- Enfin elles détaillent le suivi des patients par période.
- Le plan de la partie suivante suit point par point ces recommandations
1) Plan de soin initial de 0 à 6 mois : HTA non compliquée
a) Consultation d’annonce et informations
- L’HAS recommande une consultation dédiée à l’annonce et à l’éducation du patient.
- Elle sera l’objet d’informations sur les risques liés à l’HTA et sur les bénéfices du traitement. Elle permettra également de fixer les objectifs de prise en charge et d’établir le plan de soins.
b) Place des mesures hygiéno-diététiques
Elles sont recommandées pour tous les patients hypertendus, elles permettent la réduction des chiffres tensionnels et sont partie prenantes du traitement :
- Pratique d’une activité physique (30 minutes en endurance au moins 3 fois par semaine.
- Reduction du poids en cas de surcharge (sans objectif).
- Normalisation des apports sodés (6-8g/J soit natriurèse de 100 à 150 mmol/j).
- Suppression ou réduction de la consommation d’alcool avec maximum 3 verres par jour chez l’homme et 2 chez la femme.
- Arrêt de l’intoxication tabagique.
- Régime alimentaire privilégiant fruits et légumes et limitant les aliments gras et saturés.
Il est recommandé que les RHD soient initiées dès cette consultation.
c) Définition d’un cible tensionnel à atteindre à 6 mois
- Les recommandations françaises reconnaissent l’HTA (≥ 140mmHg de PAS) et l’HTA sévère (≥ 180mmHg).
- Les recommandations européennes reconnaissent 3 grades selon les valeurs de PAS/PAD, grade 1: 140-159/90-99; grade 2 : 160-179/100-109; grade 3 : ≥180 / ≥ 110.
- Les objectifs recommandés sont une PA systolique entre 130 – 139 et une PA diastolique < 90 mmHg à 6 mois de prise en charge par une mesure en cabinet.
- Les objectifs pour les mesures diurne AMT ou MAPA sont < 135/85mmHg.
- Pour le sujet de plus de 80 ans il est recommandé d’obtenir une PAS <150mmHg sans hypotension orthostatique (PAS diurne en AMT ou MAPA < 145mmHg).
- Chez les patients > 80ans la lutte contre la iatrogénie est impérative, il n’est pas recommandé d’ajouter plus de 3 molécules anti-hypertensive.
d) Eléments à prendre en compte dans le choix initial du traitement
- La plus grande partie des patients traités en ville n’ont pas de complication, cependant le choix thérapeutique doit être adapté aux comorbidités (cf plus loin).
- Les diurétiques de l’anse peuvent être prescrits à la place des diurétiques thiazidiques en cas d’insuffisance rénale sévères (DFG < 30ml/min), de syndrome néphrotique ou d’insuffisance cardiaque.
- Les IEC et les ARA2 ne doivent être associés, de plus leur utilisation nécessite un contrôle de la créatinémie, du sodium et du potassium 1 à 4 semaines après leur introduction et à chaque modifications posologiques ou en cas d’événements intercurrent.
- La dose et la molécule la plus efficiente doivent être prescrites pour chaque patient.
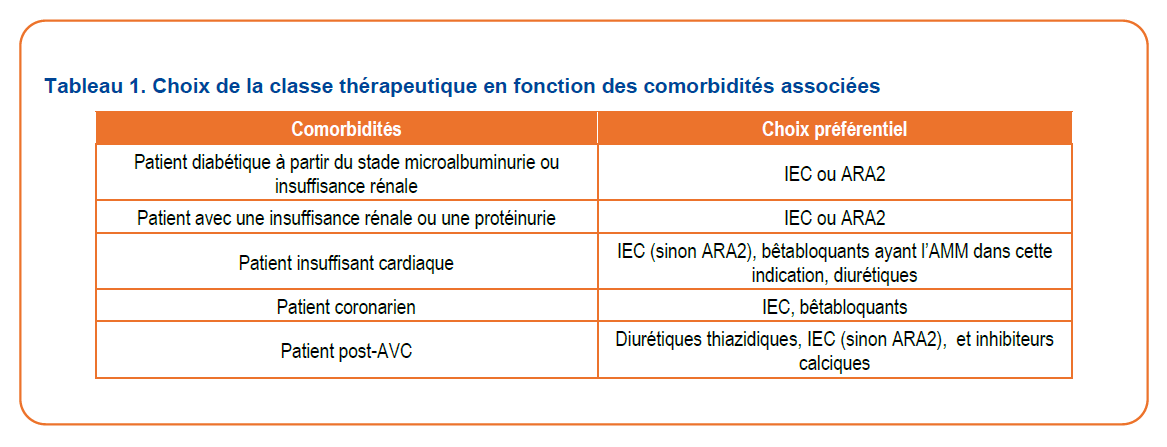
e) Adaptation du traitement au cours des 6 premiers mois
- Une monothérapie est introduite en première intention lorsque l’HTA est de découverte récente et l’HTA non compliquée (= pas sévère = < 180mmHg et sans atteinte d’organe).
- Si à 1 mois l’objectif tensionnel n’est pas atteint il faut passer à la bithérapie. Elle permet d’améliorer l’efficacité en limitant les effets secondaires liés à l’augmentation de la molécule en monothérapie.
- La bithérapie associe préférentiellement un bloqueur du système rénine-angiotensine (IEC ou ARA2) avec un inhibiteur calcique ou un diurétique thiazidique.
- Une consultation de suivi est prévu tous les mois , elle permet de suivre l’adhésion aux MHD, au traitement et de rechercher les effets secondaires potentiels.
- L’adhésion est favorisée par des traitements présentant des formes associées.
- Le plus souvent une mesure tensionnelle à domicile est recommandée pour évaluer l’efficacité du traitement, elle est recommandée avant chaque modification thérapeutique.
f) Par quelles molécules débuter ?
- Il est recommandé d’utiliser ARA 2, IEC, diurétique thiazidique, inhibiteur calcique en monothérapie et si possible en monoprise, puis en association si nécessaire.
- Les bétabloquants ne sont pas recommandés en première intention car moins efficaces en terme de protection des AVCs.
- La prescription doit se faire en DCI et la prescription de générique est encouragée. En cas d’oubli de prise, la rémanence du traitement est meilleure avec les ARA2 ou les IEC qu’avec les inhibiteurs calcique eux-mêmes meilleurs que les diurétiques thiazidiques et les bétabloquants.
2) Plan de soins ultérieur quand la PA est contrôlée à 6 mois
a) Organisation du suivi après 6 mois de prise en charge
- Une consultation est proposée tous les 3 à 6 mois, elle s’inscrit dans une démarche d’éducation pouvant associer infirmier et pharmacien.
- Elle évalue la mesure tensionnelle au cabinet, l’évaluation des éventuelles mesures réalisées en ambulatoire, la tolérance et l’adhésion au traitement et aux MHD
- La recherche d’une hypotension orthostatique est également recommandée (en particulier chez les patients diabétiques, parkinsoniens et âgés). L’hypotension orthostatique (symptomatique ou pas) est associée à une morbi-mortalité cardiovasculaire, à un déclin cognitif et à un risque de chute.
- Un contrôle biologique associant sodium, potassium, créatinémie, protéinurie est souhaitable tous les 1 à 2 ans en l’absence de co-morbidité et tous les 6 mois en cas de diabète, d’insuffisance rénale de protéinurie, d’HTA mal contrôlée, de décompensation cardiaque , d’épisode d’hypovolémie ou chez le sujet âgé.
- En l’absence de diabète ou de dyslipidémie on réalisera un contrôle glycémique et lipidique tous les 3ans.
- Un ECG est réalisé tous les 3 à 5 ans, plus fréquemment en cas de cardiopathie sous-jacente.
b) Adaptation de l’ensemble des traitements du patient hypertendu après 6 mois
- La cible tensionnelle est une PAS entre 130 et 139 mmHg et une PAD < 90 mmHg.
- Des objectifs plus ambitieux peuvent s’appliquer (120 – 129 mmHg de PAS).
- Un traitement peut être allégé en cas d’hypotension orthostatique persistante.`
- La prise des médicaments (en particulier IEC, ARA2, thiazidiques) peuvent être suspendus en cas d’événements intercurrents à type d’hypovolémie. Il faudra surveiller le ionogramme et la créatinémie.
- Une attention particulière sera portée aux associations de médicaments pouvant augmenter les chiffres de PA ou accentuer les effets secondaires.
3) Plan de soins ultérieur quand la PA n’est pas contrôlée à 6 mois
a) Vérification tensionnelle en dehors du cabinet médical
- Il est recommandé de procéder à des mesures ambulatoires par AMT ou MAPA si les objectifs tensionnels ne sont pas atteint à 6 mois.
- C’est la vérification à domicile qui permet de parler d’HTA non contrôlée.
- Il est recommandé d’évaluer l’adhésion au traitement par des questionnaires dédiés, en faisant préciser les effets secondaires ou en recherchant une diminution de la fréquence cardiaque sous bétabloquant ou calciumbloquant bradycardisant.
b) Réévaluation de l’efficacité, des facteurs de résistance et de la tolérance du traitement
- Lorsqu’une trithérapie est nécessaire elle associe le plus souvent un IEC ou un ARA2 avec un diurétique thiazidique et un inhibiteur calcique à doses optimales.
- Le contrôle de la natriurèse peut permettre d’évaluer la consommation sodée. (objectif < 200mmol/J), il faut également rechercher les facteurs aggravants (alcool, SAOS, médicaments, dépression)
- Une HTA est dite résistante en cas d’une PA non contrôlée malgré les MHD et une trithérapie associant un diurétique thiazidique
- En cas d’HTA résistante il est recommandé d’avoir recours à un avis spécialisé après vérification de tous les facteurs cités précédemment.
- L’avis spécialisé vise à éliminer formellement une cause d’HTA secondaire et à évoluer l’atteinte des organes cibles tout en optimisant la prise en charge.
- D’autres situations peuvent aussi nécessiter le recours à un spécialiste de l’HTA ou à un centre de référence (atteinte d’organe, complications CV, hypotension orthostatique persistante).
- En cas d’HTA résistance et après avoir éliminé une HTA secondaire un quatrième anti-hypertenseur peut être ajouté.
- Ce médicament est en général la spironolactone (12,5 à 50 mg/jour) sauf en cas d’insuffisance rénale sévère (DFG < 30ml/min), à défaut il peut être remplacé par un bétabloquant.
- Pour rappel en cas d’insuffisance rénale sévère le diurétique thiazidique doit être remplacé par un diurétique de l’anse et sa dose adaptée à l’état d’hydratation du patient.
E) Classes médicamenteuses
Nous allons abordé essentiellement 5 classes de traitement anti-hypertenseur :
- Inhibiteur de l’enzyme de conversion (IEC),
- Antagonistes des récepteur de l’angiotensine 2 (ARA2),
- Diurétiques thiazidiques (mais également de l’anse),
- Inhibiteurs calciques,
- Bétabloquants.
- Nous allons à présent nous concentrer sur les spécificités de chaque classe.
- NB : C’est volontairement qu’aucune « prescription type » n’est présentée. Vous restez libres et responsables de vos prescriptions, du choix de la molécule et des associations. Cependant il est rappelé les schémas thérapeutiques recommandés et les règles de bon usage des médicaments.
Les médicaments du système rénine angiotensine sont classés en trois catégories. Il n’existe pas d’exception à l’application de racines de la dénomination commune internationale : ARA II et IEC sont indiqués en première intention dans l’hypertension artérielle.
- Inhibiteurs de l'enzyme de conversion de l'angiotensine (IEC) : pril ou ‐prilate
- Antagonistes des récepteurs de l'angiotensine II (ARA II) : ‐ sartan
- Inhibiteurs de la rénine : ‐kiren
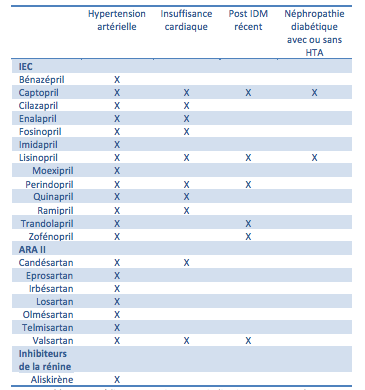
1) Les inhibiteurs de l’enzyme de conversion
Ces médicaments ont deux actions :
- Ils inhibent la conversion de l’angiotensine I (peu active) en angiotensine II. Leur effet est donc d’inhiber les effets liés à la synthèse d’angiotensine II,
- Ils augmentent les concentrations de la bradykinine. La bradykinine a des effets tissulaires locaux de vasodilatation par stimulation de la production de NO (oxyde nitrique) et de prostaglandines vasodilatatrices.
- Les IEC induisent ainsi une baisse de la pression artérielle par réduction des résistances artérielles et artériolaires périphériques.
- La chute tensionnelle est d’autant plus importante que le SRAA est stimulé (par exemple un régime hypo sodé ou un traitement diurétique).
- Les IEC en supprimant l’effet vasoconstricteur de l’angiotensine II sur l’artériole efférente du glomérule peuvent diminuer la filtration glomérulaire.
- Ceci explique que dans certains cas, une élévation de la créatinémie de 10 à 20 % puisse apparaitre après institution d’un traitement par IEC.
- Cet effet de la réduction de la filtration glomérulaire par les IEC est mis à profit pour protéger la fonction rénale et réduire la protéinurie chez les sujets diabétiques notamment.
2) Les antagonistes des récepteurs l’angiotensine II
- Ces médicaments sont 10 000 fois plus sélectifs pour le récepteur AT1 que le récepteur AT2.
- Il s’agit d’inhibiteurs compétitifs.
- Leurs effets pharmacologiques sont ceux des IEC moins les effets du catabolisme de la bradykinine.
- Ils induisent moins de phénomènes de toux ou d’angiooedème.
- Les IEC et les ARA 2 empêchent l’action de l’angiotensine II :
- Soit en inhibant la transformation de l’angiotensine I en angiotensine II pour les IEC
- Soit en se fixant sur les récepteurs à l’angiotensine II pour les ARA II
3) Effets communs aux IEC et aux ARA II
a) Interactions médicamenteuses
Intérêt de l’association avec :
- Les diurétiques thiazidique et de l’anse : Effet synergique dans l’HTA. Mais attention tout de même au risque d’hypotension artérielle et d’insuffisance rénale si la déplétion hydro sodée est trop importante.
- Les béta bloquants : en diminuant la sécrétion de rénine, les béta bloquants renforcent l’action des IEC et ARA II. Cependant cette association n’est pas recommandée en première intention lors de l’introduction d’une bithérapie (sauf chez patient coronarien).
Association potentiellement délétère :
- Les diurétiques distaux (épargneurs de potassium) : risque d’hyperkaliémie surtout en cas d’insuffisance rénale chronique ou aiguë.
- AINS : en inhibant la synthèse de prostaglandines dont certaines sont vasodilatatrices, ils antagonisent une partie des effets vasodilatateurs des IEC et réduisent ainsi une partie de leur effets anti hypertenseurs. ASSOCIATION IEC + AINS : Les AINS inhibent la vasodilatation de l’artériole afférente par les prostaglandines. Les IEC/ARA 2 inhibent la vasoconstriction de l’artériole efférente normalement faite par l’angiotensine II. La conséquence étant une diminution du débit de filtration glomérulaire avec un risque d’insuffisance rénale.
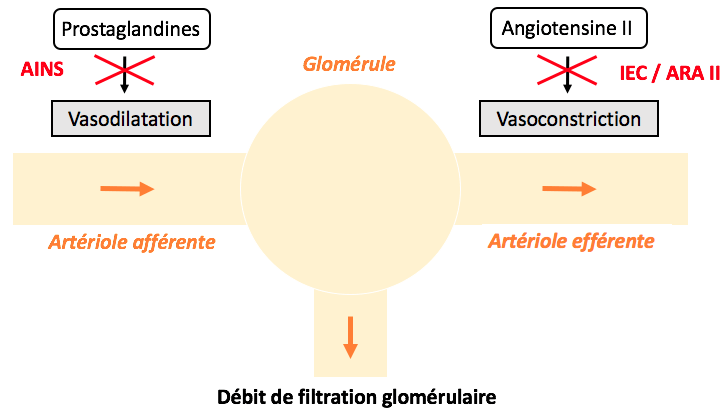
Effets secondaires
- Risque d’insuffisance rénale si sténose de l’artère rénale (car dans ce cas la vasoconstriction post glomérulaire due à l’angiotensine II est indispensable pour maintenir une pression de filtration suffisante). Ce risque est d’autant plus important en cas de sténose bilatérale rénale ou de sténose sur rein unique.
- Hypotension artérielle (risque vertiges et chutes chez le sujet âgé).
- Hyperkaliémie : ils peuvent induire une hyperkaliémie en cas d’insuffisance rénale et d’association avec un diurétique épargneur de potassium.
- Toux (surtout avec les IEC) : elle est favorisée par l’inhibition de la dégradation de la bradykinine. Elle impose souvent l’arrêt du traitement.
- Angio-œdème (avec les IEC) : rare (< 1%) mais potentiellement grave. Il met en jeu là encore très probablement la bradykinine.
Contre indications
- Sténose bilatérale des artères rénales,
- Œdème angioneurotique sous IEC,
- Grossesse (passage placentaire) : du fait de l’hypotension artérielle fœtale, survenue d’oligoamnios, de retard de croissance, et de mort fœtale in utero. La prescription de médicaments du système rénine‐angiotensine est formellement contre indiquée,
- Allaitement (passage),
- Hyperkaliémie,
- Femme en âge de procréer sans moyen contraceptif (contre indication relative).
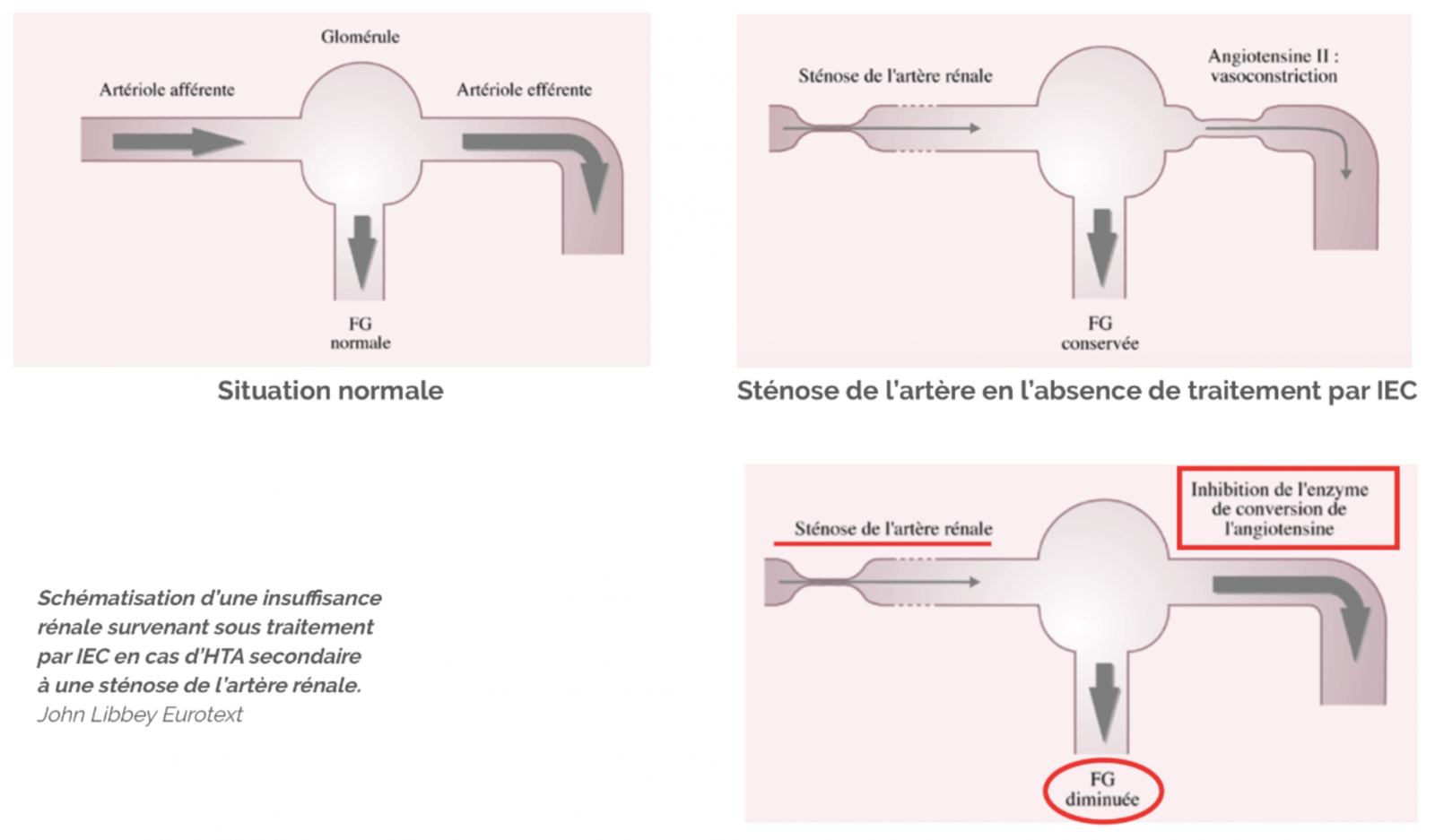
4) Traitements diurétiques
- Les diurétiques ont en commun la propriété d’augmenter l’élimination du sodium et de l’eau par le rein.
- Ils exercent cet effet par une inhibition de la réabsorption rénale du sodium.
- Cette capacité des diurétiques à négativer la balance hydrosodée explique qu’ils soient utilisés dans le traitement des états œdémateux et de l’hypertension artérielle.
a) Site d’action des différents diurétiques :
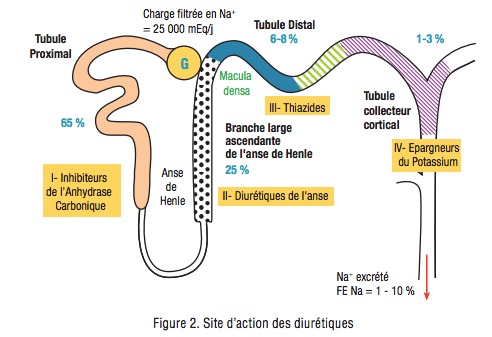
b) Il existe quatre classes de diurétiques, qui se distinguent par leur site d’action :
- Les diurétiques proximaux : ce sont les inhibiteurs de l’anhydrase carbonique (acétazolamide) et les substances osmotiques (Mannitol). Ils ne sont pas utilisés dans le traitement des syndromes œdémateux d’origine rénale, ni dans le traitement de l’HTA.
- Les diurétiques de l’anse : furosémide (Lasilix®), bumétanide (Burinex®), pirétanide (Eurelix®) ; ils inhibent la réabsorption de sodium dans la branche ascendante de l’anse de Henlé.
- Les diurétiques thiazidiques : ce sont des dérivés du benzothiazide, et sont donc des sulfamidés : hydrochlorothiazide (Esidrex®), chlortalidone (Hygroton®), indapamide (Fludex®). Ils inhibent la réabsorption de sodium sur la partie proximale du tube distal, au niveau du segment de dilution.
- Les diurétiques du tube collecteur cortical : ils regroupent l’amiloride (Modamide®) et les antialdostérones, spironolactone (Aldactone®), éplérènone (Inspra®) ; ils ont en commun la capacité de s’opposer à l’échange Na/K.
c) Diurétiques thiazidiques :
- Ils inhibent la réabsorption de sodium sur la partie proximale du tube distal, au niveau du segment de dilution.
- Au niveau du tube distal l’entrée dans la cellule du sodium filtré est médiée par un co-transporteur NaCl situé sur la membrane apicale. Les diurétiques thiazidiques inhibent directement la réabsorption de chlorure de sodium par compétition avec le site chlore du co-transporteur. Ils stimulent indirectement la réabsorption de calcium (augmentation de la réabsorption tubulaire proximale parallèle à celle du Na).
- Leur effet est faible : ils permettent une excrétion de 5 à 10 % du sodium filtré.
-
Contre indications des thiazidiques :
-
Absolues : goutte -
Relatives : syndrome métabolique, i
ntolérance au glucose, g
rossesse, h
ypercalcémie, h
ypokaliémie.
-
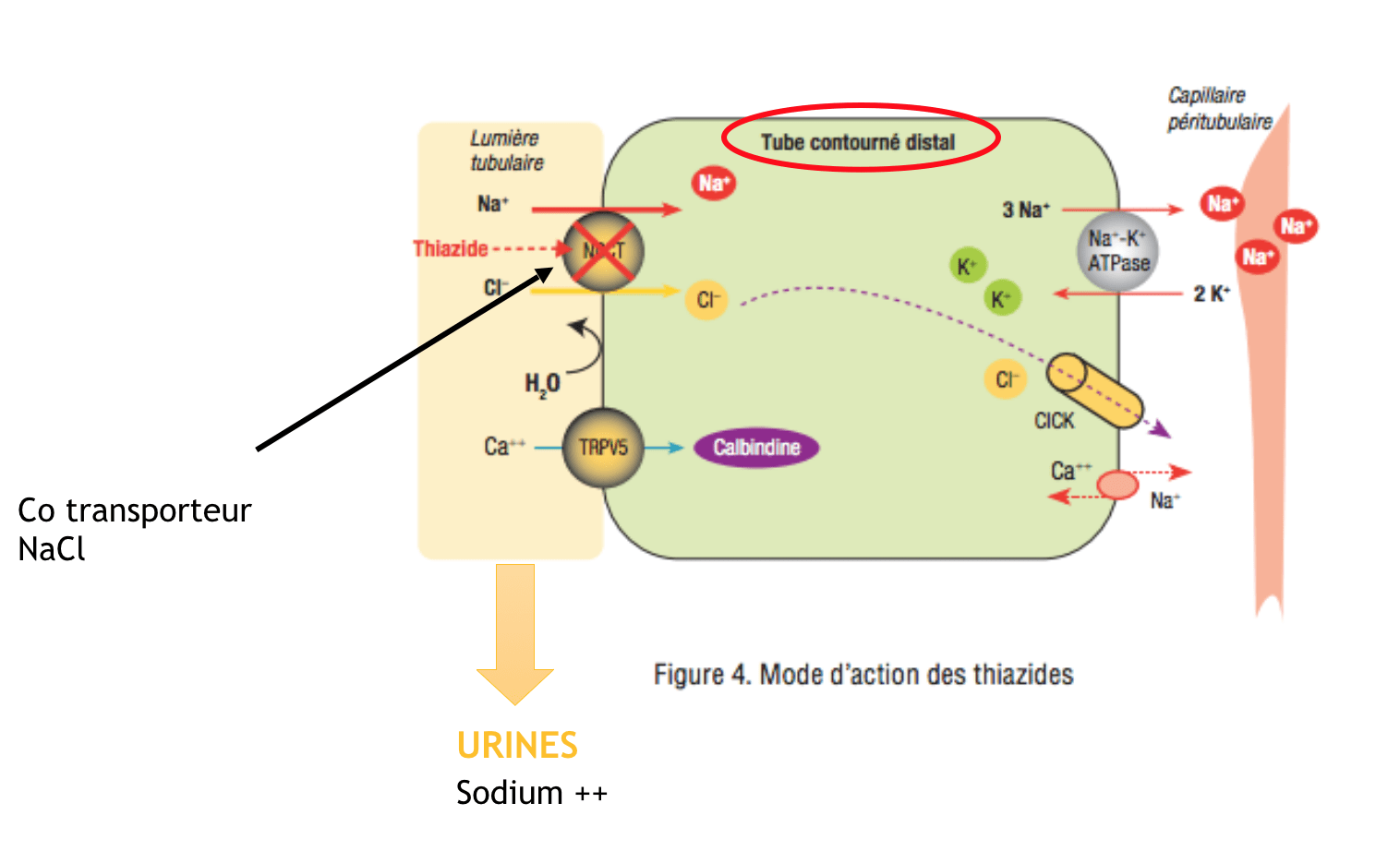
d) Diurétiques de l’anse :
- L’entrée du NaCl filtré dans les cellules du segment ascendant de l’anse de Henle est médiée par un co-transporteur Na-K-2Cl situé sur la membrane apicale de la cellule. L’énergie pour ce transfert est fournie par le gradient électrochimique favorable de sodium (faible concentration intracellulaire, électronégativité de la cellule)
- Les diurétiques de l’anse inhibent directement la réabsorption de Na, K, Cl par compétition avec le site Cl du co-transporteur. Ils permettent ainsi une excrétion de 20 à 25 % de la quantité de Na filtré (= fraction d’excrétion du Na).
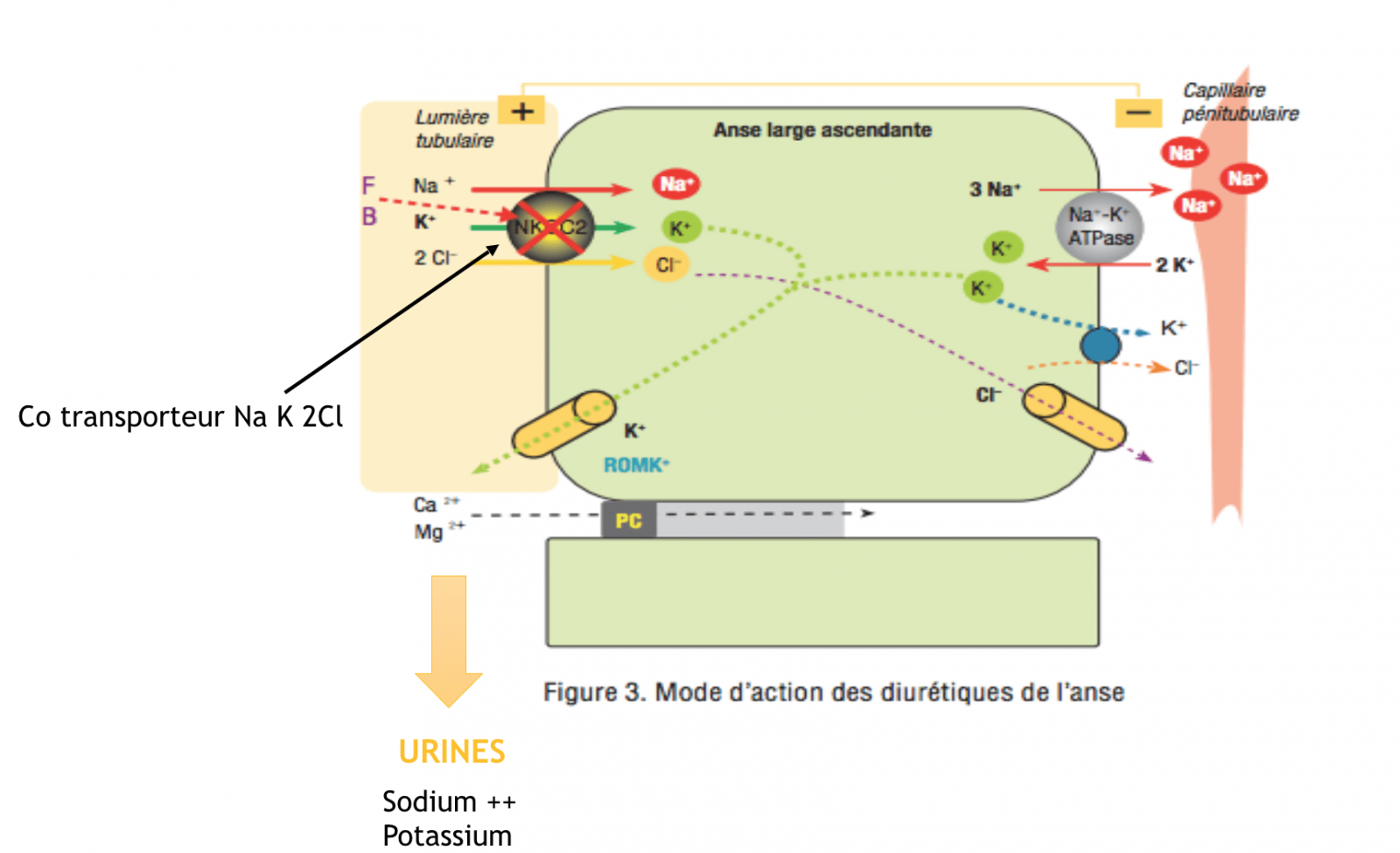
e) Diurétiques épargneurs du potassium :
- Ils interviennent au niveau de la cellule principale dans le tube collecteur cortical.
- L’entrée du sodium filtré dans ces cellules est médiée par la présence d’un canal épithélial sodique (ENaC) sur la membrane apicale. L’énergie est fournie par le gradient favorable de Na. Le Na réabsorbé est ensuite excrété de la cellule par une pompe Na-K ATPase dépendante sur la membrane basolatérale.
- L’aldostérone augmente le nombre de canaux sodés et de pompes Na-K ATPase dépendantes.
- L’effet natriurétique de ces substances est faible, entraînant une excrétion de 1 à 3 % du sodium filtré. Ils sont surtout utilisés en combinaison avec les thiazidiques pour prévenir la fuite urinaire de K.
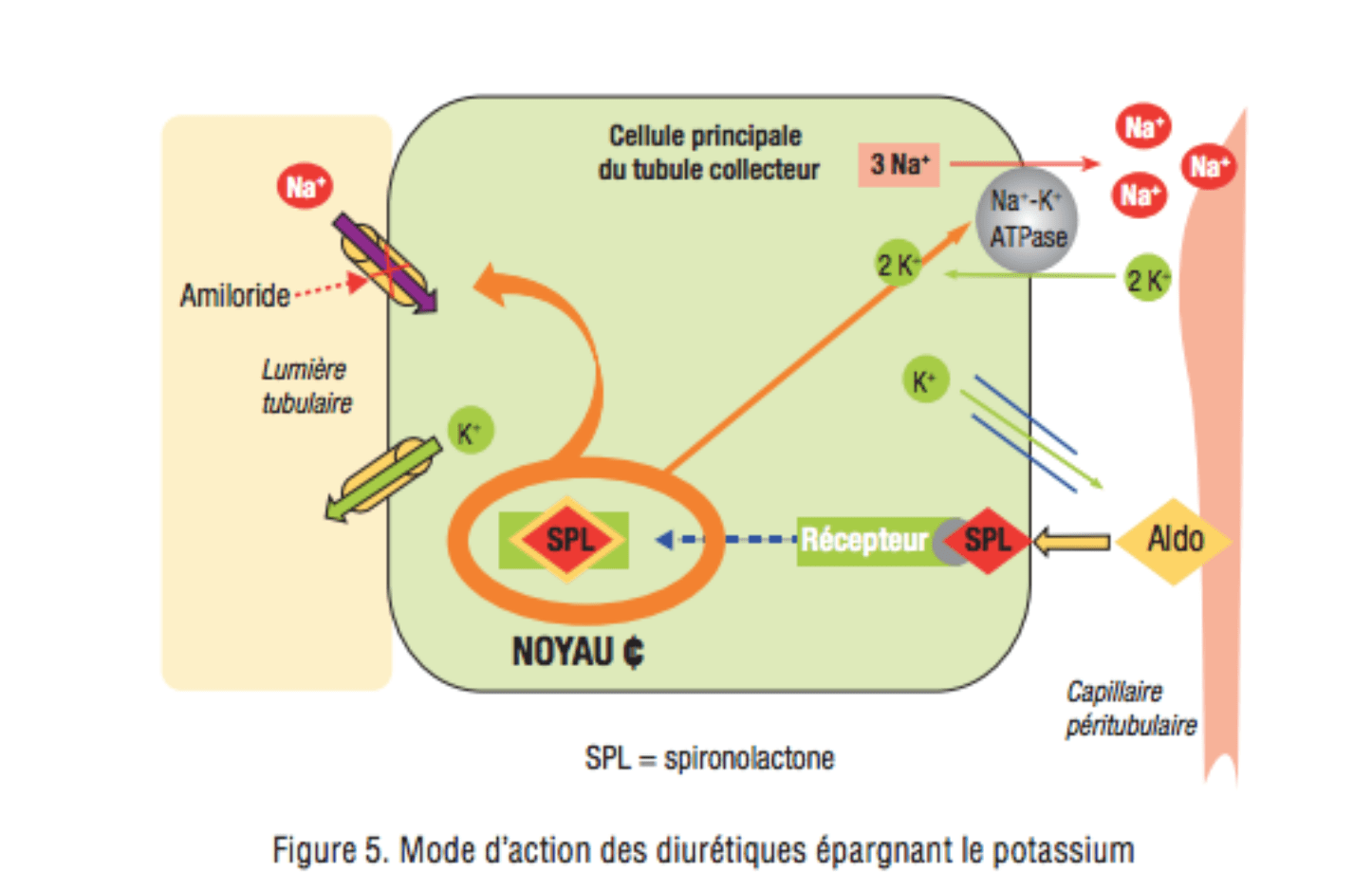
f) Aspect commun du traitement diurétique appliquée à l’HTA
- L’efficacité des diurétiques pour prévenir les complications cardiaques et vasculaires de l’HTA a été parfaitement démontrée par de multiples essais de prévention.
- Les thiazidiques figurent au rang des quatre classes médicamenteuses recommandées pour une utilisation en première intention dans l’HTA commune.
- Les diurétiques sont particulièrement efficaces chez les sujets de couleur noire et chez les personnes âgées.
- Il est nécessaire de surveiller la kaliémie.
- Les associations préférentielles sont les diurétiques épargneurs de potassium et les bloqueurs du système rénine angiotensine-aldostérone (IEC ou ARA2).
- L’effet immédiat des diurétiques est une réduction du volume plasmatique. Cette réduction entraîne une baisse du débit cardiaque qui n’est qu’incomplètement compensée par une élévation de la résistance périphérique totale. De ce fait l’administration aiguë de diurétiques à un effet anti-hypertenseur.
g) Cas particuliers :
- En cas d’hyperaldostéronisme primaire non chirurgical : la spironolactone est le traitement logique de l’hypertension
- En cas d’insuffisance rénale chronique :
- Les diurétiques thiazidiques perdent leur efficacité en cas d’insuffisance rénale (clairance de la créatinine inférieure à 30 ml/mn).
- Les diurétiques distaux exposent au risque d’hyperkaliémie grave et sont contre indiqués dans l’insuffisance rénale sévère.
- Seuls les diurétiques de l’anse conservent leur efficacité et sont licites chez un patient ayant une insuffisance rénale sévère (< 30 ml/mn de clairance). Il peut être nécessaire d’utiliser une forte posologie de furosémide pour obtenir un accroissement de la natriurèse.
h) Complications des diurétiques :
- Déplétion volémique (tous),
- Hypokaliémie (acétazolamide, thiazidiques et diurétiques de l’anse) : La mesure de la kaliémie est indispensable avant tout traitement puis régulièrement au cours du suivi,
- Hyperkaliémie (épargneurs de potassium) : Plusieurs facteurs augmentent le risque d’hyperkaliémie lors de la prise de diurétiques épargneurs de potassium : l’insuffisance rénale, la néphropathie diabétique, l’administration simultanée d’un bloqueur du système rénine-angiotensine (IEC, ARA2), la prise d’AINS, une supplémentation potassique.
- Alcalose métabolique (thiazidiques et diurétiques de l’anse),
- Acidose métabolique (acétazolamide et épargneurs de potassium),
- Hyponatrémie (thiazidiques),
- Hyperuricémie (thiazidiques et diurétiques de l’anse),
- Allergie (thiazidiques),
- Gynécomastie et troubles menstruels (spironolactone).
5) Traitements inhibiteurs calciques
- Ils ont en commun la propriété de bloquer les canaux calciques voltage dépendants de type L (prédominants au niveau cardiaque et des fibres lisses par opposition aux canaux de type N présents sur les neurones et de type T présents au niveau des glandes sécrétrices).
- Ils agissent au niveau des canaux calciques voltage-dépendants en freinant l’entrée de calcium dans les cellules musculaires lisses vasculaires et les cardiomyocytes.
- Les inhibiteurs calciques sont répartis en deux grands groupes :
- Les médicaments à effets sélectifs vasculaires prédominants les dihydropyridines : (Amlodopine, nicardipine),
- Les médicaments ayant des effets vasculaires et cardiaques bradycardisants avec les Phényl alkylamines (vérapamil) et les Benzothiazépines (diltiazem),
a) Mécanisme d’action
Les antagonistes calciques bloquent les canaux calciques voltage dépendants (le site de fixation est différent entre les trois classes d’inhibiteurs calciques). Ce blocage induit :
- Au niveau des fibres cardiaques : une réduction de l’entrée de calcium lors du potentiel d’action ce qui réduit la contractilité et ralentit la conduction auriculo-ventriculaire.
- Au niveau du nœud sinusal : le blocage des canaux calciques aboutit à une réduction de l’automaticité sinusale (baisse de la fréquence cardiaque)
→ Donc effet inotrope, chronotrope et dromotrope négatifs.
- Une relaxation des fibres lisses vasculaires entrainant une baisse des résistances artérielles et donc une baisse de la pression artérielle. Cette baisse de la pression artérielle entraine une stimulation sympathique réflexe et une stimulation du SRAA.
On obtient ainsi deux profils d’antagoniste calcique selon que l’effet vasculaire ou que l’effet cardiaque est prédominant
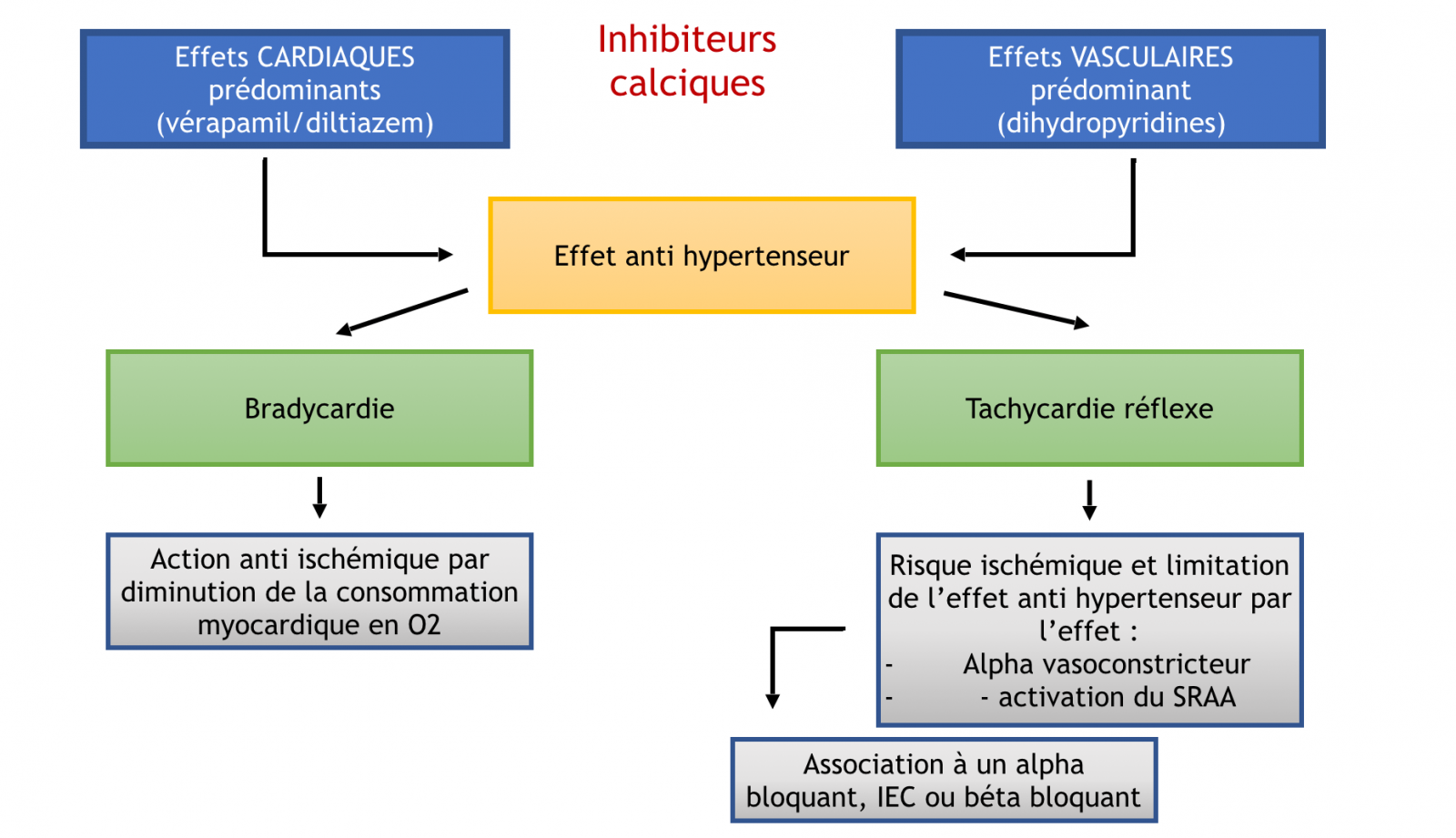
b) Effets indésirables :
- Hypotension artérielle,
- Œdèmes des chevilles,
- Bradycardie sinusale, bloc sino auriculaire, BAV avec vérapamil ou diltiazem,
- Décompensation cardiaque chez insuffisant cardiaque par effet inotrope négatif,
- Constipation par effet relaxant intestinal,
- Flush (dihydropyridines).
c) Précautions d’emploi :
- Sujet âgé : augmentation progressive des posologies avec notion pour plusieurs, inhibiteurs calciques d’une dose max à ne pas dépasser,
- Insuffisance hépatique : prudence chez le cirrhotique,
- Insuffisance rénale : pas d’adaptation posologique à réaliser.
d) Contre indications relatives :
- Tachyarythmie,
- Insuffisance cardiaque avec FEVG altérée,
- Œdème des membres inférieurs préexistant.
6) Traitements béta bloquants
a) Effets physiologiques de l’inhibition des récepteurs béta adrénergiques :
- Bêta 1 : Cœur : inotrope négatif, chronotrope négatif : diminution du débit cardiaque et donc diminution de la pression artérielle. Dromotrope négatif et bathmotrope négatif, Rein : diminution de la sécrétion de rénine.
- Bêta 2 : Vaisseaux périphériques : vasoconstriction, Bronches : bronchoconstriction.
b) Classification
- Les béta bloquants peuvent être classés en « cardio sélectifs » ou « non cardio sélectifs » en fonction de leur sélectivité pour les récepteurs B1 adrénergiques.
- Cardio sélectifs : aténolol, bisoprolol, métoprolol, nébivolol, esmolol,
- Non cardio sélectifs : labétalol, propranolol.
c) Effets indésirables :
- Bradycardie,
- Hypotension,
- Fatigabilité musculaire lors des efforts,
- Cauchemars, insomnie,
- Troubles sexuels,
- Hypoglycémie chez le diabétique.
d) Contre-indications :
- Insuffisance cardiaque décompensée,
- Bradycardie,
- Hypotensions symptomatiques sévères,
- Bloc atrio ventriculaire,
- Angor de prinzmetal,
- Asthme sévère.
7) Traitements alfa bloquants
a) Mécanisme d’action
- Ce sont des anti hypertenseurs, anti adrénergiques périphériques qui :
- Bloquent les récepteurs alpha 1 adrénergiques périphériques post synaptiques au niveau des artérioles et des veines,
- Bloquent les récepteurs alpha 1 adrénergiques centrales avec réduction du tonus sympathique et de la pression artérielle.
- Chez l’hypertendu, ces effets se traduisent rapidement par une diminution des pressions artérielles systolique et diastolique, en décubitus, en position debout, au repos et à l’effort sans augmentation reflexe de la fréquence cardiaque.
- Ils ne sont pas recommandés dans les traitements de première ligne.
b) Classification
- Les deux alpha bloquants disponibles avec une action anti hypertensive sont :
- La prazosine, L’uradipil.
c) Contre-indications :
- Association des alpha bloquants entre eux,
- Grossesse et allaitement,
- Uradipil : contre indiqué chez l’enfant < 12 ans.
PRÉVENTION
Votre texte ici
SURVEILLANCE
A) Suivi des patients, rythme et situations
1) Suivi des patients avec une pression artérielle normale haute et hypertension « blouse blanche » :
- Ces patients ont souvent d’autres facteurs de risque cardio vasculaires (notamment des atteintes d’organes liées à l’hypertension) et ont un risque élevé de développer une hypertension.
- Ils doivent être suivis au même titre que les patients hypertendus.
- A chaque visite, il est recommandé de rappeler et renforcer les mesures hygiéno-diététiques
2) Suivi des patients hypertendus, plan de soins pendant les 6 premiers mois :
- Après initiation d’un traitement anti hypertenseur, le patient doit être revu au moins une fois dans les deux premiers mois puis très régulièrement pendant les 6 premiers mois jusqu’à obtention du contrôle tensionnel pour évaluer la tolérance et l’efficacité du traitement, renforcer l’éducation et parfaire l’information du patient.
- La fréquence des visites médicales dépend de la sévérité de l’hypertension, de l’urgence à la normaliser et des comorbidités du patient.
- La bithérapie en un seul comprimé pourrait diminuer la tension dans les 1 à 2 semaines jusqu’à 2 mois après le début du traitement.
- L’utilisation des IEC et des ARA2 nécessite un contrôle du sodium et du potassium plasmatiques et de la créatininémie dans un délai de 1 à 4 semaines après l’initiation du traitement puis lors des modifications posologiques ou en cas d’événement intercurrent
3) Suivi des patients hypertendus, plan de soins ultérieur chez le patient dont la pression artérielle est contrôlée à 6 mois :
- Une consultation de suivi auprès du médecin généraliste est proposée tous les 3 à 6 mois. Elle s’inscrit aussi dans le cadre d’une démarche d’éducation thérapeutique à laquelle le pharmacien ou l’infirmier peuvent être associés.
- Cette consultation a pour objectif de rechercher les symptômes, de surveiller le niveau tensionnel, et d’évaluer la tolérance et l’adhésion au traitement médicamenteux et aux mesures hygiéno-diététiques.
- La surveillance tensionnelle comprend la mesure de la PA au cabinet médical, et l’analyse de mesures tensionnelles récentes faites au domicile.
- Un contrôle biologique (Na, K, créatininémie, recherche de protéinurie quelle que soit la méthode) est souhaitable tous les 1 à 2 ans, ou plus fréquemment en cas de diabète, d’insuffisance rénale, de protéinurie, d'HTA mal contrôlée, de décompensation cardiaque ou d’autres événements intercurrents. Cette surveillance doit être plus fréquente chez le sujet âgé.
- En l’absence de diabète ou de dyslipidémie, un contrôle biologique (glycémie à jeun et exploration d’une anomalie lipidique est souhaitable tous les 3 ans.
- Un ECG est justifié tous les 3 à 5 ans, ou plus fréquemment en cas de symptômes cardiaques ou de cardiopathie sous-jacente.
- Pour les patients dont la tension est stabilisée depuis plusieurs mois/années, il est conseillé de revoir le patient minimum tous les 2 ans pour évaluer les facteurs de risque cardio vasculaires et les atteintes d’organes liées à l’hypertension
4) Suivi des patients hypertendus, plan de soins ultérieur lorsque la pression artérielle n’est pas contrôlée à 6 mois :
- À 6 mois, si la pression artérielle de consultation n’est pas contrôlée, il est recommandé de réaliser une mesure tensionnelle à domicile ou en ambulatoire. C’est seulement lorsque la pression artérielle n’est pas à l’objectif dans ces cas là que l’on peut parler d’hypertension non contrôlée.
- Ceci doit conduire le médecin à rechercher la cause de cette hypertension persistante et notamment l’observance au traitement et aux mesures hygiéno-diététiques.
La tension artérielle doit être prise au moins :
- Tous les 5 ans si elle est optimale
- Tous les 3 ans si elle est normale
- Tous les ans si elle est normale haute
Chez les plus de 50 ans, le dépistage doit être plus fréquent du fait d’une augmentation de la PA systolique avec l’âge.
B) Stratégie d’amélioration globale de la prise en charge des patients
- La mauvaise observance est une des causes les plus importantes de mauvais contrôle tensionnel.
- La non observance à un traitement anti hypertenseur est un facteur de risque élevé d’événements cardio vasculaires.
- La vérification de l’adhésion est toujours difficile, mais peut être facilitée par les informations recueillies auprès du pharmacien, des autres professionnels de soins (infirmier, etc.) et de l’entourage du patient. Une coopération pluri professionnelle est encouragée. La reconnaissance précoce d’un manque d’observance peut diminuer le nombre d’investigations complémentaires à la recherche d’une cause de l’hypertension artérielle persistante et évite la prescription de médicaments complémentaires.
- Une des recommandations majeure est de simplifier la stratégie thérapeutique pour essayer d’améliorer l’observance des patients notamment par la prescription d’une bithérapie d’emblée en un seul comprimé.
1) Méthodes pour évaluer l’observance d’un patient
- Dosage des médicaments anti hypertenseurs dans le sang ou les urines (rare).
- En recherchant un ralentissement de la fréquence cardiaque sous bétabloquants ou sous inhibiteurs calciques bradycardisants.
- Surveillance de la natriurèse (objectif < 150 – 200 mmol/jour).
- Mesures à domicile ou en ambulatoire.
- Questionnaires dédiés (précisant les difficultés de prise, recherchant les effets secondaires du traitement) mais ils surestiment souvent l’observance du patient.
➔ L’évaluation de l’observance doit être améliorée par le développement de méthodes peu coûteuses, facilement reproductibles et utilisables en pratique quotidienne.
- Des techniques de e-santé pourraient permettre dans l’avenir de contrôler l’observance des patients par des appareils d’automesures connectés et des piluliers connectés.
2) Interventions ayant pour but l’amélioration de l’observance
a) A l’échelle du médecin :
- Prodiguer des informations concernant les risques d’une hypertension et les bénéfices du traitement, l’importance des mesures hygiéno-diététiques,
- Responsabilisation du patient,
- Evaluation et résolution des potentiels obstacles à l’adhérence du traitement et en particulier des effets secondaires,
- Collaboration avec d’autres spécialités paramédicales : infirmiers, pharmaciens.
b) A l’échelle du patient :
- Mesure à domicile de la pression artérielle,
- Groupes d’échanges,
- Accompagnements familial, social ou infirmier,
- Autogestion à l’aide de guides d’informations pratiques.
c) A l’échelle thérapeutique :
- Simplification de la prise médicamenteuse par la prescription d’une bithérapie en un seul comprimé,
- Rappels sur les boîtes de médicaments,
- Limitation des effets secondaires (utilisation des doses minimales efficaces)
d) A l’échelle du système de santé :
- Développement des systèmes de suivi : téléphonique, visites à domicile, télétransmission des données des mesures prises à domicile,
- Favoriser la collaboration entre les différents prestataires médicaux : médecins, pharmaciens, infirmiers,
- Remboursement des médicaments,
- Développement d’un recueil de données national (incluant les prescriptions médicales) accessibles aux infirmiers et pharmaciens,
- Faciliter l’accès aux médicaments.
Des consultations et des séances d’éducations thérapeutiques sont réalisables auprès des pharmaciens. Ces procédures font l’objet d’une circulaire de la société francaise d’hypertension. Ces entretiens pharmaceutiques dans l’HTA à l’officine sont prévus par la loi santé de 2009 et font l’objet de points précis :
- Faire le point sur l’état de la connaissance du malade
- Faire le point sur ses acquis et sur ses croyances
- Faire le point sur ses difficultés vis-à-vis de sa maladie
- Le suivi et l’évaluation de l’HTA
C) Stratégie de réduction ou d’arrêt des traitements
- Pour quelques patients dont le traitement anti hypertenseur est associé à un contrôle optimal de la tension pendant une période prolongée, il est possible de réduire le nombre ou la posologie des médicaments.
- Ceci est le cas par exemple lorsque le contrôle tensionnel est accompagné d’une modification du mode de vie avec une alimentation saine, une perte de poids, un exercice physique régulier.
- Dans tous les cas, cette modification thérapeutique doit se faire progressivement et doit faire l’objet de visites régulières car la réapparition d’une hypertension peut se faire plus ou moins rapidement, en quelques semaines ou quelques mois.
- Les patients avec un antécédent d’aggravation rapide de la tension ou d’atteinte d’organe liée à l’hypertension ne doivent pas bénéficier d’une décroissance thérapeutique.
D) Prise en charge de l’hypotension orthostatique
- La prise en charge de l’hypotension orthostatique fait également l’objet de recommandations propres éditées par la société française d’hypertension. Vous en trouverez ici quelques points essentiels.
- La définition est une diminution de la PA systolique d’au moins 20 mmHg et/ou de la PA diastolique d’au moins 10 mmHg survenant dans les 3 minutes suivant un passage en position debout
- Elle doit être recherchée systématiquement chez les hypertendus ou en cas de comorbidité (âge >65ans, parkinson, diabète, dénutrition…)
- Sa recherche se fait en cabinet après un repos d’au moins 5 minutes en position allongée.
- La mesure de la fréquence cardiaque est importante lors du diagnostic car elle va permettre d’orienter vers une origine neurogène ou non qui sera suspectée devant des signes de dysautonomies et confirmée par MAPA.
- Il est primordial d’éliminer les causes iatrogènes et hypovolémiques.
- La prise en charge repose sur des mesures non pharmacologiques (hydratation, bas de contention, éducation et décomposition du lever) et par des mesures pharmacologiques (diminution, arrêt ou changement des traitements ou midodrine en cas d’étiologie neurogène).
E) Prise en charge du risque cardio-vasculaire
- Les récentes recommandations sur la prise en charge des dyslipidémies ont été retirées par la HAS pour des causes de conflit d’intérêt. En revanche les recommandations européennes sont toujours en vigueur, en voici la synthèse en ce qui concerne le patient hypertendu.
- Pour rappel : l’évaluation du risque cardio vasculaire avec le système SCORE est recommandée chez les patients hypertendus qui n’ont pas déjà un haut ou très haut risque cardiovasculaire du à une maladie cardiovasculaire documentée, une insuffisance rénale ou un diabète.
- Les patients hypertendus, et encore plus ceux qui sont également diabétiques de type 2 ou qui présentent un syndrome métabolique, ont souvent une dyslipidémie athérogène caractérisée par des taux élevés de triglycérides et de LDL cholestérol (LDLc) et des faibles taux de HDL cholestérol (HDLc).
- Les statines peuvent être prescrites dans ce cadre
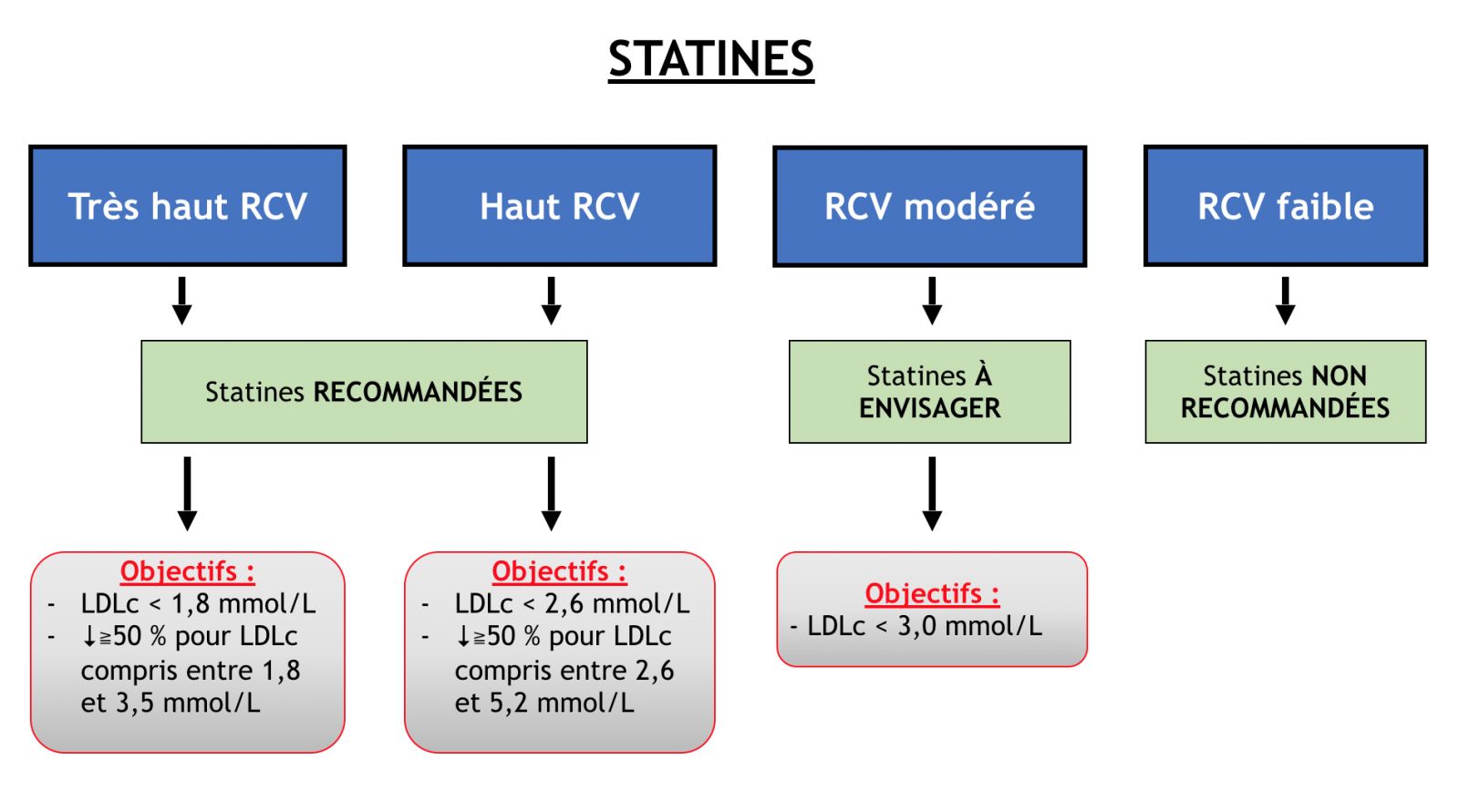
F) Traitement anti-agrégant plaquettaire
- La plus courante des complications de l’hypertension est liée à des phénomènes thrombotiques.
- L’hypertension prédispose à un état pro-thrombogène, à une artériopathie des membres inférieurs, une dysfonction cardiaque ou une fibrillation atriale qui sont des situations souvent associées à un phénomène thromboembolique, systémique ou veineux.
- Un traitement antiplaquettaire n’est pas recommandé en prévention primaire chez les patients hypertendus sans maladie cardiovasculaire documentée.
- Un traitement antiplaquettaire par aspirine à faibles doses est recommandé en prévention secondaire chez les patients hypertendus.
CAS PARTICULIERS
A) HTA résistante
1) Définition
L’hypertension est dite résistante lorsque :
- Le traitement (mesures hygiéno diététiques associées à un traitement à des posologies optimales d’un IEC ou ARA2, d’un diurétique et d’un inhibiteur calcique) ne permet pas d’avoir une pression artérielle < à 140 de PAS et/ou < à 90 mmHg de PAD.
- L’HTA est confirmée par des mesures à domicile ou en ambulatoire.
- Une pseudo hypertension (notamment mauvaise observance) et une cause d’hypertension artérielle secondaire sont exclues.
2) Epidémiologie
La prévalence de l’HTA résistante concerne moins de 10 % des patients. Ils sont à haut risque d’atteinte d’organes liées à l’HTA, d’insuffisance rénale et d’événements cardiovasculaires précoces
3) Traitement et prise en charge
- Renforcement des mesures hygiéno-diététiques (notamment la restriction salée avec contrôle de la natriurèse et objectif < 200 mmol/jour).
- Ajout d’une faible dose de spironolactone à la trithérapie en cours.
- Si la spironolactone ne peut pas être utilisée ou est mal tolérée, choisir alors un autre diurétique (eplerone, amiloride, dose augmentée de thiazidique, diurétique de l’anse) ou ajouter un bétabloquant ou de la doxazosine.
- Il faut avoir recours à un avis spécialisé et s’acharner à éliminer toutes origines secondaire ou facteurs aggravants (SAOS, consommation d’alcool, médicaments, etc…)
B) HTA pseudo-résistante
- Il s’agit d’une HTA répondant mal au traitement associant RHD et trithérapie anti-hypertensive.
- A la différence de l’HTA résistante on retrouve des facteurs aggravants ou favorisants :
- mauvaise observance,
- HTA blouse blanche,
- matériel inadapté,
- posologies inadaptées.
- Calcifications des artères brachiales (surtout chez les personnes âgées) : la médiacalcose (calcifications de la média des artères) est particulièrement fréquente chez le diabétique et l’insuffisant rénal chronique. Elle se retrouve le plus souvent au niveau des membres inférieurs mais également au niveau des membres supérieurs. Dans les cas très avancés, les artères sont alors incompressibles et la mesure de pression artérielle n’est pas réalisable. Dans les cas intermédiaires, la mesure de la pression artérielle peut être faussement élevée. En pratique donc, la constatation d’une médiacalcose significative doit faire mettre en question la fiabilité de la mesure de pression artérielle systolique et nécessite parfois de prendre la pression artérielle à l’orteil.
C) HTA masquée et HTA blouse blanche
- L’HTA masquée est définie par des PA normales en cabinet mais élevées en ambulatoire. Elle est plus fréquente chez les sujets diabétiques. Cette situation est associée à un risque cardiovasculaire accru.
- L’HTA blouse blanche est définie par des PA normales en ambulatoire mais élevées au cabinet.
- Dans les deux cas, il est recommandé d’améliorer le mode de vie en insistant sur les mesures hygiéno-diététiques pour diminuer le risque cardio vasculaire mais également de proposer un suivi plus régulier avec des mesures de pression artérielle à domicile et en ambulatoire plus rapprochées
D) HTA et diabète
- Un traitement antihypertenseur est recommandé chez le diabétique dès lors que sa pression artérielle est supérieure à 140/90 mmHg
- Chez le diabétique, les recommandations européennes sont :
- de cibler une pression artérielle systolique entre 120 et 129 mmHg,
- chez les plus de 65 ans, de cibler une pression artérielle systolique entre 130 et 139 mmHg,
- de cibler une pression artérielle diastolique entre 70 et 80 mmHg.
- Il n’y a pas d’objectif tensionnel spécifique dans les recommandations HAS mais la recherche d’une microalbuminurie par le rapport albumine/créatinine doit être rapprochée.
- Chez le diabétique, le traitement antihypertenseur de première intention doit associer un inhibiteur du système rénine angiotensine avec un inhibiteur calcique ou un diurétique thiazidique
E) HTA et insuffisance rénale chronique
- L’hypertension est un facteur de risque majeur de développement et d’aggravation d’une insuffisance rénale peu importe la cause initiale de l’insuffisance rénale.
- Chez les patients insuffisants rénaux diabétiques ou non, il est recommandé de traiter une hypertension par des mesures hygiéno-diététiques et un traitement médicamenteux si celle-ci est supérieure à 140/90 mmHg.
- Chez les patients insuffisants rénaux diabétiques ou non, il est recommandé au niveau européen de cibler une pression artérielle systolique entre 130 et 139 mmHg
- Les inhibiteurs du système rénine angiotensine (IEC ou ARA2) sont plus efficaces pour réduire l’albuminurie, ils sont recommandés en première intention si le patient présente une microalbuminurie ou une protéinurie.
- Chez le patient insuffisant rénal chronique, il est recommandé d’utiliser en première intention un inhibiteur du système rénine angiotensine avec un inhibiteur calcique ou un diurétique.
- Pas de recommandation spécifique de l’HAS mais une surveillance rapprochée de la créatinémie et de la protéinurie.
- Pour rappel les diurétiques thiazidiques ne sont plus recommandés si le DFG est < 30ml / min (insuffisance rénale sévère ou terminale)
F) HTA, hypertrophie du ventricule gauche et insuffisance cardiaque
- Chez les patients présentant une insuffisance cardiaque avec fraction d’éjection conservée, la trithérapie (si nécessaire) recommandée se compose d’un IEC ou ARA2 avec un bétabloquant et un diurétique. Si l’HTA est résistante, alors un antagoniste des récepteurs aux minéralocorticoïdes (spironolactone ou eplerone) peut être ajouté.
- Chez les patients présentant une hypertrophie ventriculaire gauche, il est recommandé :
- D’utiliser un inhibiteur du système rénine angiotensine (IEC ou ARA2) avec un inhibiteur calcique ou un diurétique,
- De cibler la pression artérielle systolique entre 120 et 130 mmHg (recomandations européennes)
G) HTA et accident vasculaire cérébral
- L’hypertension est un facteur de risque majeur d’accidents ischémique et hémorragique cérébraux.
- Il peut être indifféremment d’origine ischémique ou hémorragique.
- Chez les patients hypertendus présentant un accident vasculaire cérébral, il est recommandé de débuter un traitement antihypertenseur pour prévenir une récidive ou l’apparition d’autres événements cardiovasculaires :
- d’emblée dans le cadre d’un accident ischémique transitoire,
- après quelques jours dans le cadre d’un accident ischémique constitué.
- Les médicaments antihypertenseurs recommandés dans le cadre de la prévention de la récidive d’un accident vasculaire cérébral sont les bloqueurs du système rénine angiotensine (IEC ou ARA2) associés à un inhibiteur calcique ou un diurétique thiazidique.
- Les bétabloquants sont les médicaments les moins efficaces dans le cadre de la prévention Iaire et IIaire de l’AVC.
H) HTA et coronaropathie
- Chez les patients atteints de coronaropathie recevant un traitement antihypertenseur, les recommandations européennes préconisent :
- De cibler une pression artérielle systolique entre 120 et 129 mmHg,
- Chez les plus de 65 ans, de cibler une pression artérielle systolique entre 130 et 139 mmHg
- De cibler une pression artérielle diastolique entre 70 et 80 mmHg.
- Il n’ y a pas de recommandation spécifique de l’HAS.
- Reco HAS et européennes se rejoignent sur le traitement.
- Chez les patients hypertendus avec antécédent d’infarctus du myocarde, il est recommandé d’utiliser des bétabloquants et des inhibiteurs du système rénine angiotensine (IEC ou ARA2) comme médicaments de première intention.
- Chez les patients hypertendus présentant un angor il est recommandé d’utiliser des bétabloquants et/ou des inhibiteurs calciques comme médicaments antihypertenseurs de première intention.
I) HTA et fibrillation auriculaire
- L’hypertension prédispose à des arythmies cardiaques (notamment la fibrillation atriale et plus rarement des arythmies ventriculaires) qui doivent être considérées comme des manifestations cardiaques causées par l’hypertension.
- La fibrillation atriale augmente le risque d’accident vasculaire cérébral et d’insuffisance cardiaque.
- Chez les patients hypertendus présentant également une fibrillation atriale, il est préférable d’utiliser des béta-bloquants ou des inhibiteurs calciques bradycardisants (vérapamil et diltiazem). Les inhibiteurs calciques sont à éviter lorsque le patient présente une fraction d’éjection diminuée.
- Devant un patient présentant une fibrillation atriale, il est recommandé de rechercher une hypertension artérielle.
- Une anticoagulation orale préventive est recommandée chez les patients hypertendus présentant une fibrillation atriale et un score de CHA2DS2VASc ≥ 2.
- Pour Rappel les méthodes d’automesures et les techniques oscillométriques ne sont pas recommandées en cas d’arythmies complètes.
J) HTA, anévrisme et dissection aortique
- Une hypertension chronique peut être associée à un risque modéré de dilatation aortique proximale.
- Les patients hypertendus présentant un anévrisme aortique associé ou non à un syndrome de Marfan ou à une bicuspidie aortique, doivent avoir une pression artérielle inférieure ou égale à 130/80 mmHg.
- Chez les patients atteints du syndrome de Marfan, un traitement préventif par IEC, ARA2 ou béta-bloquant semble réduire la progression d’un anévrisme aortique ou l’apparition de complications.
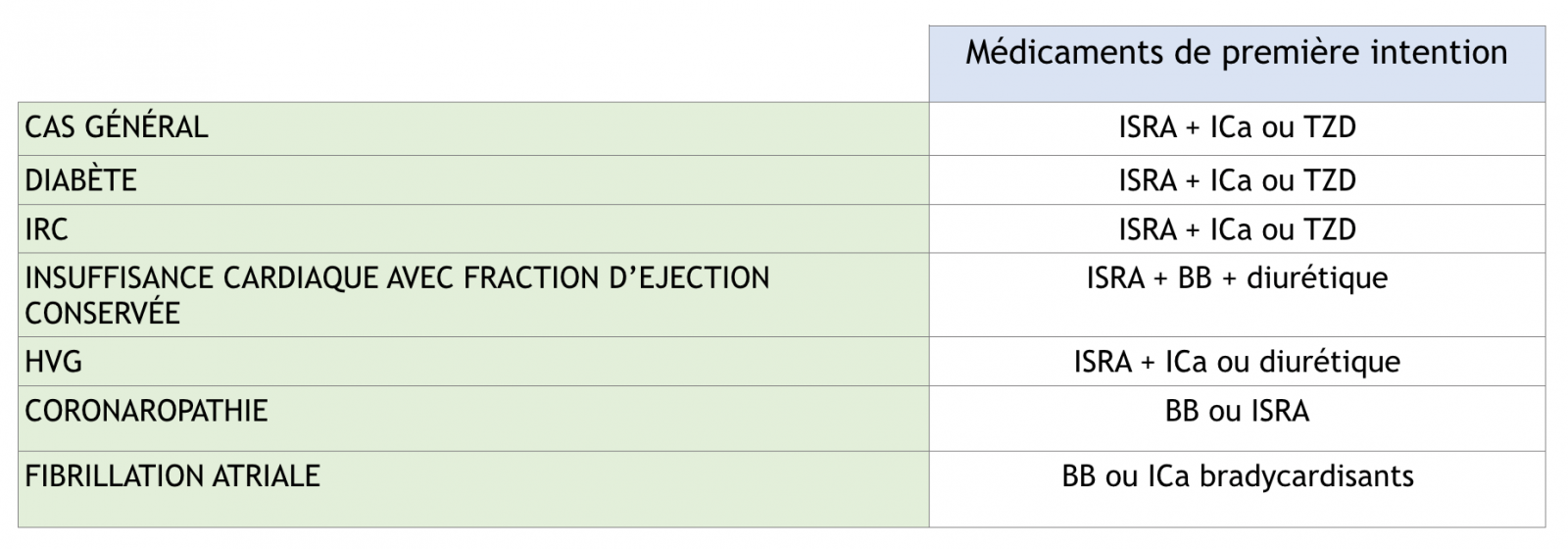
K) HTA et grossesse
1) Généralités
- L’hypertension gravidique (pendant la grossesse) fait l’objet de recommandations spécifiques dont voici les principales lignes.1
- Il s’agit d’une pathologie fréquente de grossesse (5 à 10 % des parturientes) et qui est une source majeure de morbi-mortalité materno-fœtale.
- Les risques maternels comprennent les décollements placentaires, les AVC, les défaillances multiples d’organes, l’éclampsie et le décès.
- Le fœtus est exposé à un haut risque de retard de croissance intra utérin, de prématurité voire de mort intra utérine.
2) Définition
- La définition de l’hypertension gravidique est basée sur des mesures prises en cabinet.
- Pression artérielle systolique 140 mmHg et/ou Pression artérielle diastolique 90 mmHg
- Modérée : PAs entre 140 et 159 mmHg et PAd entre 90 et 109 mmHg
- Sévère : 160/110 mmHg
3) L’HTA chez la femme enceinte comprend plusieurs entités
- HTA pré existante : existe avant le début de la grossesse ou se développe avant la 20ème semaines d’aménorrhée. Elle persiste généralement après les 6 semaines post-partum et peut être associée à une protéinurie.
- HTA gestationnelle : se développe après la 20ème SA et se normalise généralement dans les 6 semaines post-partum.
- Pré-éclampsie : HTA gravidique associée à une protéinurie > 0,3 g/24h. La pré éclampsie est suspectée lorsqu’elle est associée à des céphalées, des douleurs abdominales, une thrombopénie, une insuffisance hépatique. Elle doit conduire à la recherche rapide d’une protéinurie pour confirmation diagnostique. Elle est plus fréquente chez la Primipare, en cas de Grossesse multiple, Môle hydatiforme, Syndrome des anti phospholipides, d’HTA préexistante, d’Insuffisance rénale et de Diabète. Elle est souvent associée à un retard de croissance intra utérin du à une insuffisance placentaire et elle est souvent la cause d’une prématurité.
4) La Prévention de la pré éclampsie est réalisable (ressort du spécialiste) :
- Si risque modéré ou élevé de pré- éclampsie : indication d’aspirine (100-150mg) entre la 12ème et 36ème semaines d’aménorrhée
- Critères de risque élevé :
- Maladie hypertensive au cours d’une précédente grossesse
- Insuffisance rénale
- Maladie auto-immune tels que le lupus érythémateux systémique ou le syndrome des antiphospholipides
- Diabète de type 1 ou de type 2
- Hypertension chronique.
- Critères de risque modérés de pré-éclampsie :
- Primipare,
- Age ≥ 40 ans,
- Intervalle entre deux grossesses > 10 ans,
- IMC de ≥ 35 kg / m2,
- Antécédents familiaux de pré-éclampsie,
- Grossesse multiple
5) Conduite à tenir :
a) Mesures de la pression artérielle
- Position assise ou en position latérale gauche,
- Brassard de taille adaptée,
- Au niveau du cœur,
- Méthode auscultatoire (les méthodes automatiques ont tendance à sous-estimer la pression artérielle chez la femme enceinte).
b) Examens complémentaires
- A réaliser systématiquement chez la femme enceinte hypertendue : Analyse d’urine avec protéinurie, Numération formule sanguine, plaquettes, Hématocrite, Bilan hépatique, Créatininémie, Uricémie.
- Autres examens à envisager sur avis spécialisé :
- Échographie doppler des artères rénales et surrénales,
- Métanéphrines urinaire et plasmatique si suspicion de phéochromocytome,
- Échographie doppler des artères utérines (après 20 SA) pour détecter les patientes à haut risque de pré éclampsie ou de retard de croissance intra utérin.
c) Indication de traitement :
- Les IEC, ARA2 et les inhibiteurs de la rénine sont contre indiqués chez la femme enceinte
- Les béta bloquants peuvent induire des bradycardies chez le fœtus et sont donc à manier avec précaution
- Les diurétiques sont à éviter car le volume plasmatique est généralement diminué lors d’une pré éclampsie


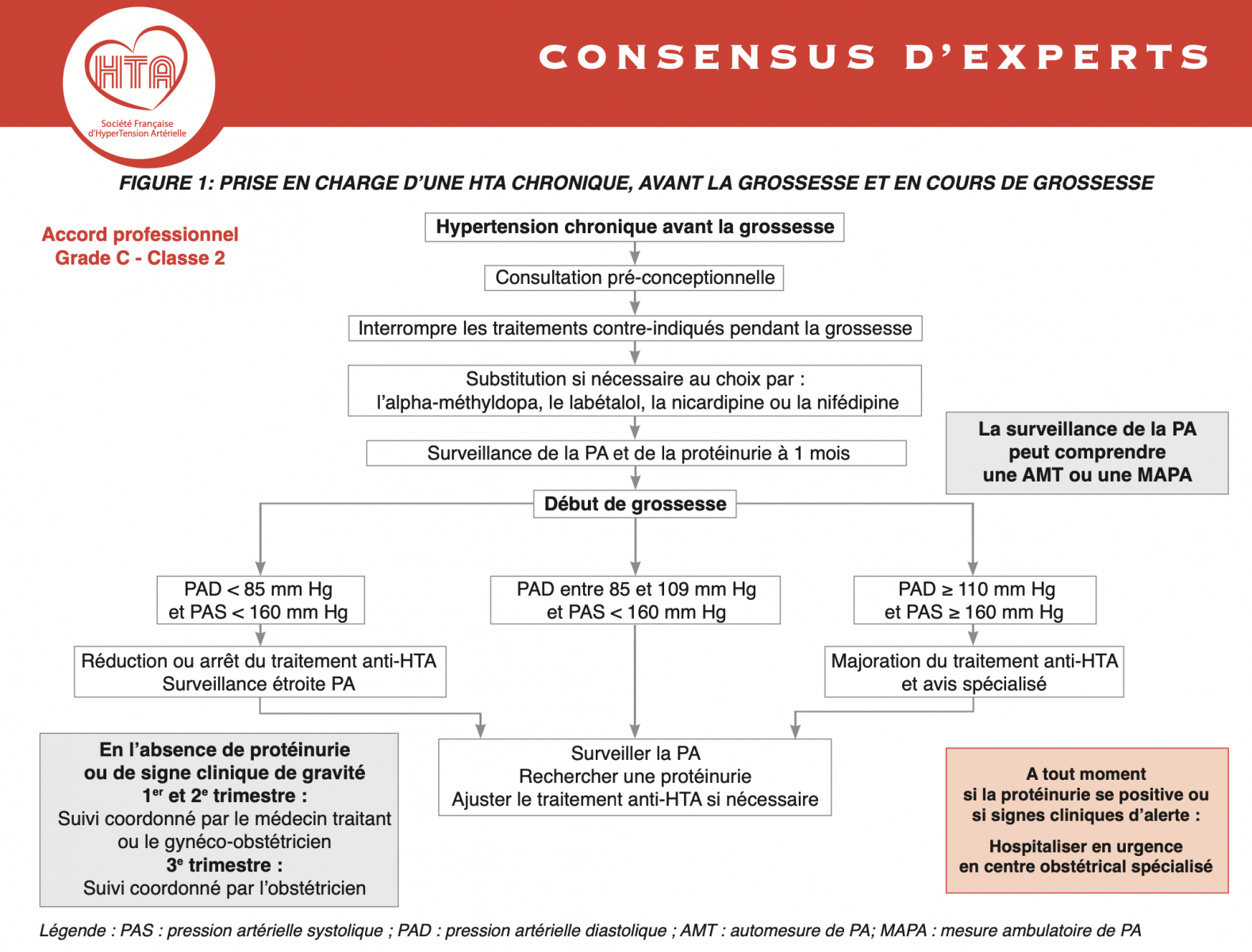
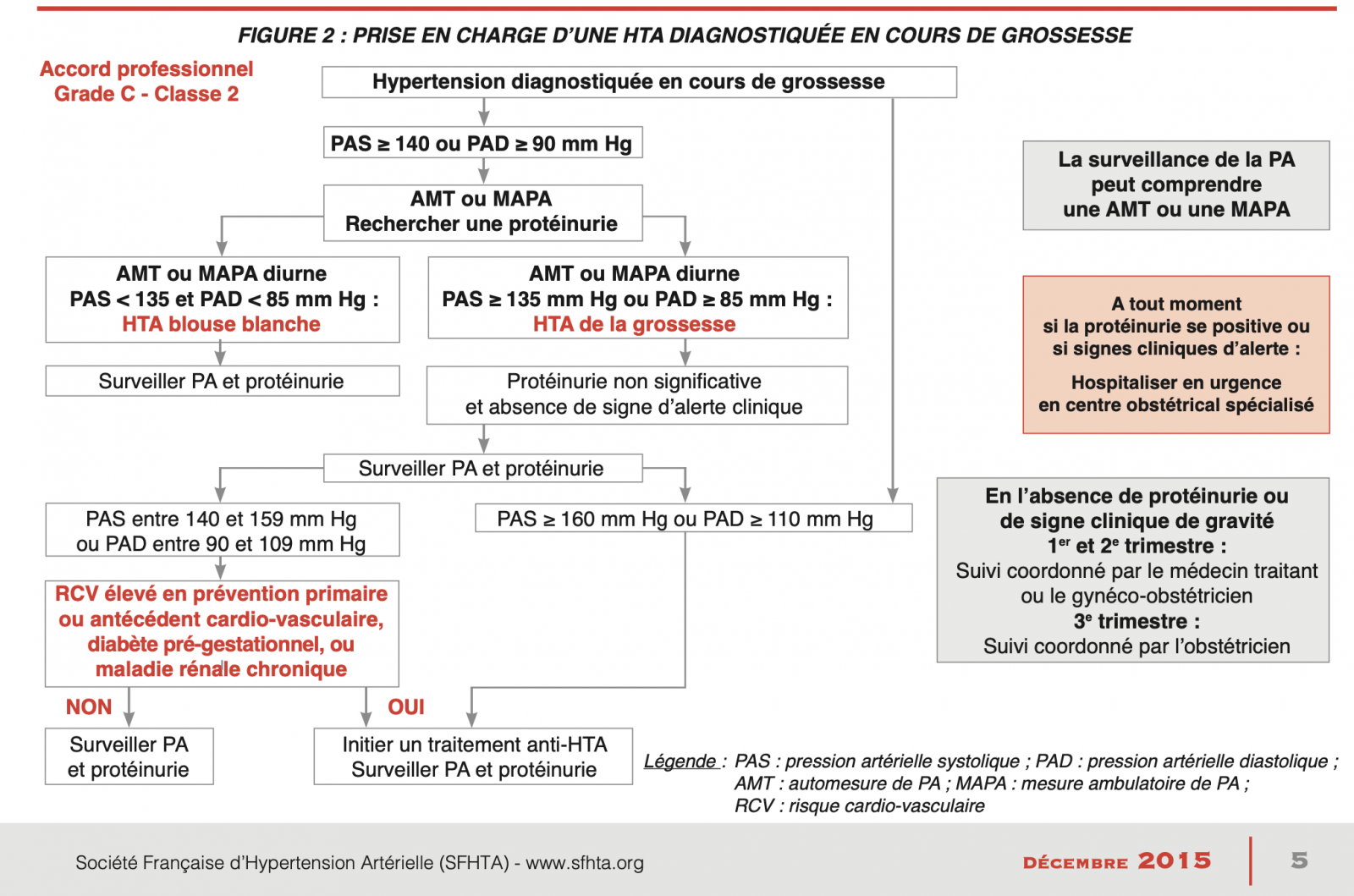

L) HTA et post partum
- Fréquent pendant la première semaine du post-partum.
- Traitement habituel de l’HTA mais :
- Éviter méthyl dopa (car risque de dépression),
- Risque de passage du médicament si allaitement (éviter propranolol et nifédipine).
- Risque de récidive au cours des prochaines grossesses et risque cardio vasculaire augmenté : maintien des mesures hygiéno-diététiques au long cours.
- Suivi médical : consultation annuelle
M) HTA du sujet noir
- Cette partie fait l’objet de recommandations spécifiques.1
- Bien que ne formant pas une population homogène les sujets noirs originaires des caraïbes et sub-sahariennes présentent des facteurs de risques plus élevés liés à l’hypertension.
- Ces sujets présentent une surmortalité d’origine cardio-vasculaire en rapport avec les mort-subite et les accidents vasculaires cérébraux en particulier en cas de drépanocytose associée. Ils sont également plus sujets à l’hypertrophie ventriculaire gauche et aux néphropathies.
- Il n’y a pas de recommandation formelle concernant les objectifs tensionnels spécifiques à cette population
- Les mesures hygiéno-diététiques restent le traitement indispensable.
- Les traitements IEC et ARA sont moins efficaces en monothérapie que dans la population générale mais deviennent beaucoup plus efficaces (que dans la population générale) en cas d’association avec un diurétique thiazidique ou un inhibiteur calcique.
- Les effets secondaires neuro-angiogénique des IEC et la toux sont plus fréquent.
- Les femmes sont également plus sujettes à l’HTA gravidique.
- Une surveillance particulière devrait être apportée à cette population d’un point de vue diagnostic, bilan d’atteinte d’organe et prévention.
N) HTA et traitement hormonal chez la femme
- La prise en charge de l’HTA chez la femme fait l’objet d’une recommandation propre de la société française d’hypertension artérielle (décembre 2018).1
- La prévalence de l’HTA est moins fréquente avant la ménopause mais elle augmente considérablement après la ménopause.
- Les dernières études sur le sujet suggèrent plutôt une augmentation du risque cardiovasculaire sous traitement hormonal substitutif.
- Une recherche d’une HTA devient donc recommandée avant tout introduction de traitement hormonal et rechercher les antécédents migraineux plus fréquemment associés aux complications à type d’AVC. Il est rappelé que le traitement contraceptif est une des principales étiologies d’HTA secondaire et d’éviter le traitement oestro-progestatif chez la patiente hypertendue.
- Des recommandations visant à limiter la prescription du traitement hormonal substitutifs sont également proposées (patiente asymptomatique, risque cardiovasculaire élevé).
- Enfin différents schéma thérapeutiques sont proposés dans la recommandation en fonction des antécédents de la patiente.
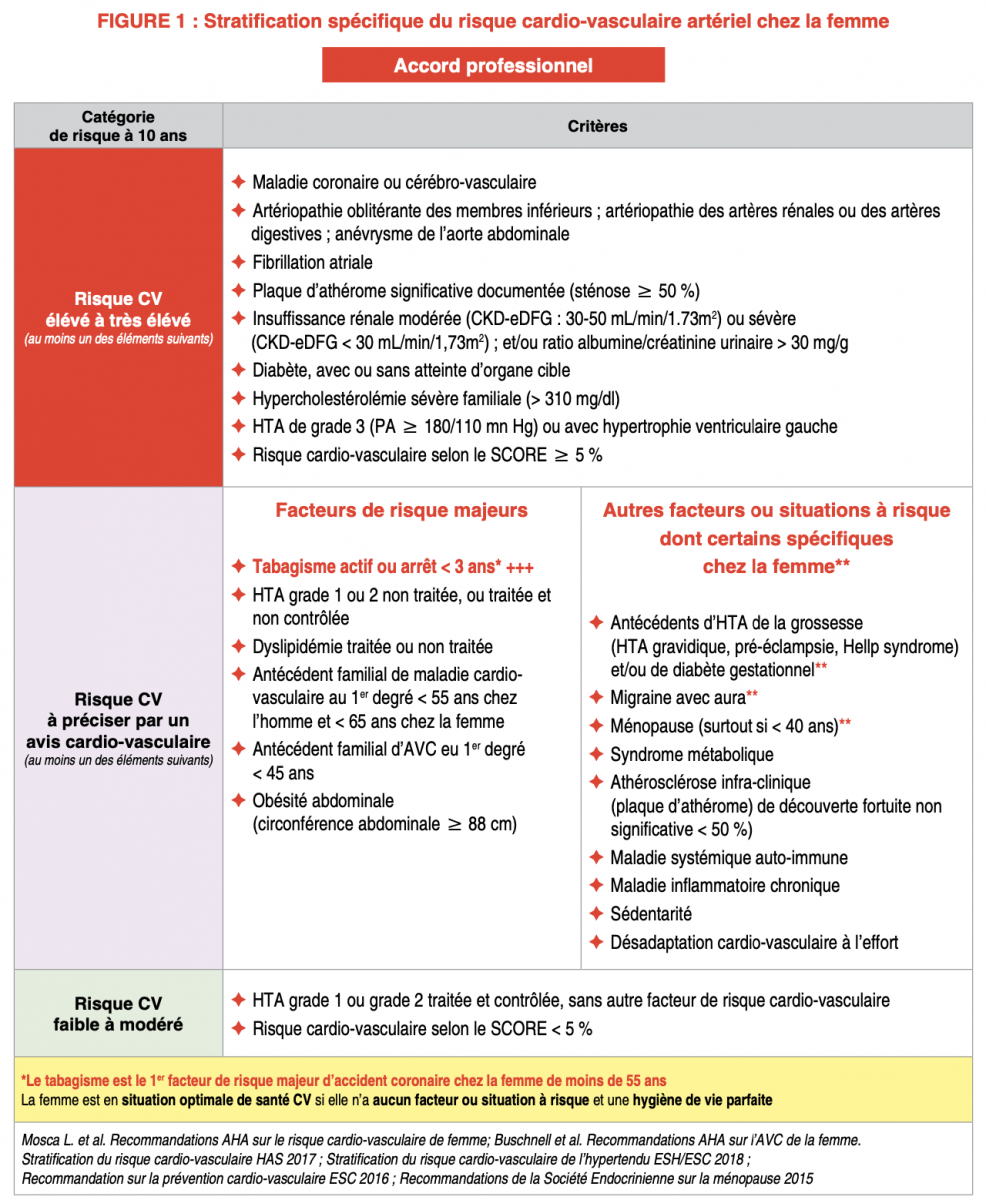

Résumé