Encéphalopathie hépatique

INTRODUCTION/GÉNÉRALITÉ
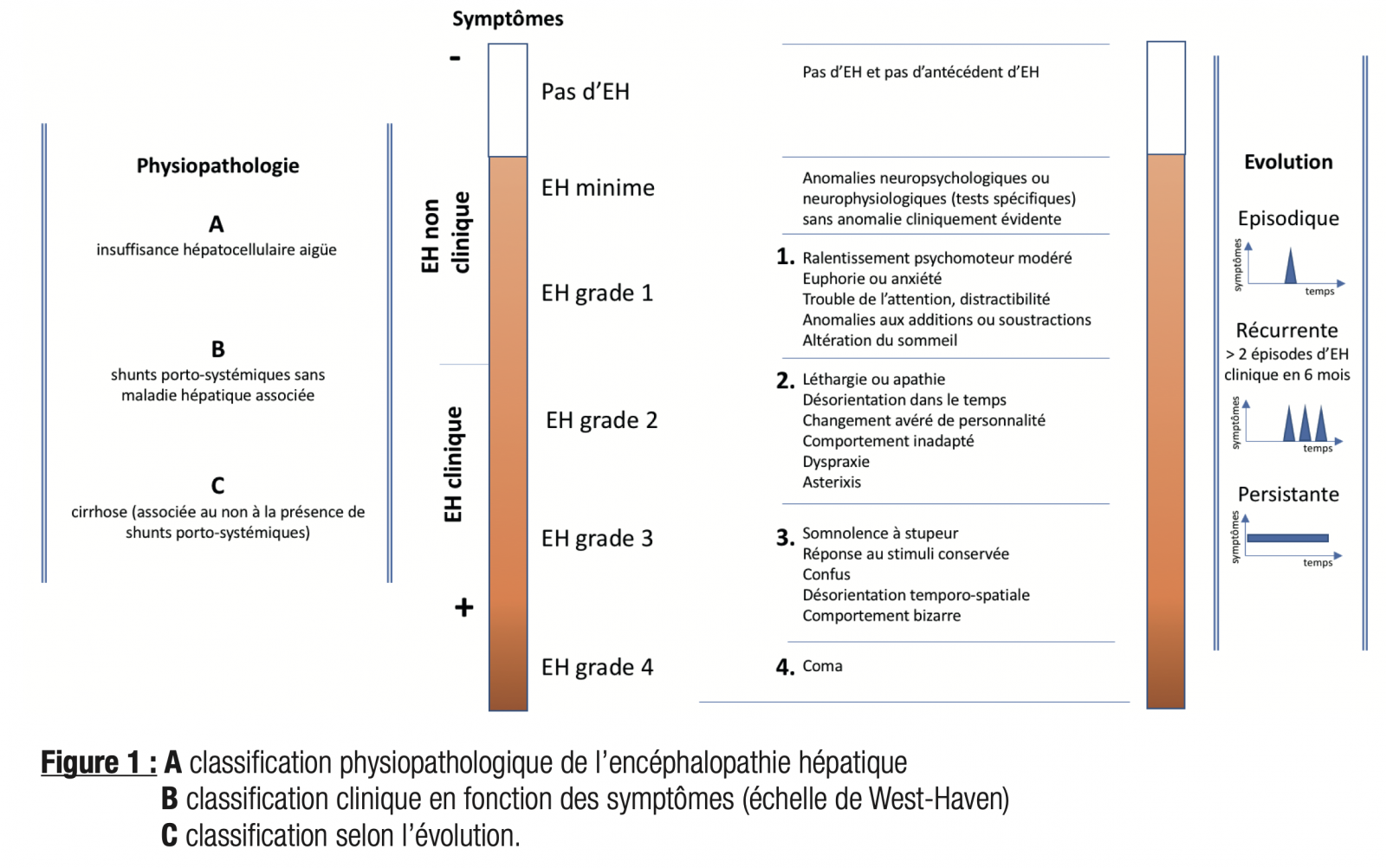
L’encéphalopathie hépatique (EH) correspond à l’ensemble des troubles neurologiques ou neuropsychiatriques associés à une atteinte du foie et/ou à un shunt porto-systémique.1 1 L’EH peut se présenter sous forme clinique (signes cliniques patents) ou minime (absence de signe clinique évident). Une classification physiopathologique commune est dorénavant adoptée depuis le congrès mondial de gastroentérologie à Vienne en 1998.1 Trois type d’EH ont ainsi été définis 1 :
- Le type A, EH secondaire à une insuffisance hépatocellulaire aiguë
- Le type B, EH secondaire à la présence de shunts porto-systémiques sans maladie hépatique associée
- Le type C, EH secondaire à une cirrhose (associée au non à la présence de shunts porto-systémiques)
Ces recommandations ne se focaliseront que sur le type C, l’EH qui complique la cirrhose. L’amélioration de la prise en charge de la cirrhose et de ses complications classiques et l’élargissement des indications des techniques d’anastomoses porto-caves par voie trans-hépatique (Transjugular Intrahepatic Portosystemic Shunt, TIPS) semblent participer à une augmentation de l’incidence d’épisodes d’EH.1
CLASSIFICATION
- Il existe plusieurs classifications de l’EH : celle de West-Haven est la plus communément retenue.
- Elle est généralement utilisée de façon binaire : pas d’EH clinique (grades 0-1), et EH clinique (grades 2 à 4).
-
L’EH minime est considérée comme étant un stade précoce de l’EH, correspondant aux stades 0 et 1 de la classification de West Haven.1
- Chez les patients ne présentant pas d’EH clinique, certains ne présentent pas d’EH du tout (grade 0), d’autres une EH minime détectable uniquement aux tests psychométriques (EH minime), et d’autres de légers signes détectables par un examen poussé (par exemple : troubles de calcul, ... grade 1). Il existe un chevauchement important entre la catégorie EH minime et le grade 1, en raison de l’absence de méthode diagnostique de référence et de la fluctuation de l’EH.
- Enfin, l’EH peut être épisodique, récidivante ou persistante.
PHYSIOPATHOLOGIE
Les mécanismes conduisant à l’encéphalopathie hépa- tique sont complexes et incomplètement connus. Ils font intervenir une augmentation de la perméabilité de la barrière hématoencéphalique, l’action de substances neu- rotoxiques, en particulier l’ammoniaque, ainsi que des perturbations de la neurotransmission. Les travaux les plus récents mettent en exergue le rôle de l’infection bacté- rienne et de l’inflammation dans la physiopathologie de l’encéphalopathie hépatique.1 1
A) Augmentation de la perméabilité de la barrière hématoencéphalique
- À l’état physiologique, la barrière hématoencéphalique protège le cerveau des modifications métaboliques de l’organisme.
- Au cours de l’insuffisance hépatique, il a été démontré qu’il existait une augmentation de la perméabilité de la barrière hématoencéphalique permettant une entrée d’eau et d’électrolytes, mais également de substances neurotoxiques présentes dans la circulation systémique. Des modifications marquées des systèmes de transport de la barrière hématoencéphalique ont été également démontrées grâce à des techniques d’imagerie cérébrale fonctionnelle. Il existe en particulier une augmentation du transport des acides aminés neutres et une diminution de celui du glucose, des corps cétoniques et des acides aminés basiques.
B) Accumulation de substances neurotoxiques
1) Ammoniaque
- On constate au cours de l’encéphalopathie hépatique, une augmentation majeure des taux sériques d’ammoniaque.
- La neurotoxicité de l’ammoniaque est connue depuis de nombreuses années sur des modèles expérimentaux chez l’animal mais également chez l’homme.
- Chez l’homme, la principale source d’ammoniaque est digestive. Les bactéries de la flore digestive sont équipées de glutaminases qui dégradent la glutamine, un acide aminé apporté par les protéines alimentaires, en ammoniaque.
- Chez l’individu sain, l’ammoniaque est, au cours de son premier passage hépatique, directement dégradé en urée, elle-même excrétée par le rein et les selles et à moindre degré en glutamine. L’ammoniaque est également métabolisée par le muscle strié.1
- En cas d’insuffisance hépatique et/ou de shunts portosystémiques, il existe un défaut de la clairance hépatique de l’ammoniaque qui se retrouve alors en excès dans la circulation systémique. La diminution de la masse musculaire, liée à la dénutrition, fréquente chez le patient cirrhotique, contribue également à diminuer le métabolisme de l’ammoniaque. À cause de l’augmentation de perméabilité de la barrière hématoencéphalique, le cerveau se trouve exposé à des concentrations excessives d’ammoniaque à l’origine d’anomalies cérébrales fonctionnelles et structurales, pouvant en partie expliquer les signes neurologiques de l’encéphalopathie hépatique.
- Les études d’imagerie fonctionnelle au cours de l’insuffisance hépatique ont montré que l’ammoniaque induisait directement des altérations du métabolisme énergétique cérébral avec des perturbations du métabolisme du glucose, principal substrat énergétique du cerveau, ainsi qu’une dysrégulation du flux sanguin cérébral induisant une hypoperfusion céré- brale de certains territoires. Les études autopsiques ont démontré que l’ammoniaque avait une toxicité directe sur les astrocytes et induisait des modifications structurales de ces cellules identiques à celles rencontrées dans la maladie d’Alzheimer.1 Les liens entre les anomalies cérébrales et les manifestations cliniques de l’encéphalopathie ne sont pas connus avec précision.
2) Substances agonistes des benzodiazépines ou benzodiazepine-like
- Chez l’individu sain, on constate de faibles taux sériques de benzodiazépines endogènes. Chez les patients cirrhotiques, ces substances s’accumulent à cause d’un défaut de leur élimination hépatique. Les benzodiazépines endogènes proviennent pour une grande partie du métabolisme des acides aminés alimentaires par les bactéries de la flore intestinale. On suppose que ces substances altèrent l’un des systèmes de neurotransmission, la voie GABAergique (voie inhibitrice). Il a également été suggéré qu’elles induisaient des altérations de la fonction des astrocytes.
3) Autres substances neurotoxiques
- Les mercaptans, provenant de la dégradation des acides aminés soufrés par les bactéries de la flore digestive, les composés phénoliques synthétisées par les bactéries à partir d’acides aminés aromatiques de même que les acides gras à chaîne courte et moyenne synthétisés également par les bactéries digestives sont des substances neurotoxiques. Elles agissent de façon synergique avec l’ammoniaque au niveau cérébral. Les examens d’imagerie et les études autopsiques ont permis de déceler un excès de manganèse dans certaines structures cérébrales des patients cirrhotiques. Les mécanismes expliquant la neurotoxicité du manganèse ne sont pas connus.
C) Bactéries, infection et inflammation
- Les bactéries commensales de la flore digestive, à l’origine de la formation de nombreuses substances neurotoxiques (ammoniaque, agonistes des benzodiazépines, mercaptans, phénols, acides gras) jouent un rôle important dans la physiopathologie de l’encéphalopathie hépatique. Les travaux expérimentaux récents suggèrent que les bactéries pathogènes sont également fortement impliquées. L’infection bactérienne est un facteur déclenchant ou aggravant très fréquent de l’encéphalopathie hépatique.1
- Chez le cirrhotique, l’encéphalopathie s’accompagne souvent d’un syndrome de réponse inflammatoire systémique (SIRS) résultant de l’activation de cytokines pro-inflammatoires (IL-1, IL-6, TNFα, interférons) en réponse à une agression hépatocytaire compliquée ou non d’une infection bactérienne. Des travaux expérimentaux ont montré que l’induction d’une hyperammoniémie (après ingestion d’une solution d’acides aminés) chez des patients cirrhotiques ayant une infection bactérienne documentée associée à un SIRS s’accompagnait d’une altération des fonctions cérébrales. Ces anomalies tendent à s’améliorer lorsque l’infection est contrôlée et que le SIRS disparaît, malgré la poursuite de l’induction d’une hyperammoniéme.1
- Ces données suggèrent que la réponse inflammatoire peut moduler la réponse neuropsychiatrique à l’hyperammoniémie. Les cytokines pro-inflammatoires seraient impliquées dans des modifications de la diffusion de l’ammoniaque, d’une alté- ration des systèmes de neurotransmission, en particulier l’expression de récepteurs aux benzodiazépines, et de modi- fications de la circulation sanguine cérébrale.
ÉPIDÉMIOLOGIE
- La prévalence de l’EH clinique pourrait concerner entre 30 et 45% des patients cirrhotiques avec une incidence de 20% par an et même de 50% après la pose d’un TIPS.1 1
- La prévalence de l’EH minime est plus difficilement estimable en raison de l’absence de méthode de référence pour le diagnostic mais serait fréquente chez les patients cirrhotiques avec une prévalence estimée de 22 à 80% selon les études.1 1 1 1
- La présence d’une EH minime est associée à une augmentation de l’incidence des épisodes d’EH clinique (> 50% à 3 ans) et enfin à une diminution de la survie 1 1 1
FACTEURS DE RISQUES
Votre texte ici
EXAMEN CLINIQUE
- Les experts suggèrent qu’une encéphalopathie hépatique soit dépistée chez tous les patients atteints de cirrhose quelle que soit leur fonction hépatique (Avis d’Expert, Accord Fort).
- Il est recommandé de rechercher systématiquement des signes fortement évocateurs d’une EH : astérixis, ralentissement psychomoteur, inversion du rythme nycthéméral, désorientation temporo-spatiale, troubles de la conscience (Grade 1+, Accord Fort).
-
Une encéphalopathie hépatique minime doit être recherchée chez tous les patients atteints de cirrhose. Parmi les tests disponibles, les experts suggèrent l’utilisation du test d’énumération des animaux.1
A) EH clinique
- L’EH clinique se présente classiquement comme un tableau confusionnel (delirium) aigu ou chronique avec une désorientation dans le temps et l’espace et une désorganisation du cours de la pensée avec une activité psychomotrice diminuée. Plus rarement, il existe une hyperactivité psychomotrice.1 1 L’altération de la conscience peut être sévère, responsable d’une stupeur ou d’un coma.
- Ce tableau confusionnel est associé à un astérixis, ou flapping tremor, correspondant à une chute brutale et de brève durée du tonus musculaire des extenseurs de la main,1 qui peut aussi être observée dans d’autres causes d’encéphalopathie métabolique (hypercapnie, urémie, encéphalopathie médicamenteuse). L’astérixis est recherché en demandant au patient de tendre les bras, les poignets et les doigts.1 L’apparition de mouvements de flexion plusieurs fois par minute signe l’astérixis. Toute épreuve de maintien d’une posture, dont la langue tendue, peut également permettre de le rechercher.1 1 Des myoclonies spontanées diffuses sont possibles dans les formes sévères.
- Comme dans toutes les encéphalopathies métaboliques, des signes de focalisation sont possibles. Bien que ceux-ci doivent faire rechercher un diagnostic différentiel, ils peuvent être présents en cas d’EH. Dans la plus grande série d’évaluation neurologique systématique de 34 patients avec 48 épisodes d’EH, 8 (21%) présentaient des signes de focalisation (6 une hémi-parésie ou -plégie, 2 une agnosie et une monoplégie).1
- Les patients avec une forme modérée d’EH clinique peuvent présenter une rigidité oppositionnelle de type frontale, gegenhalten, des réflexes ostéo-tendineux augmentés, un signe de Babinski ou un grasping. Un tableau particulier, décrit comme dégénérescence hépato-cérébrale, avec l’apparition d’un syndrome parkinsonien akinéto-rigide est parfois possible.1
- Au niveau oculaire, il est classique d’observer un myosis, et des troubles oculomoteurs sont parfois présents.1 1 Ceux-là peuvent se manifester par un nystagmus dans le regard latéral ou variable dans sa direction, des mouvements toniques conjugués des deux yeux vers le bas, des mouvements non coordonnés des deux yeux ou un bobbing oculaire. L’absence complète de réponse oculomotrice aux tests oculo-vestibulaires/oculo-caloriques, classiquement associée à un pronostic défavorable dans les autres agressions cérébrales, peut se rencontrer dans les formes sévères d’EH sans être associée à un mauvais pronostic.1 1
- Des crises convulsives sont possibles au cours de l’EH mais sont rares et doivent amener à discuter un diagnostic différentiel. Il est possible de poser un diagnostic de crises convulsives de façon erronée devant des myoclonies, ce qui entraîne une prescription non justifiée de sédatifs.1
B) EH minime
- L’EH minime se caractérise classiquement par un examen neurologique normal et l’existence d’anomalies détectées uniquement aux tests neuropsychologiques et neurophysiologiques.1
- Il est à noter cependant que des éléments en faveur de troubles neuropsychologiques peuvent être recherchés à l’examen neurologique (apraxie, syndrome dysexécutif, jovialité, désinhibition, apathie, ralentissement psychomoteur, ...). Ceux-ci ne sont généralement pas recherchés, probablement car il n’existe pas de standardisation de l’examen clinique chez un patient cirrhotique.
- L’interrogatoire du patient et surtout de sa famille/entourage doit permettre de caractériser les troubles éventuels : ralentissement psychomoteur, troubles de sommeil, inversion du rythme nycthéméral, troubles du calcul. Une attention particulière devrait être portée sur les activités de la vie quotidienne et l’impossibilité récente à effectuer des tâches auparavant routinières (faire ses comptes, faire sa déclaration d’impôts, lire des livres ou le journal, regarder la télévision, ...), car cela représente un indice de l’existence d’un trouble neuropsychologique.
- Le test neuropsychologique constitue l’examen de référence pour le diagnostic d’EH minime en permettant une caractérisation précise du trouble neuropsychologique. Un syndrome dysexécutif évoque fortement une EH minime. Un profil différent doit faire évoquer un diagnostic différentiel ou un diagnostic associé (démence vasculaire ou alcoolique notamment dans le contexte du patient cirrhotique). Il est à noter cependant que l’accessibilité des patients cirrhotiques aux tests neuropsychologiques est extrêmement difficile en France. Aussi, en l’absence d’un accès facile, le choix des examens neuropsychologiques ou neurophysiologiques devrait s’appuyer sur les possibilités locales.
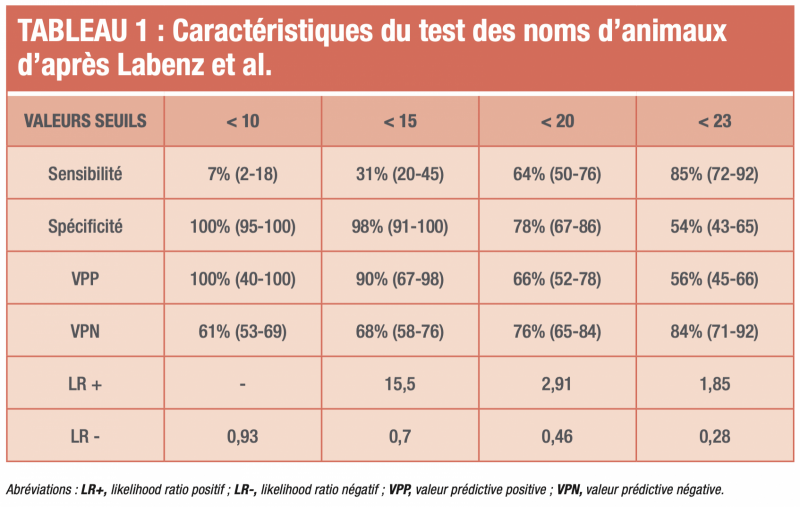
- Un ensemble de tests neuropsychologiques ou neurophysiologiques adaptés au profil particulier de l’EH minime a été proposé mais le test d’énumération des animaux est suggéré par les experts :1 test simple, réalisable au lit du malade, consistant à demander au patient de nommer le plus grand nombre d’animaux en une minute.1 Un résultat inférieur à 15 animaux par minute pourrait permettre de distinguer les patients présentant une EH minime de ceux qui n’en présentent pas, selon l’étude initiale italienne. Ce test prometteur vient d’être validé par une autre équipe indépendante qui a également évalué les caractéristiques du test en comparant différentes valeurs seuils.1 Dans la mesure où ce test est facilement réalisable en consultation ou au lit du malade sans matériel important et qu’il ne prend pas beaucoup de temps, il pourrait constituer un test de dépistage rapide. La valeur seuil de 20 noms d’animaux en 1 minute semble raisonnable. Les consignes de réalisation du test des animaux sont détaillées dans le tableau 2.

EXAMENS COMPLÉMENTAIRES
- Il n’est probablement pas recommandé de doser l’ammoniémie pour confirmer le diagnostic d’encéphalopathie hépatique.
- En cas de doute diagnostique devant des troubles de la conscience, il est probablement recommandé de doser l’ammoniémie car une valeur normale remet en cause le diagnostic d’encéphalopathie hépatique (Grade 2-, Accord Fort)
A) Dosage de l'ammoniémie
- Au cours de la cirrhose, plusieurs études observent une corrélation entre la sévérité d’un épisode d’EH et l’ammoniémie.1 1 1 1
- Il semble que l’ammoniémie artérielle, veineuse, ou les pressions partielles en ammoniaque aient sensiblement la même performance diagnostique.
- Néanmoins, il est impossible d’établir des seuils discriminants clairs et certaines études n’observent pas cette corrélation de manière satisfaisante.1 1
- La valeur prédictive positive d’une ammoniémie élevée est mauvaise chez un patient avec cirrhose et ce dosage ne peut pas être recommandé pour affirmer une EH.
- La valeur prédictive négative est en revanche meilleure. L’EASL et l’AASLD précisaient en 2014 dans leurs recommandations que le dosage de l’ammoniémie ne pouvait être utilisé que pour sa valeur prédictive négative, pour remettre en cause le diagnostic d’EH chez un patient avec troubles de la conscience et ammoniémie normale.1 1 Cela peut faire proposer de doser l’ammoniémie en cas de symptômes d’EH, pour évoquer des diagnostics différentiels qui sont nombreux chez les patients cirrhotiques avec troubles de la conscience, en particulier si la cirrhose survient en contexte de consommation excessive d’alcool présente ou passée.1
-
Il n’est pas possible de formuler de recommandation sur l’intérêt du dosage de l’ammoniémie dans l’EH minime en l’absence de données cliniques disponibles. L’étude de Quero 1 ne corrèle pas directement l’ammoniémie aux données des tests psychométriques, considérés comme l’examen de référence dans cette étude. Le rôle de l’ammoniémie sera probablement revisité en tant que marqueur pronostique et thérapeutique dans les années à venir, et ce aussi chez des patients sans EH.
-
Diagnostics différentiels avec les maladies héréditaires du métabolisme à évoquer devant une hyperammoniémie sévère : L’EH peut révéler des maladies héréditaires du métabolisme hépatique, dont la maladie de Wilson et les déficits du cycle de l’urée (en particulier un déficit en ornithine transcarbamylase ou en argino-succinate synthase) . Une étude pédiatrique révèle que des maladies métaboliques peuvent expliquer jusque 10% des encéphalopathies hépatiques chez l’enfant.1 D’autre part, l’EH est rare dans la maladie de Wilson mais fréquente chez les patients présentant des déficits du cycle de l’urée.1 1 Bien que rares, la reconnaissance de ces pathologies est essentielle car, en l’absence de mise en route urgente de traitements spécifiques, leur issue est souvent fatale.
Face à un tableau d’EH, que ce soit dans un contexte aigu ou chronique, certaines atypies doivent faire évoquer la possibilité d’une maladie héréditaire du métabolisme :1
- des antécédents familiaux de maladie hépatique et/ou neurologique,
- des antécédents personnels de symptômes neurologiques (aigus ou chroniques) et/ou d’EH
- l’absence d’ictère
- la dissociation entre les valeurs d’ammoniémie (élevées) et des transaminases (peu élevées)
- la sévérité de l’atteinte neurologique.
La suspicion d’un déficit du cycle de l’urée doit conduire à des examens métaboliques en urgence (chromatographie des acides aminés sanguins et des acides organiques urinaires dont l’acide orotique) et un traitement d’urgence sans attendre les résultats des examens métaboliques :
- arrêt transitoire (48-72h) des apports protidiques
- apports hypercaloriques (> 2000 calories) glucido-lipidiques,
- épurateurs d’ammonium (benzoate de sodium, phénylacétate / phénylbutyrate de sodium)
- voire épuration extra-rénale.
La mise en route de ces traitements permet, dans la majorité des cas, d’éviter de recourir à la transplantation hépatique en urgence. Une ammoniémie très élevée doit faire évoquer ces diagnostics métaboliques rares. Doser l’ammoniémie lors d’un premier épisode supposé d’EH pourrait donc faciliter le diagnostic différentiel, tout particulièrement quand un ou plusieurs des cinq paramètres décrits ci-dessus sont présents.
Conditions de dosage de l’ammoniémie :

B) Électroencéphalogramme (EEG)
Il est probablement recommandé de faire un électroencéphalogramme s’il existe un doute sur le diagnostic d’encéphalopathie hépatique clinique ou minime (Grade 2+, Accord Fort).
- L’EEG permet de diagnostiquer une EH minime ou clinique avec des performances correctes.
- Les anomalies EEG sont également corrélées à la sévérité de l’encéphalopathie et au risque de développer un événement clinique futur.
- L’EEG permet ainsi de quantifier l’intensité de l’encéphalopathie.
- L’EEG doit être effectué par des mains exercées et interprété par un médecin spécialiste.
- Un certain nombre de situations cliniques (notamment la prise de certains médicaments, l’hyponatrémie, l’insuffisance rénale, etc.) peuvent donner des anomalies électroencéphalographiques proches de l’EH et que ces dernières ne sont pas spécifiques.1 1
C) Imagerie cérébrale avec injection
Il est probablement recommandé d’effectuer une imagerie cérébrale chez un patient suspect d’encéphalopathie hépatique pour le diagnostic différentiel (Grade 2+ , Accord Fort).
- L’imagerie cérébrale est surtout nécessaire au cours du premier épisode de l’EH.
- Elle est indiquée systématiquement pour écarter une lésion intracrânienne si ce diagnostic est suspecté 1 notamment en raison du fait que la population de patients cirrhotiques ou consommateurs excessifs d’alcool sans cirrhose a un risque beaucoup plus élevé d’hémorragie intracérébrale que la population générale (risque relatif variant de 4,8 à 7,7).1
- Une imagerie en coupes injectée est nécessaire, que ce soit par une tomodensitométrie ou une IRM quand une lésion intracérébrale est suspectée ou probable.
- Sur la base des études récentes, il n’est pas possible d’établir de recommandation sur l’intérêt de l’IRM cérébrale couplée ou non à la spectroscopie dans le diagnostic de l’encéphalopathie étant donné que ses performances n’ont pas été comparées aux autres techniques et à la clinique.
- En revanche, des études plus anciennes semblent suggérer un intérêt de la spectroscopie couplée à l’IRM, avec cependant de très faibles effectifs.1 1
DIAGNOSTICS DIFFÉRENTIELS
- Les experts suggèrent que toute première évaluation d’un trouble neurologique chez un patient cirrhotique doit faire pratiquer un bilan clinique et paraclinique pour éliminer un diagnostic différentiel ou associé. Outre la biologie (ionogramme sanguin, glycémie, calcémie, NFS, hémostase, protéines de l’inflammation, urée et créatininémie), une imagerie cérébrale de préférencepar IRM est indispensable. En cas de rechute d’encéphalopathie hépatique clinique, outre la biologie, aucun examen n’est à recommander de manière systématique pour le diagnostic différentiel. Une imagerie en urgence par tomodensitométrie, un EEG et/ou une ponction lombaire doivent être pratiqués au moindre doute en cas de trouble de conscience chez un patient avec une cirrhose (Avis d’Expert, Accord Fort)
- Les experts suggèrent la mise en place de circuits courts permettant une expertise neurologique dans un délai adapté (Avis d’Expert, Accord Fort).
Dans le spectre clinique de l’EH, on distingue deux cadres devant faire évoquer chacun différents diagnostics différentiels :
- l’EH minime dans laquelle le trouble cognitif est d’évolution chronique et la plainte peut provenir de l’entourage chez un patient non conscient de son trouble.
- l’EH clinique dont le trouble de la vigilance peut aller jusqu’au coma.
Un bilan diagnostique clinique et paraclinique pour rechercher un diagnostic différentiel ou associé à l’EH est indispensable devant toute première évaluation d’un trouble neurologique chez un patient cirrhotique. De manière systématique, les éléments à préciser sont :
- L’anamnèse récente (infections, traumatismes, sevrages, prise de psychotropes), notamment récidive ou évolution fluctuante.
- L’étude des antécédents (diabète, pathologie neuro-vasculaire, épilepsie, complications connues de la cirrhose et de l’insuffisance hépatique).
- L’examen neurologique cognitif, moteur, sensitif, neurovisuel et des nerfs crâniens ; un astérixis est fortement évocateur d’encéphalopathie métabolique mais pas synonyme d’atteinte hépatique (Tableau 4).1
- La biologie classique (ionogramme sanguin, glycémie, calcémie, NFS, hémostase, protéines de l’inflammation, urée et créatininémie) et l’imagerie cérébrale (de préférence par IRM).
Ce questionnement quant à l’éventualité d’un diagnostic différentiel ne sera que plus important lors d’un premier épisode et devra être adapté aux circonstances. Il est à noter que les discussions diagnostiques sont différentes selon qu’il s’agit d’une suspicion d’EH de forme clinique ou minime.

A) Diagnostic différentiel de l’EH minime
- L’évocation d’un diagnostic différentiel (ou associé) doit être systématique devant tout élément clinique ou paraclinique pouvant être attribué à une pathologie alternative ou associée.
- Dans l’EH minime le trouble cognitif est isolé et comporte principalement un ralentissement de la vitesse de pensée, un trouble attentionnel, un trouble de la mémoire de type sous-cortico-frontale (défaut de récupération sans atteinte du stockage). Cette sémiologie de l’atteinte cognitive chez les patients cirrhotiques avec EH minime n’a pas de spécificité. Ces anomalies peuvent se rencontrer dans de nombreuses pathologies neurologiques et psychiatriques comme le syndrome dépressif, la schizophrénie, la iatrogénie médicamenteuse (benzodiazépines), le syndrome frontal d’origine dégénérative ou la pathologie neuro-vasculaire et globalement toutes les causes de ralentissement psychique.
- D’autres atteintes cognitives, comme un trouble important de l’orientation spatio-temporelle (le patient se perd régulièrement près de chez lui, ...), une atteinte de la mémoire épisodique antérograde, une atteinte des praxies visuo-constructives (difficultés à s’habiller, difficultés à reproduire un dessin), un trouble du langage (manque du mot évident, ...), même s’ils peuvent se voir dans l’EH minime doivent faire évoquer des diagnostics alternatifs, en particulier s’ils s’accompagnent d’une évolution progressive ou de l’absence de fluctuations (maladies neuro-dégénératives, syndrome de Korsakoff,...).
- Une expertise neurologique est alors requise pour envisager un bilan neuropsychologique complet (exploration exhaustive de toutes les fonctions cognitives réalisé par un neuropsychologue, d’une durée d’une à deux heures) et des examens adaptés qui seront prescrits par le neurologue.
- Une bonne réponse clinique au traitement spécifique de l’EH (lactulose, rifaximine) peut aussi aider à résoudre la question du diagnostic étiologique en faveur du diagnostic d’EH si un doute persiste.

B) Diagnostic différentiel de l’EH clinique :
- L’EH clinique est caractérisée par l’existence d’une confusion comportant un trouble de la vigilance, de l’attention et une désorientation temporo-spatiale, manifestations peu spécifiques. L’examen doit rechercher des symptômes et signes en faveur d’une cause alternative ou associée.
- La constatation de signes de localisation impose de rechercher une pathologie focale du système nerveux central.
- Certains signes peuvent évoquer un état de mal épileptique confusionnel, nécessitant la réalisation d’un EEG : clonies des paupières, myoclonies segmentaires différentes de l’astérixis, grandes fluctuations du contact. L’EEG peut être parfois d’interprétation délicate et conclure à tort à des manifestations épileptiques pouvant conduire à la prescription indue d’anti-épileptiques comme les benzodiazépines qui sont fréquemment associées à une aggravation de l’EH.
- Une fièvre sans arguments pour une étiologie infectieuse commune (liquide d’ascite, urinaire, ...) doit faire discuter la possibilité d’une méningite à pyogène ou d’une méningo-encéphalite et réaliser une ponction lombaire en urgence, qui doit aussi être proposée en l’absence d’arguments de certitude en faveur de l’EH.
- En cas de rechute d’EH clinique, outre la biologie, aucun examen n’est à recommander de manière systématique pour le diagnostic différentiel, mais une TDM cérébrale peut être discutée si aucun facteur de décompensation n’est identifié, notamment pour éliminer une hémorragie cérébrale post traumatique (le traumatisme pouvant passer inaperçu dans le contexte) voire spontanée en rapport avec les troubles de l’hémostase.

ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
A) Réduire ou éliminer les principaux facteurs favorisants de l’encéphalopathie hépatique minime au cours de la cirrhose.
- Il est probablement recommandé de surveiller la natrémie en cas de cirrhose décompensée car une hyponatrémie sévère est un facteur favorisant d’encéphalopathie hépatique. (Grade 2+, Accord Fort)
- Il est probablement recommandé de limiter la prescription des inhibiteurs de la pompe à protons à leurs strictes indications validées (doses et durées). (Grade 2+, Accord Fort)
- Il est probablement recommandé de contre-indiquer la prescription de benzodiazépines chez les cirrhotiques décompensés. (Garde 2+, Accord Fort)
Plusieurs facteurs précipitants ont été rapportés dans les principales séries publiées d’EH clinique et d’EH minime. Il est donc logique de penser que l’éviction de ces différents facteurs pourrait prévenir la survenue de l’EH. Il s’agit essentiellement de facteurs non spécifiques liés aux autres complications de la cirrhose (hémorragie digestive, infection, déshydratation/traitements diurétiques, pertes digestives, troubles métaboliques- hyponatrémie, alcalose hypokaliémique, insuffisance rénale). Les mécanismes impliqués sont différents selon les facteurs et comprennent l’augmentation de l’ammoniémie, la présence d’un syndrome inflammatoire, ou encore une agression neurologique propre. Ces facteurs pourraient favoriser l’EH. Il a été montré que le contrôle d’un ou de plusieurs facteur(s) favorisant(s), présents dans environ 50 % des cas, permettait dans environ 90 % des cas d’améliorer les symptômes.1 Ces facteurs peuvent précéder ou être contemporains d’un épisode d’EH clinique mais leur causalité n’est pas formellement établie.
1) Troubles ioniques
- Les perturbations métaboliques sont fréquentes chez les patients cirrhotiques, d’autant plus que la maladie hépatique est sévère.
- Il est difficile de savoir si ces troubles métaboliques ont par eux-mêmes une responsabilité dans la survenue de l’EH, ou s’ils ne sont qu’associés et témoins de la sévérité de l’hépatopathie.1
- Certains troubles ioniques comme l’alcalose métabolique ou l’hypokaliémie ont été associés de manière inconstante à l’EH.
- La perturbation la plus fréquemment mise en cause est l’hyponatrémie.1 Elle est responsable d’un œdème cérébral avec hypo-osmolarité extra-cellulaire, compensée par une diminution intra-cellulaire dans les astrocytes d’organites hyperosmolaires tels que le myo-inositol. L’effet de ces perturbations cellulaires intra-cérébrales a vraisemblablement un effet synergique avec les effets de l’hyperammoniémie impliquée dans la physiopathologie de l’EH.1
- La prévention de l’hyponatrémie est essentielle chez les patients cirrhotiques. En l’absence de traitement médical réellement efficace, elle repose principalement sur la surveillance stricte du ionogramme plasmatique et sur l’adaptation précoce des doses de diurétiques pour maintenir une natrémie si possible > 135 mmol/L et dans tous les cas > 130 mmol/L.
2) Insuffisance rénale
- Les patients cirrhotiques avec EH sont très sensibles aux modifications de la volémie.
- En général, les fonctions neurologiques sont meilleures chez des patients hyperhydratés que déshydratés.
- Une déshydratation peut avoir de multiples causes (surdosage en diurétiques, troubles digestifs, intolérance au lactulose) et doit être prévenue.1
- La responsabilité de l’insuffisance rénale dans le développement de l’EH a été rapportée dans plusieurs études.1
- En analyse multivariée, la créatinine était un facteur indépendant d’EH et il existait une corrélation significative entre les valeurs de créatininémie et celles de l’ammoniémie. Il faut toutefois noter qu’il existe fréquemment une association entre hyponatrémie et insuffisance rénale.1
- Le suivi attentif de la fonction rénale chez les patients cirrhotiques et la prise en charge précoce de l’insuffisance rénale débutante (AKI I) sont probablement des éléments utiles à la prévention de l’EH.
3) Syndrome inflammatoire et sepsis
- Les patients cirrhotiques ont une susceptibilité accrue aux infections bactériennes et fungiques.1
- Le rôle délétère du sepsis comme facteur précipitant de l’EH clinique est une notion classique et ancienne.1 1
- Il a été suggéré que les facteurs inflammatoires et le sepsis jouaient un rôle important sur les effets cérébraux de l’ammoniémie.1 Le sepsis peut donc être considéré comme un facteur d’agression cérébrale.
- Le rôle de ces facteurs dans la physiopathologie de l’EH minime a été moins bien étudié mais le lien entre syndrome inflammatoire et anomalies cognitives au cours de l’EH minime a été suggéré indépendamment des taux d’ammoniémie.1
-
Plus récemment, il a été suggéré que le niveau de pullulation bactérienne digestive était augmenté chez les patients ayant une EH minime.1
-
Il est logique de penser que la prévention et le traitement approprié du sepsis sont des éléments importants pour prévenir l’EH.1
4) Diabète
- L’incidence du diabète est élevée chez les patients avec cirrhose (30 à 40 %).
- Le diabète déséquilibré et la malnutrition sont des facteurs de risque de décompensation de la cirrhose avec EH.1
- Plusieurs études de cohorte ont montré que le diabète était un facteur indépendant lié au développement d’une EH.1 1
- Sur le plan physiopathologique, plusieurs hypothèses ont été avancées. Le syndrome d’insulino-résistance et le diabète de type 2 sont considérés responsables d’un état inflammatoire chronique. De plus, la dysfonction du système nerveux autonome pourrait expliquer un ralentissement du transit digestif et favoriser une pullulation bactérienne et la translocation bactérienne.1
- L’effet de la metformine pourrait impliquer son action sur l’activité de la glutamine synthétase (diminution de l’ammoniémie) et un effet anti-inflammatoire. La contre-indication de ce traitement en cas de cirrhose décompensée en limite toutefois son intérêt. Néanmoins, l’optimisation du traitement du diabète est probablement un élément important pour prévenir l’EH.
5) Hémorragie digestive
- L’hémorragie digestive est responsable fréquemment d’encéphalopathie clinique.
- L’urgence de la situation et l’état souvent précaire du patient ne se prêtent pas aisément à la recherche d’une EH minime. Les données de la littérature intéressent essentiellement l’EH clinique.
- Le développement de l’EH dans cette situation est multifactoriel (aggravation de l’insuffisance hépatocellulaire, majoration de l’ammoniémie par digestion des protéines sanguines, syndrome inflammatoire et infections).
- La relation entre hémorragie digestive, augmentation de l’ammoniémie et encéphalopathie clinique est bien connue.1 1
- Au cours d’une hémorragie digestive, un traitement antibiotique systématique, recommandé en prévention des risques infectieux, a montré une amélioration globale de la survie, surtout chez les patients cirrhotiques sévères (score de Child Pugh C). Cette recommandation pourrait être discutée chez les cirrhotiques compensés (score de Child-Pugh A).1
6) Constipation
- La constipation est une plainte assez fréquente chez les patients cirrhotiques.
- La physiopathologie est probablement multifactorielle (dysautonomie digestive, diabète, ascite).1
- Elle est classiquement décrite comme un facteur favorisant de l’EH en rapport avec le ralentissement du transit digestif responsable d’une augmentation de la pullulation bactérienne.1
7) Médicaments
a) Inhibiteurs de la pompe à protons
- Les inhibiteurs de la pompe à protons (IPP) augmenteraient l’incidence de l’EH en augmentant le pH gastrique qui favoriserait la pullulation microbienne/dysbiose au niveau de l’intestin grêle, responsable de la formation de produits comme l’ammoniaque et d’endotoxines bactériennes.
- Par ailleurs, l’augmentation de la perméabilité de la membrane intestinale et de la translocation bactérienne pourraient être responsables d’une inflammation systémique, pilier supposé de la physiopathologie de l’EH.
- D’autres mécanismes d’action des IPP dans la physiopathologie de l’EH ont été proposés :
- Altération de l’absorption de micronutriments comme le magnésium et la vitamine B12
- Augmentation de l’hyponatrémie, effet indésirable direct des IPP.
-
il semble donc prudent de réévaluer systématiquement la balance bénéfice/risque et le caractère approprié de prescription des IPP chez les patients cirrhotiques,
b) ß-bloquants
- Il a été suggéré que le propranolol pouvait favoriser une EH.1
c) Sédatifs et psychotropes
- La plupart des benzodiazépines (BZD) sont utilisées comme anxiolytiques à visée sédative et une hypersensibilité de l’agoniste au récepteur des BZD a été rapportée au cours de la cirrhose pouvant favoriser l’EH.1
- Dans le cadre du syndrome de sevrage, la prescription de benzodiazépines est parfois la seule possibilité thérapeutique et doit être strictement encadrée avec une évaluation clinique régulière.
B) Traitements proposés pour prévenir ou traiter un épisode d’encéphalopathie hépatique minime
- Les experts suggèrent d’administrer du lactulose en prophylaxie primaire de l’encéphalopathie hépatique en cas d’hémorragie digestive haute (Avis d’Expert, Accord Fort).
- Il est probablement recommandé de traiter tous les malades ayant une encéphalopathie hépatique minime par lactulose ou rifaximine pour améliorer la qualité de vie et réduire le risque d’encéphalopathie hépatique clinique (Garde 2+, Accord Fort).
- Le traitement pharmacologique de l’EH minime peut être considéré comme un traitement préventif de l’EH clinique.
-
Outre la détection et le contrôle de potentiels facteurs favorisants, les traitements de l’EH minime sont basés sur une modification du microbiote digestif (réduction de la pullulation bactérienne, accélération du transit digestif ou modification qualitative de la flore digestive (antibiothérapie, probiotiques) afin de réduire l’hyperammoniémie.1
1) Disaccharides non absorbables (lactulose, lactitol)
- Depuis 20 ans, de nombreuses études, avec une méthodologie plus ou moins satisfaisante, ont évalué l’efficacité des disaccharides non absorbables, considérés comme prébiotiques, dans la prise en charge de l’EH. La majorité de ces études ont essentiellement inclus des patients avec EH clinique.
-
Quelques études se sont centrées spécifiquement sur l’EH minime. La majorité de ces études montrent une amélioration significative des performances psychométriques des patients avec EH minime traités et une amélioration de leur qualité de vie.1 L’apparition d’une EH clinique chez les patients avec EH minime, traités par lactulose semble être diminuée mais il n’a pas été montré d’amélioration significative de la survie (en sachant que le délai de suivi des patients dans la majorité des études ne permettait pas d’étudier ce critère).1
-
En 2007 une conférence de consensus américaine rapportait que le lactulose était considéré par les médecins américains comme le traitement de première ligne en cas d’EH minime avérée1 et un algorithme de prise en charge thérapeutique de l’EH minime avait été publié, avec le lactulose en première ligne de traitement.1
2) La rifaximine
- C'est un antibiotique à large spectre ayant un faible passage systémique (peu absorbable par voie digestive), limitant ainsi la toxicité systémique et le risque de développer des résistances bactériennes. Plutôt que de modifier le microbiote intestinal, la rifaximine semble avoir un effet direct sur la fonction bactérienne et la virulence en altérant leur capacité à se transloquer.1
- Il a été montré que ce traitement pouvait moduler le microbiote et ainsi améliorer les performances neuro-psychiques et les fonctions cognitives des patients avec EH minime.1
- En 2010 un large ECR en double aveugle chez 299 patients, publié dans le NEJM, démontrait que le traitement par rifaximine diminuait significativement le risque d’EH clinique.1
- Malgré l’hétérogénéité des études disponibles, il semble raisonnable de recommander l’utilisation de lactulose ou de rifaximine pour le traitement de l’EH minime, en raison du fardeau que représente celle-ci en termes de qualité de vie, de réadmissions et de survenue d’EH clinique, et de l’innocuité de ces traitements.
3) Les probiotiques, symbiotiques (type le VSL#3 le plus fréquemment utilisé, mélange de 4 souches vivantes de lactobacillus)
- Seuls ou en association avec des prébiotiques (lactulose), ont pour but de modifier le microbiote intestinal afin de limiter la pullulation bactérienne.1
- De nombreuses études ont été publiées et les différentes méta-analyses ont suggéré un effet bénéfique des probiotiques sur les perturbations neuro-psychologiques observées au cours de l’EH minime.
-
L’intérêt des probiotiques dans la prise en charge de l’EH minime reste équivoque essentiellement en raison de la qualité méthodologique insuffisante des nombreux essais publiés (faible effectif, durée courte, variabilité nutritionnelle des populations étudiées), du caractère très variable des traitements évalués (type de substances, posologie) et des objectifs analysés. Au total, bien que l’efficacité sur l’amélioration de l’EH minime et la prévention des épisodes d’EH clinique soit probable, elle reste incertaine.
4) L-Ornithine-L-Aminotransferase (LOLA)
Son utilisation est basée sur la propriété de cette enzyme à diminuer le taux d’ammoniaque par le biais d’une augmentation de l’activité de la glutamine synthétase et du cycle de l’urée.1 1
Les Essais à comparaisons multiples entre probiotiques, lactulose, rifaximine ou L-ornithine-L- aspartate (LOLA) n’ont pas montré de supériorité de l’un d’entre eux sur les autres 1 1 1 1 et n’ont pas montré de différence significative en terme d’efficacité sur l’EH minime ou de prévention des épisodes d’EH clinique, ni en terme de survie.1
C) Traitement curatif de l’encéphalopathie hépatique clinique et de l’encéphalopathie hépatique minime
Chez les patients cirrhotiques ayant une encéphalopathie hépatique clinique, il est recommandé de traiter en priorité le(s) facteur(s) précipitant(s) de l’encéphalopathie hépatique et de débuter un traitement par un disaccharide non absorbable (lactulose ou lactitol). (Grade 1+, Accord Fort)
1) Lactulose/Lacticol
- Le lactulose est un disaccharide non absorbable composé de fructose et de galactose qui est métabolisé par les bactéries de la flore intestinale en acide acétique et acide lactique.
- Cette acidification du milieu colique crée un environnement hostile à la survie des bactéries uréasiques productrices d’ammoniaque (NH3) et favorise la conversion du NH3 en ions ammonium (NH4+) non absorbables et donc facilement éliminés par l’effet laxatif du lactulose.
-
Le lactitol, composé de béta-galactosido-sorbitol, est aussi un disaccharide non absorbable utilisé dans le traitement de l’EH et offre une alternative au lactulose1 mais son utilisation reste plus confidentielle en France.
-
L’association albumine +/- lactulose : Il n’est pas indiqué d’administrer l’albumine isolément en présence d’une EH clinique ; l’association lactulose-albumine mériterait d’obtenir une validation externe par des études plus large, en excluant des facteurs confondants notoires, comme une antibiothérapie concomitante.
2) Le polyéthylène glycol (PEG)
- Il augmente l’excrétion de l’ammoniaque par son effet laxatif osmotique.
-
Cette option thérapeutique n'est pas recommandée et mérite d’être explorée davantage.
3) La rifaximine
- L’analyse des biais potentiels des ECRs inclus dans des méta-analyses (études anciennes avec souvent de faibles effectifs) ne permet pas de recommander la rifaximine seule comme traitement de l’EH clinique.
- L’association rifaximine + lactulose : pas de recommandation actuellement.
4) Le flumazénil
- C'est un antagoniste compétitif des récepteurs des benzodiazépines qui peut avoir un effet bénéfique sur l’EH en modulant le tonus GABA-ergique qui est élevé chez ces patients, conduisant à une neuro-inhibition.
- Le niveau de preuve suggérant un effet bénéfique du flumazénil sur l’EH était jugé de faible qualité. Son utilisation pourrait être intéressante dans les cas d’EH secondaire à une prise de benzodiazépines et dans des situations d’EH au stade de coma pour tenter d’éviter une intubation trachéale.
D) Traitements utilisé pour éviter la récidive de l’encéphalopathie hépatique
- Chez les patients cirrhotiques, il est recommandé d’utiliser un disaccharide non absorbable (lactulose ou lactitol) pour prévenir la récidive de l’encéphalopathie hépatique. (Garde 1+, Accord Fort)
- Chez les patients cirrhotiques, il est probablement recommandé d’ajouter la rifaximine pour prévenir la récidive de l’EH, en cas d’échec de la prévention par un disaccharide non absorbable (lactulose ou lactitol). (Garde 2+, Accord Fort)
- Chez les patients cirrhotiques, les experts suggèrent d’utiliser la rifaximine seule pour prévenir la récidive de l’encéphalopathie hépatique lorsque le lactulose est mal toléré. (Avis d’Expert, Accord Fort)
Il est recommandé d’utiliser en première intention le lactulose (ou lactitol) pour prévenir la récidive de l’EH clinique. Pour prévenir la récidive de l’EH clinique, il est recommandé d’ajouter la rifaximine en cas d’échec du lactulose seul. Il est difficile de recommander d’utiliser la rifaximine seule pour prévenir la récidive de l’EH car il n’y a pas d’ECR ayant évalué efficacement la rifaximine au placebo. Les experts suggèrent que la rifaximine seule peut être utilisée pour prévenir la récidive de l’EH lorsque le lactulose est mal toléré ; l’ensemble des experts s’accorde à dire que l’utilisation de la rifaximine seule est fréquente car la plupart de ces malades ne parvient pas à poursuivre le lactulose au long cours du fait des effets indésirables (diarrhée, ballonnements etc.).
E) Prise en charge non médicamenteuse de l’encéphalopathie hépatique
- Il n’est probablement pas recommandé d’estimer l’état nutritionnel et, plus spécifiquement, la sarcopénie, pour évaluer le risque de survenue d’une encéphalopathie hépatique ni pour en guider son traitement. (Grade 2-, Accord Fort)
- Il est probablement recommandé des apports énergétiques et protéiques journaliers optimaux de 35-40 kcal/kg et 1,2-1,5 g/kg de poids idéal, respectivement. Il n’est pas recommandé d’avoir recours à une restriction protéique en dehors de la phase aiguë de l’encéphalopathie hépatique et pour une courte durée. (Grade 2+, Accord Fort)
- Il est probablement recommandé de supplémenter en acides aminés ramifiés les patients cirrhotiques pour prévenir l’encéphalopathie, particulièrement en cas d’intolérance au régime protidique. (Grade 2+, Accord Fort)
1) Etat nutritionnel
- La malnutrition protéique a bien été documentée au cours de la cirrhose et sa sévérité est directement corrélée à la gravité de la maladie du foie.1 1 1 La malnutrition protéique résulte de plusieurs mécanismes intriqués impliquant l’insuffisance hépatique qui s’associe à la baisse de la glycogénolyse, la diminution de l’activité physique et l’augmentation des dépenses énergétiques de repos. D’autres facteurs semblent participer, mais les mécanismes sont mal connus.
- L’évaluation théorique de l’état nutritionnel comprend un recueil des ingesta journaliers, des données anthropométriques (poids, taille, indice de masse corporelle ou IMC, périmètre brachial, épaisseur du pli cutané tricipital), des données de la composition corporelle et des mesures biologiques. Toutefois, la plupart de ces éléments sont difficiles à interpréter au cours de la cirrhose. L’IMC n’a que peu de valeur dans cette population, en particulier aux stades les plus avancés de cirrhose, lorsqu’il existe de l’ascite ou des œdèmes. La reproductibilité et la fiabilité des mesures du périmètre brachial et de l’épaisseur du pli cutané tricipital sont faibles.1
- La composition corporelle, qui peut être évaluée selon des méthodes plus ou moins complexes, a les mêmes limites que l’IMC. Les marqueurs biologiques utilisés en pratique courante sont tous de synthèse hépatique, et ne sont pas utilisables chez les patients atteints de cirrhose lorsqu’il existe une insuffisance hépatique.1
- L’évaluation de la sarcopénie est probablement le meilleur outil pour évaluer l’état nutritionnel.1 En dehors du contexte de la cirrhose, la sarcopénie est estimée en combinant l’évaluation de la masse musculaire (par absorptiométrie, impédancemétrie ou scanner) et celle de la force musculaire.1 Chez les patients atteints de cirrhose, la détermination de la masse musculaire sur le scanner est la technique qui a été la plus évaluée.1 La mesure de la surface musculaire du psoas et des muscles abdominaux, sur une coupe de scanner au niveau des corps vertébraux L3 et L4, est la plus utilisée, car indépendante de l’activité physique des patients-souvent très diminuée dans ce contexte-, simple à mesurer et reproductible.1 Il n’existe toutefois pas, pour l’instant, de valeur consensuelle définissant les seuils anormaux et des travaux multicentriques doivent être réalisés.1
- Il existe de nombreux arguments suggérant que la dénutrition et, en particulier la sarcopénie, favorise la production accrue d’ammoniaque, principal composé impliqué dans l’encéphalopathie. De plus, l’hyperammoniémie favorise la dénutrition protéique, contribuant ainsi à majorer la sarcopénie.1 Néanmoins, aucun impact d’une renutrition protéique sur l’EH n’a été documenté dans la littérature.
- Le rythme, la fréquence et l’heure des repas semblent également jouer un rôle dans la survenue d’un épisode d’encéphalopathie. Plusieurs études, rapportées dans une revue systématique en 2012, se sont intéressées à la chrononutrition.1 Leur conclusion converge vers l’ingestion de petits repas fractionnés (pas plus de 3 à 6H de jeûne), en favorisant les encas du soir. Néanmoins le bénéfice clinique reste faible, puisque ni la survie, ni le nombre d’hospitalisations, et ni le nombre d’épisodes d’encéphalopathie ne sont modifiés par ces mesures.
2) Compléments alimentaires
- Les acides aminés ramifiés (valine, leucine, isoleucine) sont métabolisés par le muscle squelettique, contrairement aux autres acides aminés, qui sont métabolisés par le foie, parmi lesquels les acides aminés aromatiques (phénylalanine, tyrosine, méthionine). En cas de cirrhose, les concentrations plasmatiques des acides aminés ramifiés sont abaissées alors que celles des acides aminés aromatiques sont élevées. L’apport d’acides aminés ramifiés pourrait faciliter la détoxification de l’ammoniaque en augmentant la synthèse de glutamine et entraîner une diminution de la perméabilité de la barrière hémato-encéphalique.1 Bien que les acides aminés ramifiés aient montré un bénéfice sur la récidive de l’EH, ils ne sont pas utilisés en France car non commercialisés et non remboursés. Il est cependant possible de s’en procurer sous forme de suppléments alimentaires, utilisés par de nombreux sportifs.
-
Le zinc est diminué en cas de cirrhose et altère plusieurs fonctions enzymatiques, augmentant le risque d’encéphalopathie. Une supplémentation en zinc a donc fait l’objet de plusieurs études reprises dans une méta-analyse récente. D’après les résultats de ce travail, la correction du déficit en zinc permettrait d’améliorer les tests psychométriques mais n’aurait pas d’influence sur la survenue de nouveaux épisodes d’EH.1
F) Éducation thérapeutique et encéphalopathie hépatique
Afin de prévenir la survenue des complications de la cirrhose et d’améliorer la qualité de vie du patient cirrhotique et de son entourage, les experts suggèrent de proposer au patient et à un aidant identifié un programme d’éducation thérapeutique dès le diagnostic d’hépatopathie chronique avancée ou d’EH minime ainsi qu’une conciliation médicamenteuse après toute hospitalisation pour complication. (Avis d’Expert, Accord Fort)
Afin de prévenir la survenue des complications de la cirrhose et d’améliorer la qualité de vie du patient cirrhotique et de son entourage, il est fortement recommandé de proposer au patient et à un aidant identifié :
- Dès le diagnostic d’hépatopathie chronique avancée : un programme d’éducation thérapeutique et à défaut une démarche éducative, axée principalement sur la prévention des complications, et la surveillance.
- Dès le stade d’EH minime : un programme d’éducation thérapeutique mettant l’accent sur l’adhésion thérapeutique, le renforcement des compétences d’auto-soins (particulièrement la prise de décision incluant l’aidant naturel), et la coordination des soins. L’identification d’un aidant et sa place au sein de l’intervention est primordiale.
- Après toute hospitalisation pour complication : une prise en charge coordonnée et multidisciplinaire incluant une conciliation médicamenteuse.
G) L’encéphalopathie hépatique et le TIPS
Les experts suggèrent qu’un épisode unique d’EH clinique n’est pas une contre-indication formelle à la création d’un TIPS non urgent, dont l’indication doit être discutée au cas par cas. (Avis d’Expert, Accord Fort).
Il n’est probablement pas recommandé d’utiliser une prophylaxie médicamenteuse afin de prévenir la survenue d’une EH après TIPS.(Grade 2-, Accord Fort)
Il n’est probablement pas recommandé de lier ou d’emboliser systématiquement les shunts porto-systémiques dans le but de traiter l’encéphalopathie hépatique. La prise en charge des shunts porto-systémiques doit faire l’objet d’une discussion au cas par cas. (Grade 2-, Accord Fort)
- La création d’un shunt, associée parfois à une détérioration de la fonction hépatocellulaire, a pour conséquence une accumulation de substances neurotoxiques, favorisant l’EH. L’EH survient dans 35% des cas environ.
- En cas d’hémorragie digestive réfractaire par rupture de varices, il n’existe pas de contre-indication au TIPS (dit de sauvetage) puisqu’il n’existe pas d’alternative thérapeutique.
- Dans le contexte d’un TIPS programmé, soit pour ascite réfractaire, soit en prophylaxie secondaire de l’hémorragie digestive, toutes les études publiées ont exclu les patients avec des signes cliniques d’EH au moment de l’inclusion. On ne peut donc pas proposer cette thérapeutique en cas d’EH clinique.
- Si les facteurs de risque sont bien analysés, aucune méthode n’a permis d’identifier les patients qui vont développer une EH après TIPS. il est donc important d’identifier les patients à haut risque de développer une EH après TIPS par un interrogatoire (à la recherche d’un antécédent d’EH clinique), un examen clinique complet et une évaluation des scores de Child- Pugh et de MELD. Ainsi, au cas par cas, on pourra préférer un TIPS ou une alternative thérapeutique (greffe) si elle est disponible. En conséquence, la faisabilité d’une greffe hépatique doit être discutée chez tous les patients chez qui on pose une indication de TIPS.
- La couverture de la prothèse et son diamètre ne modifient pas l’incidence de l’EH après TIPS.1 1 1 1 1 1
- Si une EH survient après la pose du TIPS, elle doit être traitée de façon habituelle à l’aide des traitements disponibles, tels que le lactulose et/ou la rifaximine. L’EH est dite réfractaire lorsqu’il persiste des signes d’EH malgré un traitement médical bien mené. On peut alors proposer des modifications du shunt (recalibrage, occlusion). Une transplantation hépatique doit être discutée rapidement si une EH réfractaire après TIPS survient.
- La présence d’épisodes d’EH est corrélée à la présence et à la taille des shunts porto-systémiques.1 L’embolisation radiologique de shunts porto-systémiques ou de la veine splénique,1 voire leur ligature chirurgicale par voie mini-invasive1 parfois associée à une splénectomie,1 chez les patients cirrhotiques avec EH semble réalisable dans des conditions de sécurité satisfaisantes, même si l’embolisation radiologique n’est pas techniquement réalisable dans tous les cas.1 Le traitement des shunts permet la disparition de l’EH dans 46%1 à 100% des cas.1 Les principales complications sont des complications au point de ponction (hématome), hématome intra-hépatique avec hémobilie voire hémopéritoine et à moyen terme aggravation de l’ascite ou aggravation de varices œso-gastriques. Cependant, le faible effectif des études,1 1 1 1 l’absence d’évaluation à long-terme (sauf dans une étude qui montre une mortalité importante à moyen terme des complications de la cirrhose)1 et l’absence de groupe contrôle dans la totalité des études sauf une1 ne permettent pas de recommander l’embolisation ou la ligature systématique de shunts porto-systémiques dans le traitement de l’EH en pré-transplantation hépatique. La prise en charge des shunts porto-systémiques dans le cadre de l’EH doit donc se faire au cas par cas et après décision multidisciplinaire, en privilégiant les voies d’abord mini-invasives.
H) L’encéphalopathie hépatique et transplantation hépatique (TH)
1) Amélioration neurologique post-TH
Il est probablement recommandé de proposer la transplantation hépatique chez les patients présentant une encéphalopathie hépatique invalidante réfractaire aux traitements médicamenteux et non médicamenteux. (Grade 2+, Accord Fort)
- L’EH pré-greffe semble être un facteur de risque de complications neurologiques en post-greffe immédiat (EH, épilepsie, toxicité médicamenteuse1, retards au réveil).1
- La transplantation hépatique (TH) permet une amélioration significative de la plupart des fonctions cognitives chez les patients présentant une EH : les performances cognitives s’améliorent à partir de 6 mois après la TH,1 même si elles peuvent rester légèrement inférieures aux performances des patients sans EH en pré-greffe.1 1 1 On observe également une normalisation de l’EEG.1 Certaines fonctions cognitives sont améliorées, notamment la capacité d’apprentissage1 à 6-18 mois1, ainsi que l’attention visuo-spatiale, la fluence verbale, la vitesse psychomotrice et la planification spatiale.1 1
- Certaines fonctions ou certains signes radiologiques semblent moins bien s’améliorer en post-greffe : persistance de troubles visuo-moteurs,1 altérations de la substance blanche en zone temporale à l’IRM.1
- Une EH séquellaire peut persister et concerne moins de 5% des patients, notamment ceux qui présentaient une EH grade 3-4 avant la TH.1 La TH permet chez les patients atteints d’une EH d’améliorer leur qualité de vie.1 1 1 La présence d’une EH en pré-TH n’impacte pas la reprise d’une activité professionnelle après la greffe.1
2) Bilan neurologique avant TH
Les experts suggèrent la réalisation systématique d’une IRM, d’un électroencéphalogramme et d’un dosage de l’ammoniémie, afin d’éliminer une autre cause de troubles neuro-psychologiques qui pourraient persister après la transplantation hépatique. (Avis d’Expert, Accord Fort)
- Dans le champ particulier de la TH, la question du diagnostic de l’EH se pose dès le bilan pré-greffe. Il s’agit, d’une part, de ne pas méconnaitre un diagnostic différentiel de troubles neuropsychologiques qui pourraient persister après la greffe, et d’autre part, d’identifier les formes d’EH infra-cliniques (grade 1) qui pourraient impacter le pronostic si la durée d’attente est longue.1 Le bilan neurologique doit faire partie de l’évaluation de tout patient candidat à la TH.
- Il n’y a pas de test ou technique spécifiques permettant d’affirmer le diagnostic d’EH : le diagnostic d’EH est d’abord évoqué sur des arguments cliniques. Il existe des formes atypiques d’EH. Des manifestations épileptiques ont été rapportées, régressant avec le traitement de l’EH.1 1 Plus rares sont les formes de myélopathie hépatique ou porto-systémique, qui ne répondent pas aux traitements de l’EH et qui peuvent régresser après TH si le diagnostic a été fait suffisamment tôt.1 1
- Le patient candidat à la TH présente des particularités : étiologie alcoolique de la cirrhose dans 40% des cas, gravité de la décompensation hépatique, comorbidités (insuffisance rénale, diabète), qui peuvent être responsables de pathologies mimant ou se rajoutant à une EH. Certaines sont faciles à éliminer par l’imagerie : hémorragie, infection, tumeur. D’autres surviennent dans des conditions métaboliques particulières : hyponatrémie, hypercalcémie, céto-acidose, états hyperosmolaires. Dans certains cas cependant, le diagnostic différentiel est difficile : démence neuro-dégénérative, vasculaire ou alcoolique, pathologies psychiatriques.
-
La réalisation d’une imagerie cérébrale, IRM plutôt que scanner, semble nécessaire dans le contexte du bilan pré-greffe, même s’il n’existe pas d’études dédiées spécifiquement à cette situation.1 1 En IRM, les séquences T1 mettent en évidence une hyperintensité des structures de la ganglia basale et notamment du globus pallidus, en rapport avec des dépôts de manganèse. En séquences T2, l’hyperintensité est décrite le long de la substance blanche dans et autour de l’axe cérébro-spinal. Ces anomalies régressent après la TH. D’autres techniques telles que l’IRM de diffusion, l’IRM fonctionnelle, la spectro-IRM, la proton-spectro IRM font partie du domaine de la recherche.
-
La réalisation d’un électroencéphalogramme pour aider au diagnostic différentiel est discutée. Dans le champ de la TH, l’EEG a été utilisé soit comme critère permettant d’améliorer la performance du score MELD dans la prédiction de la mortalité à 12 et 18 mois,1 soit comme preuve de réversibilité de l’EH après TH.1
-
Le dosage de l’ammoniémie n’a pas été étudié dans le champ de la TH pour cirrhose. Il ne peut pas être utilisé seul pour affirmer le diagnostic de l’EH, mais sa normalité impose de rechercher un diagnostic différentiel. La relation entre le taux d’ammoniémie pré-TH et le risque de séquelles neurologiques est soulevée dans des cas cliniques rapportés de TH pour maladies du cycle de l’urée.1
3) Prise en compte d’une encéphalopathie hépatique dans l’accès à la greffe des patients inscrits pour cirrhose décompensée ou carcinome hépatocellulaire
Les experts suggèrent de prendre en compte l’encéphalopathie hépatique clinique dans les règles d’attribution des greffons et de procéder à une évaluation standardisée et reproductible de l’encéphalopathie hépatique chez tout candidat à la greffe. Les experts suggèrent de redéfinir les règles d’attribution des greffons en cas d’encéphalopathie hépatique quel que soit le stade et le MELD. (Avis d’Expert, Accord Fort)
- En France, la présence d’une EH chez un candidat à la greffe est prise en compte dans l’attribution des greffons. Elle permet d’obtenir un accès accéléré à la greffe dans des conditions cependant très restrictives et subjectives, uniquement dans le cadre d’une composante expert « Encéphalopathie ».
- Dans ce contexte:
- Les patients avec un score MELD < 15 ayant présenté au moins un épisode d’encéphalopathie sévère grade 3 ou 4 (coma) avec présence démontrée d’un gros shunt porto-systémique spontané ou thérapeutique et nécessitant des hospitalisations prolongées ou répétées peuvent bénéficier d’un accès accéléré à la greffe en 6 mois.
- Les patients avec un score MELD < 15 présentant une EH avec signes focaux et/ou un syndrome extra- pyramidal peuvent bénéficier d’un accès accéléré à la greffe en 3 mois.
- Une composante expert « Encéphalopathie » est ainsi demandée pour une cinquantaine de patients par an, et octroyée dans 90% des cas ; la composante expert EH représente au total 12% des demandes de composantes expert et est en augmentation de 17% entre 2016 et 2017.
-
Les patients inscrits en liste de greffe ayant une EH de grade 2 à 4 pourraient être priorisés sur liste quel que soit leur score MELD à l’inscription. L’attribution automatique de points MELD supplémentaires pourrait permettre de compenser le sur-risque de mortalité en liste de ces patients. Des études prospectives complémentaires sont donc souhaitables pour déterminer la valeur optimale de points MELD à octroyer et pour préciser l’impact pronostique de l’EH minime, de l’EH grade 2, de l’ACLF et des formes rares, focales et comitiales d’EH.
EVOLUTION/PRONOSTIC
- La survenue d’une EH constitue un facteur majeur de mauvais pronostic. En effet, la survenue d’un premier épisode d’EH clinique est associée de manière indépendante à une mortalité accrue avec un taux de survie cumulée à 1 an et 3 ans de respectivement 42% et 23%.1 1 Une telle association est discutée pour l’EH minime et n’est rapportée que dans certaines études.1
- Outre cette association avec la mortalité, l’existence d’une EH, clinique ou minime, est associée à un impact négatif sur la qualité de vie.
-
L’EH minime a un retentissement délétère sur les risques de la vie quotidienne : chutes, accidents de la voie publique, métiers à risque,1 altération des performances de conduite. Il a ainsi été montré un surcroit d’accidents de la voie publique chez les malades en conditions réelles de conduite1 ou lors de tests sur simulateurs.1 Cela est corroboré par une incidence accrue d’infractions et d’accidents de la route en vie réelle.1
-
Ainsi, les troubles du sommeil, les capacités d’apprentissage et de mémoire à court terme, les risques d’accidents domestiques et de conduite automobile et la survenue de chutes sont présents dès le stade d’EH minime.1
PRÉVENTION
Votre texte ici
SURVEILLANCE
- La surveillance de l’EH clinique se fait au mieux avec le score de West-Haven bien qu’aucune traduction française n’ait été validée.
- Utilisé principalement par les hépatologues, ce score n’est pas bien connu des autres spécialistes.
- D’autres scores généralistes, comme le score de Glasgow ou le FOUR score, ont été évalués et peuvent être utilisés pour interagir avec les urgentistes ou les réanimateurs.
CAS PARTICULIERS
Votre texte ici
THÉRAPIES FUTURES
Votre texte ici
