Echinococcose

INTRODUCTION/GÉNÉRALITÉ
- Les échinococcoses sont des zoonoses parasitaires causées par des larves de ténias du genre Echinococcus, appartenant à la famille des Taenidés (vers plats).1 1 1
- Il existe plusieurs espèces d'Echinococcus, dont les deux plus fréquentes chez l’homme sont E. multilocularis et E. granulosus, responsables respectivement de l'échinococcose alvéolaire (EA) et de l'échinococcose kystique (EK), appelée aussi hydatidose ou kyste hydatique.
- Au sein d'Echinococcus granulosus sensu lato, on distingue cinq espèces : E. granulosus sensu stricto, E. canadensis, E. ortleppi, E. equinus, et E. felidis.
- E. multilocularis et E. granulosus sont différentes dans leurs distributions géographiques, les animaux hôtes qu’elles impliquent et leurs présentations cliniques.1
AGENT PATHOGÈNE
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
1) Le parasite adulte
- E. multilocularis (Cestode) est un petit taenia de 3 à 5 mm.
- Il ne comporte que 3 à 4 anneaux.
- Le renard est parasité par un grand nombre de ces petits taenias.
2) La forme larvaire
- Elle se forme essentiellement au niveau du foie et rarement ailleurs et constituée de 4 éléments caractéristiques : cuticule ou membrane anhyste, membrane germinative ou proligère, protoscolex et liquide excrété-sécrété.
- Chez l’hôte intermédiaire (campagnol et autres rongeurs sauvages) la larve parasitaire constitue une vésicule racémeuse formant de multiples alvéoles au sein d’un foyer nécro-fibreux. Dans chaque vésicule bourgeonnent plusieurs protoscolex.
- L’homme est un hôte intermédiaire accidentel.1
B) L’échinococcose kystique (EK) due à E. granulosus
1) Le parasite adulte
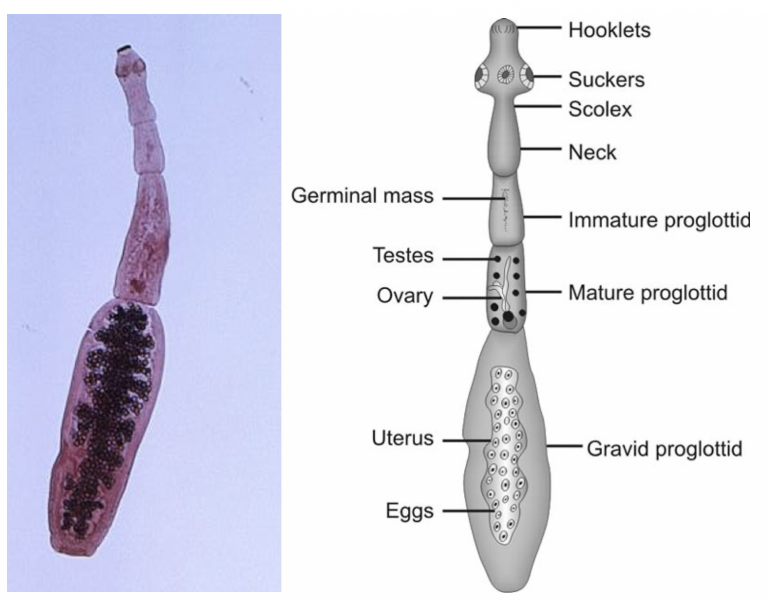
- Echinococcus granulosus est un petit taenia du chien de 3 à 7 mm.
- Il ne comporte que 3 à 4 anneaux dont le dernier occupé par un utérus ramifié rempli d’œufs.
- L'anneau terminal se détache activement du corps du parasite puis est éliminé dans le milieu extérieur.
- Ces vers sont présents en grand nombre dans l’intestin de l’hôte définitif, les canidés.
2) La forme larvaire (kyste hydatide)
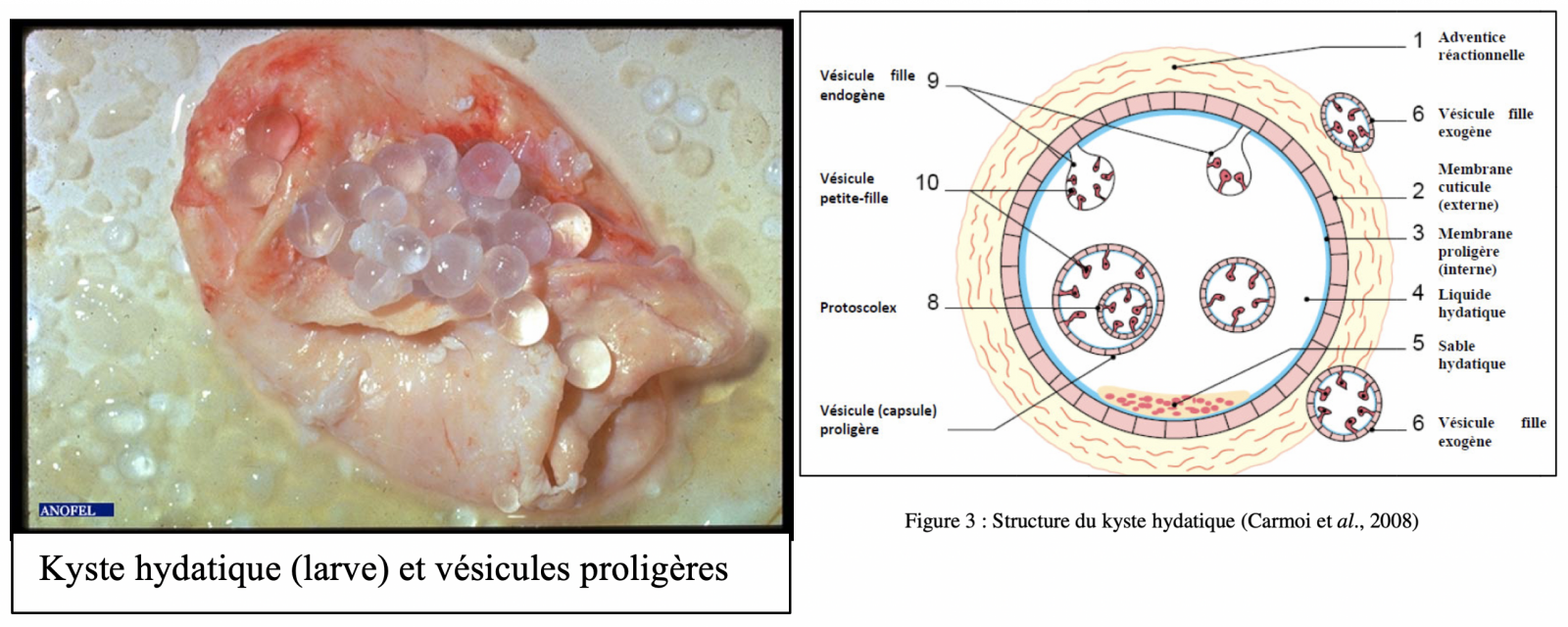
- Elle se forme dans divers organes par la vésiculisation suivie d’une croissance progressive d’un embryon hexacanthe de 25 μm à 30 μm. Au terme de son développement elle peut atteindre 10 cm à 20 cm de diamètre et de forme sphérique ou plus ou moins polylobée si elle réside dans un tissu mou.
- Le kyste est constitué, de l’extérieur vers l’intérieur, d’une membrane tissulaire réactionnelle appartenant à l’hôte et de deux membranes parasitaires : cuticule anhiste (acellulaire) et proligère germinative cellulaire, donnant naissance à des vésicules contenant des scolex invaginés (protoscolex de 150 μm à 200 μm). Le kyste est rempli d'un liquide hydatique eau de roche contenant de nombreux protoscolex et débris de membrane (sable hydatique).
-
Ces protoscolex (résultant du bourgeonnement de la membrane des capsules proligères d’un kyste hydatique et mesurant 120 μm environ) sont contenus dans le liquide directement ou dans des vésicules filles flottant dans le liquide hydatique et donneront de futures têtes de tænia (scolex) portant quatre ventouses et une double couronne de 30 à 40 crochets.1 1
CYCLE ÉVOLUTIF
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
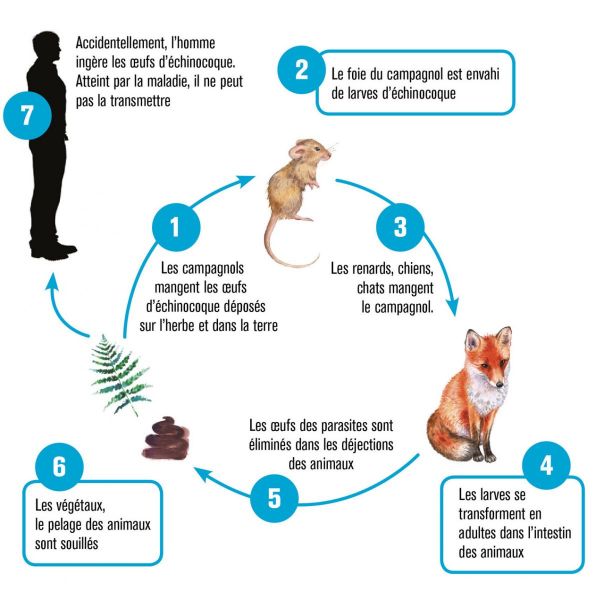
Concernant le cestode E. multilocularis (1,2 à 3,7 mm), le cycle de vie est similaire à celui d’E. granulosus, avec néanmoins les principales différences suivantes :1
- l’hôte définitif est le renard et, dans une moindre mesure, les chiens, les chats, les coyotes et les loups ;
- De très nombreuses espèces de petits mammifères sont les hôtes intermédiaires, infectés par la forme larvaire du parasite (ou métacestode).
- La croissance larvaire (dans le foie) reste indéfiniment en phase proliférative, entraînant une invasion des tissus environnants et s'accompagne d'une importante réaction immunitaire de l'hôte, sous forme de granulome périparasitaire .
Contrairement à une idée souvent répandue, l’urine des carnivores n’est pas contaminante puisque les vers adultes parasitent l’intestin des carnivores. Les embryons provenant de la transformation des œufs ingérés (oncosphères) parviennent au foie par voie portale, bourgeonnent et prennent une forme microkystique, créant de nombreuses alvéoles, d’où l’expression d’échinococcose « alvéolaire », qui différencie la maladie de celles associées à l’infection par d’autres cestodes du même « genus », E. granulosus sensu lato (responsables de l’échinococcose kystique), et E. oligarthra et E. vogeli (responsables des échinococcoses néotropicales).
B) L’échinococcose kystique (EK) due à E. granulosus
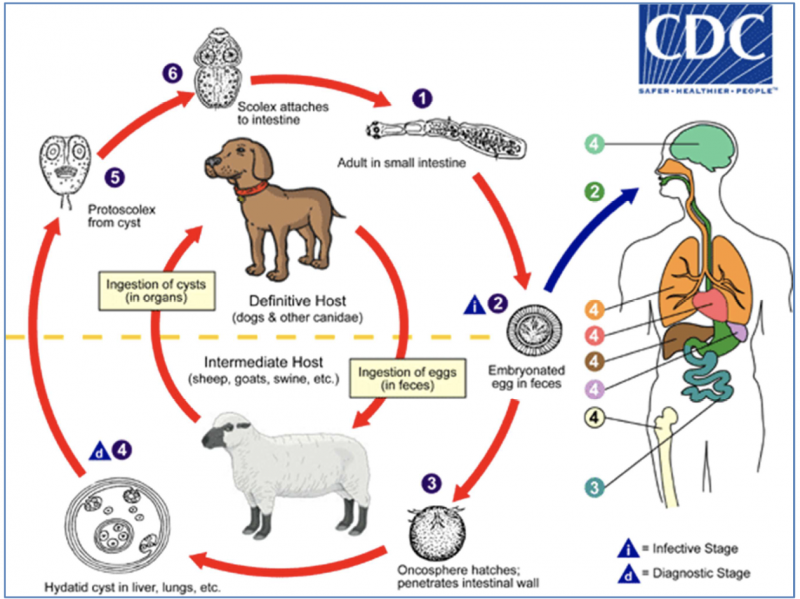
Cycle évolutif d’Echinococcus granulosus d’après les Centers for Disease Control and Prevention, 2013 : 1
- Étape 1 : L'E. granulosus adulte mesure 3 à 6 mm de long et réside dans l'intestin grêle des hôtes définitifs que sont le chien ou tous les canidés. Dans un premier temps, les proglottis (anneaux) gravides libèrent les œufs qui passent dans les selles.
- Étapes 2 et 3 : Après ingestion par un hôte intermédiaire (moutons, chèvres, porcs, bovins, chevaux, chameaux et tous les mammifères y compris l’homme), l'œuf éclot dans l'intestin grêle et libère une oncosphère (L’oncosphère est l’embryon mobile et cilié de certains ténias), celle-ci pénètre dans la paroi intestinale et migre à travers le système circulatoire vers divers organes, en particulier le foie et les poumons.
- Étape 4 : Dans ces organes, l'oncosphère se développe en un kyste entouré d’une coque fibreuse, très peu cellulaire, qui croit progressivement et peut renfermer des centaines de milliers d’éléments infestant appelés protoscolex . L'hôte définitif est infecté par l'ingestion des organes contenant le kyste de l'hôte intermédiaire infecté.
- Étapes 5 et 6 : Après ingestion par l’hôte définitif (le chien), les protoscolex se dévaginent et donnent chacun naissance, par bourgeonnement, à un E. granulosus adulte (l’évolution vers les stades adultes se fait en 32 à 80 jours).1
C) Transmission
- Pour les deux types d’échinococcoses, l’homme intervient comme hôte intermédiaire accidentel et constitue une impasse parasitaire pour le parasite qui reste séquestré dans les tissus hôtes humains.1
- Elle se fait principalement par ingestion d’œufs microscopiques présents sur des végétaux (baies, pissenlits, champignons...) souillés par les fèces d’animaux (renard, chien, chat) infestés ou par contacts directs répétés avec les animaux du fait de la présence des œufs des parasites sur leur pelage.1 1
PHYSIOPATHOLOGIE
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
- Il s'agit d'une tumeur à diffusion racémeuse, au développement anarchique, envahissante, comprimant et diffusant dans les canaux biliaires ainsi que dans les vaisseaux intrahépatiques. Au cours de l'invasion larvaire, les réactions parasite-tissu hôte sont extrêmement violentes et déterminent des lésions nécrotiques diffuses. L’antigène excrété-sécrété, à pouvoir nécrotique puissant, diffuse précocement dans des régions avoisinantes. Ils se forment alors des manchons fibreux qui gênent partiellement l’extension anarchique des membranes parasitaires. La membrane cuticulaire est plissée dans tous les sens avec des lambeaux de membrane germinative et rarement des protoscolex. Ultérieurement cette fibro-nécrose s’achève laissant persister une tumeur déshabitée à l’aspect de pain bis ou de pierre meulière.
B) L’échinococcose kystique (EK) due à E. granulosus
- Les manifestations pathologiques sont souvent très tardives et n'apparaissent que bien des années après l'infestation. Elles sont liées surtout aux complications dues à une fissuration, une rupture ou une surinfection du kyste lui-même ou à une compression anatomique de voisinage du fait de sa masse importante.
- Lors de la rupture spontanée ou provoquée d’un kyste hydatique, le déversement massif du liquide hydatique provoque dans l’immédiat un choc anaphylactique souvent mortel et la libération des scolex et des vésicules génère d’autres kystes hydatiques secondaires (échinococcose secondaire) posant un véritable problème thérapeutique. La calcification de la membrane adventice se produit parfois, mais la larve meurt plus tardivement.1
ÉPIDÉMIOLOGIE
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
L’échinococcose alvéolaire ne sévit que dans l’hémisphère nord (les œufs du parasite craignent la chaleur et la sécheresse).1 il s’agit d’une maladie majoritairement rurale.
1) Dans le Monde
- La Chine de l’Ouest (centre et nord-ouest) rassemble le plus grand nombre de cas d’échinococcose alvéolaire au plan mondial.
- Des foyers d’échinococcose alvéolaire ont été identifiés en Alaska, au Japon (Hokkaïdo), dans la plus grande part de la Russie, de l’Asie centrale, dont l’ouest de la Turquie.1
- Alors qu’en dépit d’une infection connue des renards en Amérique du Nord, seuls quelques cas humains isolés avaient été décrits au cours du siècle dernier, depuis 2013 des cas humains d’échinococcose alvéolaire ont été découverts au Canada, principalement dans l’Alberta.1
- En Europe, les principales régions d’endémie sont au nord, est et centre de l’Europe : Allemagne, Suisse, Autriche, est et centre de la France. Cependant, depuis la fin du xxe siècle, la présence du parasite est avérée dans presque tous les pays d’Europe, et l’apparition de cas humains a confirmé le risque effectif de contamination dans ces pays ; les pays baltes sont les plus touchés.1
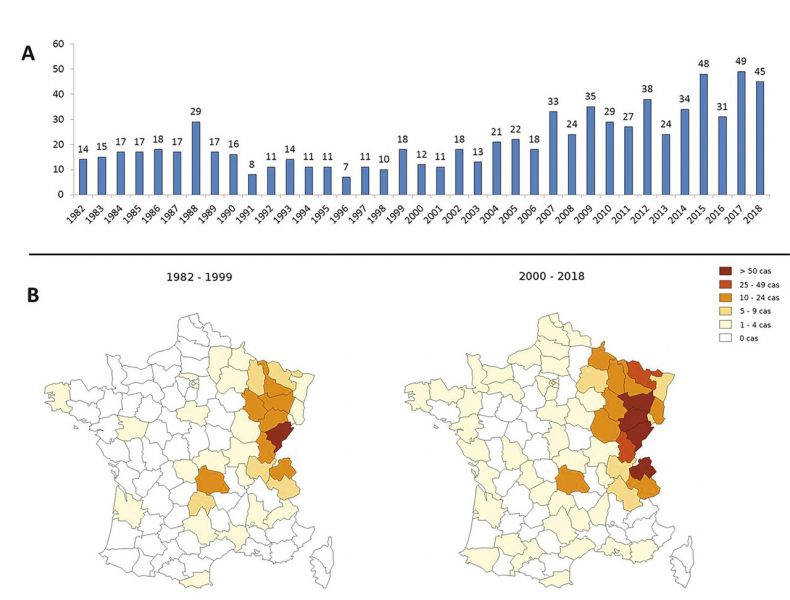
2) En France
- Au total, 607 cas ont été enregistrés dans la base FrancEchino 1982-2014
- L’incidence annuelle moyenne enregistrée entre 2006 et 2015 est de 19,2 cas par an, soit une incidence de 0,032/100 000 habitants/an.1
-
En France, cette parasitose est observée essentiellement en Franche-Comté, en Lorraine, en Rhône-Alpes et en Auvergne.1
- En France, une étude à grande échelle a montré une contamination des renards dans des régions de l’Ouest jusqu’à présent considérées indemnes, et des cas humains y sont régulièrement signalés.1
- La répartition temporelle et géographique des cas observés en France entre 1982 et 2018 est donnée dans la figure ci-dessous.1
B) L’échinococcose kystique (EK) due à E. granulosus
1) Dans le Monde
- L’échinococcose kystique existe sur tous les continents sauf l’Antarctique, le plus fréquemment dans les zones rurales d’élevage de moutons.1
- Prévalence mondiale : 2 à 3 millions de cas et incidence mondiale: 180-200 000 nouveaux cas/an.
- Dans les régions d’endémie, les taux d’incidence de l’échinococcose kystique chez l’homme peuvent dépasser 50 pour 100 000 personnes-années, et la prévalence peut atteindre 5 % à 10 % dans certaines régions d’Argentine, du Pérou, d’Afrique de l’Est, d’Asie centrale et de Chine.1
- Incidence annuelle pour quelques pays : Maroc : 7,2/100 000 hbts ; Tunisie : 15/100000 hbts ; Argentine: 21/100000 hbts ; Uruguay: 32/100000 hbts ; Kenya: 220/100000 hbts.1
2) En France et en Europe :
- En France, on note 100 à 150 nouveaux cas/an, la prévalence était de 0,42/100 000 habitants en 2016.1, des foyers existent toujours dans le Sud- Ouest (Landes et Pays basque), le Sud-Est, en Corse et en Provence.1
- Selon le rapport de surveillance de l’European Centre for Disease Prevention and Control (ECDC) de 2012, l’EK est devenue rare. 1 En 2010, l’incidence de l'échinococcose dans l'Union européenne (UE) était de 0,18 cas pour 100 000 habitants, la Bulgarie ayant enregistré le nombre de cas le plus élevé (3,85/100 000 habitants). Elle est endémique en Europe du Sud et en Europe Centrale.
FACTEURS DE RISQUES
Votre texte ici
EXAMEN CLINIQUE
Les manifestations pathologiques des infections humaines à E. multilocularis et E. granulosus sont en général très tardives et n’apparaissent que des années après l’infestation. Bien que les deux formes d’échinocoques soient très semblables, les deux maladies sont extrêmement différentes en matière de présentations cliniques, d’évolutivité et de pronostic.1 1 1
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
- De plus en plus souvent en Europe, une fois sur deux en France (données FrancEchino), l’échinococcose alvéolaire est asymptomatique et n’est découverte qu’à la faveur d’un examen d’imagerie.1
- La révélation de l’affection par des symptômes cliniques traduit habituellement soit une lésion volumineuse, soit une complication liée à l’invasion ou à la compression des structures vasculaires ou biliaires.
- Le site principal du développement des larves est presque exclusivement le foie et la présentation clinique peut imiter celle du carcinome hépatocellulaire.
1) Les manifestations cliniques révélatrices « classiques » sont :
- Des douleurs abdominales non systématisées, des troubles dyspeptiques, une pesanteur de l’hypocondre droit sans aucune caractéristique spécifique sont trouvés dans 80 % des cas dans les années précédant le diagnostic
- L’hépatomégalie, d’allure pseudo-tumorale, dure, irrégulière, due à la masse parasitaire, ne traduit parfois seulement que l’hypertrophie compensatrice du foie lorsque les lésions, même de taille limitée, ont envahi les vaisseaux portes. Sa découverte, avec un état général conservé, doit en zone d’endémie faire évoquer le diagnostic.1 Cette circonstance de découverte est devenue extrêmement rare en Europe.
- L'ictère cholestatique, accompagné éventuellement de prurit, présent dans la moitié des cas dans les années 1980, n’est présent que chez 7 % des patients en France dans les années 2010 (données FrancEchino). Il reste une circonstance habituelle de diagnostic dans les zones hyperendémiques de Chine ou d’Asie centrale, où le recours aux soins est tardif. L’ictère est lié à l’envahissement de la convergence biliaire par le processus parasitaire, comme dans un cholangiocarcinome.1
2) Les principales complications hépatiques sont :
- L'infection des voies biliaires dilatées, avec des tableaux clinico-biologiques d’angiocholite (par mise en communication de la lésion avec les voies biliaires et/ou la migration de débris parasitaires ou de calculs pigmentaires développés en amont de la sténose parasitaire).
- L’obstruction des veines portes, avec le lent développement d’une hypertension portale, et/ou d’un cavernome portal.1
- L’obstruction des veines sus-hépatiques, avec la constitution d’un syndrome de Budd-Chiari développé progressivement.1
- Le développement d’une cavité nécrotique au centre des lésions, pseudokyste (et non pas kyste parasitaire comme dans l’échinococcose kystique),1 dont le contenu peut être le siège d’une surinfection bactérienne et/ou fongique, d’autant plus qu’elle est en communication avec les voies biliaires ; dans ce cas, le tableau clinique est celui d’un abcès du foie.1
- La cirrhose biliaire secondaire est l’aboutissement ultime de ces différentes complications.
3) Les principales complications extra-hépatiques sont liés à :
- La progression des lésions hors du foie, avec envahissement pseudo-tumoral de voisinage, est à l’origine d’une symptomatologie très diverse en fonction des organes envahis : diaphragme et poumon le plus fréquemment, péricarde et cœur, glande surrénale droite, tête du pancréas, estomac et duodénum, espaces sous-cutanés et peau abdominale antérieure (par progression des lésions le long du ligament rond), cavité péritonéale et de façon ultime pelvis et os du rachis et du bassin.
-
Des localisations métastatiques dues à une infection secondaire peuvent se produire dans une variété d'organes adjacents ou distants (poumon, cerveau, os).
-
Les localisations pulmonaires (par invasion locale ou métastases) sont identifiées dans 20 % des cas lors de l’évaluation initiale d’extension ; elles révèlent l’infection dans 5 % des cas
-
Les métastases cérébrales sont exceptionnelles (1 % des cas en Europe, mais plus fréquentes en Chine) et concernent surtout des patients ayant aussi des métastases pulmonaires.1
-
- La maladie primitive extrahépatique : elle est très rare (1 % des cas), des formes à développement uniquement extrahépatique sont possibles ; à point de départ cutané, ou rachidien, elles ont parfois pu être mises en relation avec une morsure contaminée par les œufs d’E. multilocularis après léchage de sa fourrure par un renard.1
B) L’échinococcose kystique (EK) due à E. granulosus
- L’EK évoque une pathologie tumorale dont les symptômes sont dus au développement des kystes, structures remplies de liquide qui contiennent les larves. La nature et l’ampleur des symptômes cliniques dépendent principalement du site des kystes, de leur taille et de leur évolution.
- La localisation hépatique est la plus fréquente (70 %), elle est suivie par la localisation pulmonaire (20 à 30 %), puis plus rarement par d’autres localisations (os, cœur, reins, rate, muscles, système nerveux central et yeux). 1 1 1 1
- À l’instar d’une pathologie tumorale, la croissance des kystes peut déclencher des symptômes relatifs à un effet de masse dans les organes, à une obstruction du flux sanguin ou lymphatique, ou encore à des complications telles qu'une rupture des kystes avec les infections bactériennes secondaires qui peuvent en résulter. Chez l’homme, la maladie peut être sévère et occasionnellement mortelle. 1 1
1) Localisation hépatique : la plus fréquente (filtre hépatique) = kyste hydatique (KH) du foie
- Asymptomatique le plus souvent : découverte fortuite (calcifications arciformes à l'ASP, kyste liquidien à l'échographie) à l’occasion de symptomes divers sans lien avec l'hydatidose
- Hépatomégalie bien tolérée, isolée, lisse, indolore
- Palpation d'une masse abdominale
- Survenue d'une complication (spontanément ou à l'occasion d'un traumatisme) :
- La fissuration du kyste peut entraîner une réaction allergique simple (urticaire...), fissuration (souvent biliaire)
- La rupture provoque immédiatement une anaphylaxie parfois mortel et/ou plus tardivement une dissémination secondaire (chaque scolex peut donner un nouveau kyste) locale, loco-régionale ou générale à pronostic sombre.1
- Compression des structures adjacentes, notamment biliaire.
- Surinfection bactérienne : le kyste infecté évolue comme un abcès du foie.
Manifestations allergiques : La fissuration peut entraîner une réaction allergique simple (urticaire...). En revanche, la rupture provoque immédiatement une anaphylaxie.
2) Localisation pulmonaire (deuxième filtre) = kyste hydatique du poumon
- Le plus souvent latente, découverte lors d’un examen radiologique systématique (opacités uniques ou multiples, arrondies, opaques ou hydroaériques).
- Symptomes pulmonaires non spécifiques (toux, dyspnée ....)
- Complications : fissuration dans les bronches, infection, rupture (vomique hydatique eau de roche (aspect en grains de raisins blancs sucés)).
.png/Capture%20d%E2%80%99%C3%A9cran%202020-10-06%20%C3%A0%2018_32_09(1)__800x278.png)
3) Autres localisations : très rares
Tous les organes peuvent être concernés notamment rate, os, cerveau, péritoine (formes secondaires par rupture)
a) Le kyste hydatique de la rate
-
Il peut être associé à une localisation extra- splénique, le plus souvent de siège hépatique, mais il peut être isolé.
- L'échographie, demandée pour une douleur abdominale objective une formation kystique de siège splénique.
- Le KH de la rate est une éventualité rare, mais possible en milieu d'endémie hydatique.1
b) Le kyste hydatique des muscles (1 à 3 %)
- La localisation hydatique musculaire est rare, même en pays d'endémie.
- Les muscles proximaux des membres inférieurs sont le plus fréquemment touchés.
- Le motif de consultation est une tuméfaction des parties molles augmentant progressivement de volume.
- L'échographie permet d'évoquer le diagnostic devant l'échostructure liquidienne dans un contexte épidémique, elle évite la ponction.
- Le muscle psoas est une localisation exceptionnelle.1
c) Le kyste hydatique des os (0,5 à 2,5 %)
- Il a une particularité : l’absence de limitation fibreuse et l’évolution extensive.
- La localisation vertébrale du kyste hydatique est la manifestation la plus grave et la plus fréquente de l’hydatidose osseuse (40 à 50 % des atteintes osseuses)
- Tous les étages du rachis peuvent être atteints, cependant la région dorsal est la localisation la plus fréquente (80 %) suivie par les régions lombaire (18 %), sacrée et plus rarement cervicale.1 1
- Le KH vertébral est révélé par des douleurs, des déformations rachidiennes, des tuméfactions des parties molles, des fractures, des paraplégies
- L’échinococcose vertébrale est souvent une maladie de l’enfance révélée à l’âge adulte ; ce retard diagnostique est dû au caractère lent et insidieux de la maladie.1
-
Les aspects radiologiques standard sont une atteinte du corps vertébral, avec des lacunes en «grappes de raisins».
-
Le scanner ou surtout l'IRM confirme la nature hydatique de la lésion, précise l’étendue des lésions et le degré de viabilité des vésicules.
- Le diagnostic de certitude se fait par étude anatomo-pathologique et confirmé par l’examen parasitologique du kyste.
-
L'échinococcose vertébrale est une affection de mauvais pronostic, l’exérèse chirurgicale est souvent incomplète : c'est une maladie « maligne ».1
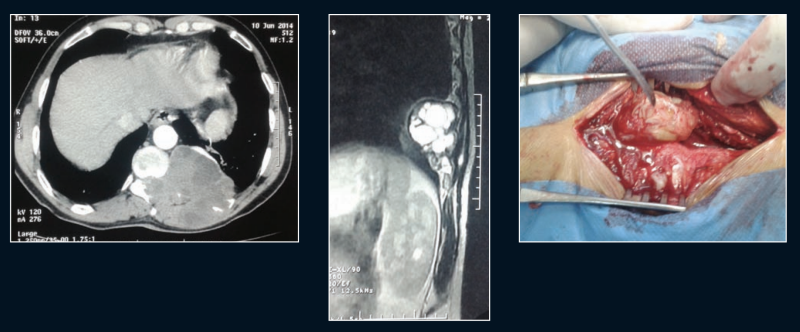
d) L’hydatidose cardiaque (< 3 %)
- Le kyste est de siège sous-péricardique ou sous-endocardique, surtout au niveau de la paroi ventriculaire gauche.
- Les risques sont la rupture dans les cavités cardiaques et la dissémination ou la rupture dans le péricarde entraînant une tamponnade.
e) L’hydatidose cérébrale (1 à 2 %)
- Elle cause des épilepsies ou une hypertension intracrânienne qui surviennent pour de petites lésions.
- Elle siège au niveau des hémisphères cérébraux, rarement dans la fosse postérieure.
EXAMENS COMPLÉMENTAIRES
A) Diagnostic de présomption des échinococcoses
- Le diagnostic de présomption des échinococcoses repose, dans un premier temps, sur les signes cliniques et sur les résultats de biologie standard telle l’hyperéosinophilie ou l’hyperleucocytose ; en cas de localisation hépatique, les signes biologiques de cholestase peuvent également être observés.
1) Biologie non spécifique :
a) L’échinococcose alvéolaire (EA) due à E. multilocularis
- Une cholestase anictérique manifestée par une élévation de la gamma-glutamyl transférase et des phosphatases alcalines peut être une circonstance diagnostique. Les autres paramètres biologiques de la fonction hépatique ne sont anormaux que dans les cas compliqués de cirrhose biliaire secondaire.
- Hyperimmunoglobulinémie polyclonale.
- Une hyperéosinophilie et une élevation des immunoglobulines (Ig) de type E totales est possible mais rare, parfois contemporaine d’une dissémination sanguine de fragments parasitaires.
- Une hyperleucocytose à polynucléaires neutrophiles et une élévation de la protéine C-réactive est un signe de surinfection bactérienne (angiocholite, surinfection bactérienne du pseudokyste nécrotique).
b) L’échinococcose kystique (EK) due à E. granulosus
- Hyperéosinophilie sanguine dans 20 à 30 % des cas : en phase d’invasion et au cours des fissuration/ruptures de kystes.
-
L’hyperleucocytose à polynucléaires neutrophiles : elle témoigne d’une surinfection bactérienne du kyste.
-
En cas de localisation hépatique, des signes biologiques de cholestase peuvent être observés.
B) Le diagnostic parasitologique
- Par examen direct ou anatomopathologie, permettant de mettre en évidence la tête du ver adulte (ou scolex) ou encore les crochets de scolex sur les prélèvements peropératoires (biopsies, liquide hydatique ou vomique hydatique = Expectoration après rupture d’un kyste dans une bronche), est présenté comme le seul diagnostic de certitude.
- Il convient de rappeler avec insistance qu’il est dangereux de ponctionner un kyste suspect en vue d’établir un diagnostic parasitologique.1 En effet, dans les deux situations cliniques (EA et EK), la ponction percutanée ou biopsie n’est qu’exceptionnellement réalisée, en raison du risque élevé de risque de dissémination parasitaire et d'anaphylaxie.1 1 1
C) Le diagnostic d'Imagerie
- Le diagnostic des échinococcoses repose essentiellement sur une combinaison d'imagerie et d’examens de biologie médicale.
- L’échographie est la technique d’imagerie à privilégier pour le diagnostic de l’échinococcose kystique et de l’échinococcose alvéolaire chez l’homme. Elle est généralement complétée ou validée par la tomodensitométrie (TDM) et/ou l’imagerie par résonance magnétique (IRM).1 1
a) L’échinococcose alvéolaire (EA) due à E. multilocularis
-
Echographie hépatique et surtout tomodensitométrie ou IRM : lésions d’allure tumorale polycycliques, confluentes, refoulant les structures biliaires et vasculaires
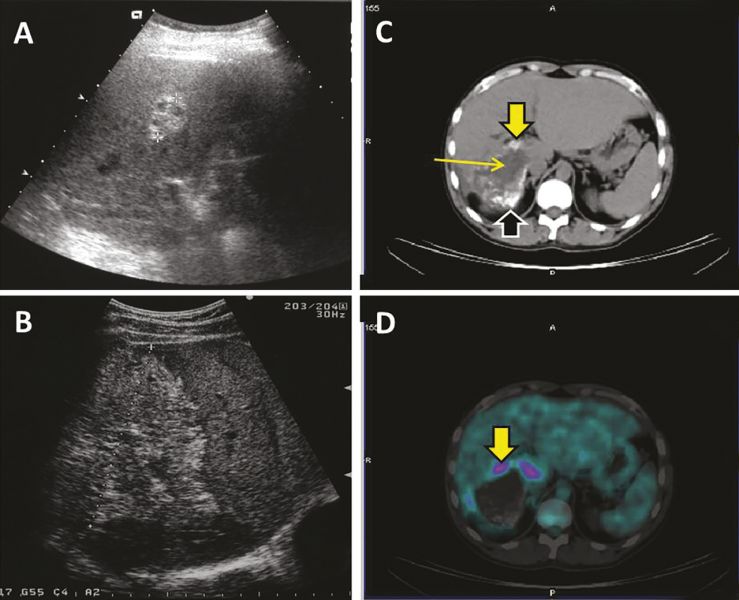
+ Echographie :
- L’aspect échographique habituel est celui d’un processus expansif intrahépatique pseudonéoplasique, d’échostructure hétérogène, à prédominance hyperéchogène, de contours irréguliers mal définis.1
- Les zones de nécrose sont généralement de siège central et d’aspect trans-sonore pseudoliquidien (fig. 4).
- Les calcifications se présentent soit sous forme d’amas nodulaire, avec cône d’ombre acoustique postérieur net, soit sous la forme d’un semis de microcalcifications.
- Dans les formes débutantes, des aspects de diagnostic différentiel plus difficile sont observés : pseudo-angiomateux hyperéchogène, pseudo-métastatique, ou pseudo-abcès du foie.
- Couplée au Doppler pulsé et couleur, l’échographie peut indiquer une compression ou un envahissement des structures vasculaires portales, sus-hépatiques et cave inférieure.
+ La tomodensitométrie (TDM) :
- La tomodensitométrie (TDM) permet de mieux apprécier le nombre, la taille et la topographie exacte de la ou des lésions.1 1
- Une classification morphologique qui décrit les différents types de lésions observés a récemment été proposée par un des centres de référence européen.1
- C’est l’examen qui permet le mieux de mettre en évidence les calcifications dont la signification semble différente selon leur type : témoins de la dégénérescence du métacestode quand elles sont macronodulaires, mais associées à des paramètres évolutifs et de viabilité du métacestode quand elles sont micronodulaires, donnant un aspect poudré.1
- Dans les formes évoluées, les lésions, le plus souvent uniques et touchant le foie droit, peuvent atteindre 10-15 cm de diamètre.
- Les lésions de diagnostic accidentel, en Europe, sont plus souvent que par le passé de petite taille (1-5 cm), et souvent multicentriques, suggérant que les lésions évoluées seraient dues à la confluence de plus petites lésions initiales (données du réseau XUUB).
- Contrairement aux tumeurs cancéreuses où le rehaussement périlésionnel est très net après injection de produit de contraste, les lésions d’échinococcose alvéolaire ne se rehaussent peu ou pas. La figure ci-dessus illustre des aspects caractéristiques d’échinococcose alvéolaire en TDM.
- Un bilan d’extension pulmonaire et cérébrale par TDM doit être réalisé avant toute décision thérapeutique.1
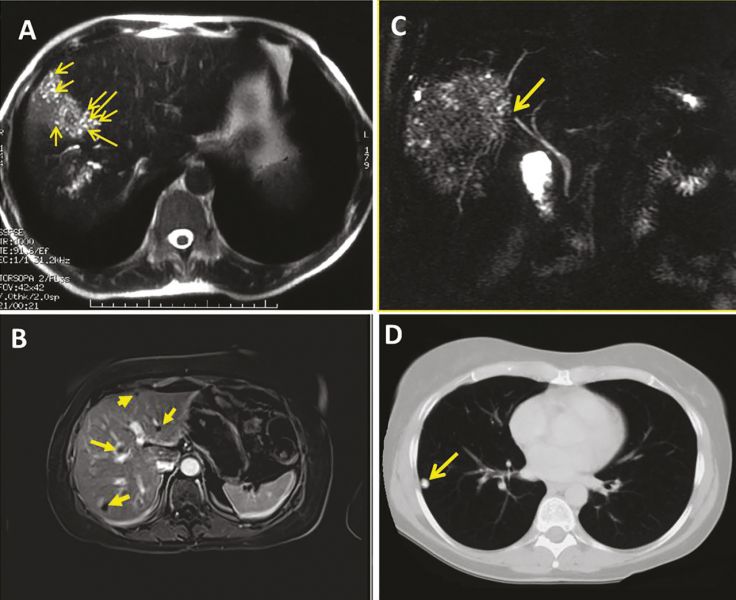
+ L’imagerie par résonance magnétique (IRM) :
- L’imagerie par résonance magnétique (IRM), qui méconnaît les calcifications, est cependant la meilleure technique pour analyser les contenus des foyers parasitaires.1 1 1
- Les multiples vésicules parasitaires, infracentimétriques, peuvent être visualisées en hypersignal en pondération T2 : l’image « en rayons de miel » ou en « grappes de raisin » est pathognomonique de l’affection. Ll’identification des microkystes est associée à l’activité métabolique des lésions.1
- L’IRM est complémentaire de la TDM pour apprécier les envahissements vasculaires en particulier cave et sus-hépatiques et l’extension de contiguïté .
- Eenfin, la cholangio-IRM est indispensable en cas de cholestase et de doute sur l’invasion ou l’obstruction des voies biliaires.
+ TEP-TDM :
- Une hyperconsommation du fluoro-désoxyglucose (FDG) à la périphérie des lésions en tomographie par émission de positons couplée à la tomodensitométrie (TEP-TDM), bien qu’en réalité associée à la réponse immunitaire de l’hôte, est considérée comme le meilleur signe d’activité métabolique du métacestode (fig. ci dessus).1 1 1
- Cependant, pour une évaluation optimale, il est indispensable d’ajouter une mesure 3 heures après l’injection du FDG aux mesures faites habituellement 1 heure après injection.1
+ Autres investigations :
- L’artériographie cœliomésentérique ou la cavographie ne sont plus nécessaires, et l’opacification des voies biliaires par ponction percutanée l’est rarement en raison du diagnostic plus fréquent de formes asymptomatiques limitées, et des performances actuelles de la TDM et de l’IRM (y compris cholangio-IRM).1
- L’opacification biliaire par cholangio-pancréatographie rétrograde endoscopique (CPRE) est la première étape d’un geste interventionnel sur des voies biliaires obstruées.1
b) L’échinococcose kystique (EK) due à E. granulosus
+ Echographie
- Le diagnostic est morphologique, basé sur l’échographie abdominale, selon la classification de GHARBI (1981) puis plus récemment la classification de l’OMS (2001) qui s'appuie sur la corrélation entre : aspect échographique/évolutivité métacestode.
- L’échographie est l’examen de première intention, généralement complétée par la TDM et/ou l’IRM, en cas de décision chirurgicale.

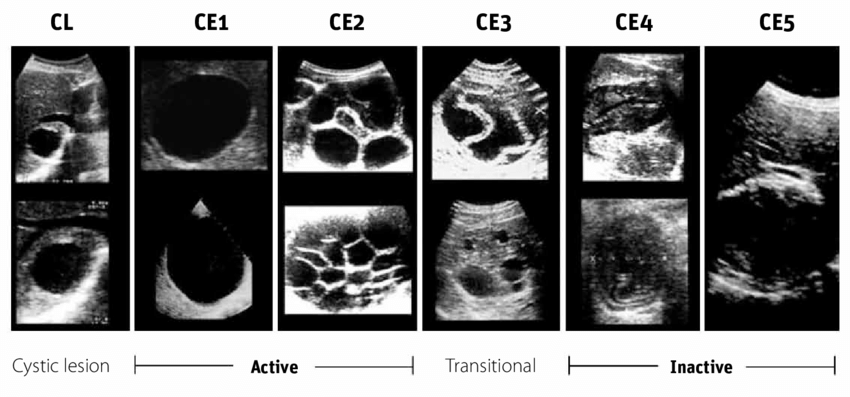
+ Comparaison avec d'autres examens d'imagerie
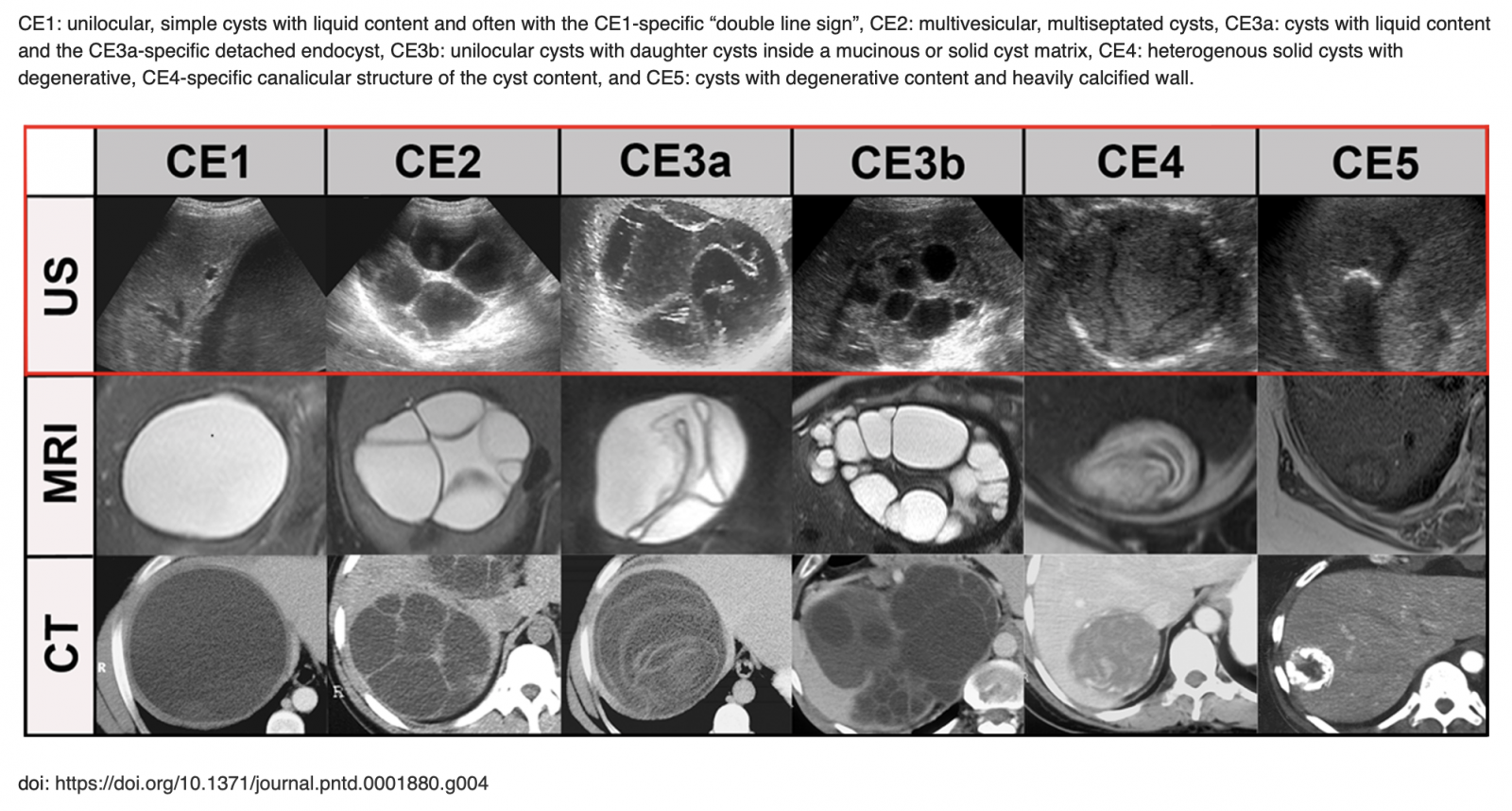
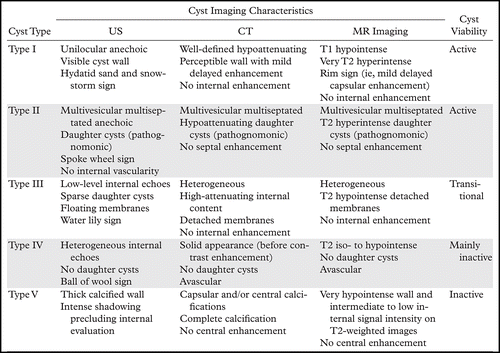
D) Le diagnostic biologique : Recherche des anticorps sériques anti-Echinococcus
- Le diagnostic sérologique des échinococcoses associe une étape initiale de recherche (dépistage), faisant appel à des tests primaires ayant une sensibilité élevée, mais pouvant être moins spécifiques, à une étape de confirmation des résultats positifs par des tests secondaires avec une spécificité élevée, mais pouvant être moins sensibles.
- Les tests secondaires sont nécessaires pour exclure la réactivité croisée dans les sérums positifs, en particulier lorsque des antigènes (Ag) d’E. granulosus ou des antigènes bruts d’E. multilocularis ont été utilisés pour le dépistage primaire d'anticorps (Ac). 1 1 1

1) Description des techniques de détection des anticorps sériques proposées
Les techniques proposées pour la version réactualisée de la NABM sont :
- pour le dépistage, l’hémagglutination indirecte (HAI) et la technique immunoenzymatique (EIA ou ELISA)
- pour la confirmation, l’immunoempreinte IE (technique du Western Blot).
a) Hémagglutination indirecte (HAI)
- Le principe d’une réaction d'agglutination est de mettre des antigènes sur un élément figuré (cellules, érythrocytes, particules, bactéries) en présence d’un sérum contenant des anticorps spécifiques agglutinants.1
- Les Ac agglutinants forment des ponts spécifiques avec les Ag particulaires et conduisent à la formation d’un réseau visible sous forme d’amas.
- Il s’agit d’une technique semi-quantitative dont le résultat est exprimé sous forme de « dilution » du sérum, à partir de laquelle un test positif est observé.
- Dans le cas du diagnostic d’Echinococcus, l’HAI utilise des globules rouges sensibilisés par un mélange d’antigènes d’E. granulosus (liquide hydatique).1
b) Technique immunoenzymatique (EIA ou ELISA)
- La technique EIA ou ELISA (Enzyme Linked ImmunoSorbent Assay) est une technique immunoenzymatique de détection qui permet de visualiser une réaction antigène-anticorps grâce à une réaction colorée produite par l’action sur un substrat d’une enzyme préalablement fixée à l’anticorps.1
- Il s’agit d’une technique quantitative dont le résultat est exprimé sous forme de « densité optique » convertie en pourcentage de positivité par rapport à des sérums témoins positif et négatif utilisés comme contrôles.
c) Immunoempreinte IE (technique du Western Blot)
- L’immunoempreinte (IE), aussi appelée Western Blot (WB), immunoblot ou immunotransfert, est une technique employée pour visualiser les anticorps dirigés contre un mélange d’antigènes ; il s’agit d’une méthode qualitative.
- Le mélange d’antigènes est soumis à une électrophorèse sur gel dans une matrice porteuse (SDS- PAGE, Native PAGE, focalisation isoélectrique, électrophorèse sur gel bidimensionnelle, etc.), afin de trier les protéines par taille, par charge, ou toute autre différence, par bandes individuelles de protéines. Les bandes de protéines séparées sont ensuite transférées vers une membrane porteuse (par ex., nitrocellulose, nylon ou polyfluorure de vinylidène (PolyVinyliDene Fluoride-PVDF)).
-
Ce procédé porte le nom de transfert, les protéines adhèrent à la membrane de la même manière qu'elles ont été séparées, en raison des interactions entre les charges. Les protéines de cet immunotransfert peuvent ensuite être utilisées pour être liées aux anticorps en vue du diagnostic. Le résultat est exprimé sous forme de « bandes » désignées par leur poids moléculaire, en relation avec une échelle de référence ; une interprétation du test est proposée à partir de la combinaison des bandes positives observées.
2) Concernant la recherche initiale (dépistage) :
- il est indiqué de réaliser simultanément deux techniques : l’ELISA (EIA) et l’HAI (hémagglutination indirecte).
- Les autres techniques : IFI (immuno- fluorescence), ELS (électrosynérèse), IDD (immunodiffusion double) et HAGG (hémagglutination sensibilisée), ne sont plus à utiliser.
a) Pour l’échinococcose alvéolaire
- Le diagnostic sérologique de l’EA associe une étape de diagnostic initial (dépistage) réalisée par des tests très sensibles, mais pouvant être non spécifiques de E. multilocularis (suivie d’une étape de confirmation réalisée avec des tests plus spécifiques).1 1
- Les techniques sérologiques qui semblent être actuellement les plus utilisées pour le dépistage de l’EA sont l’ELISA et l’HAI.1 1 1 1 1 1 1
- L’HAI utilisant un antigène d’E. granulosus, est très sensible, si on fixe la positivité à 1/80, mais elle est par définition non spécifique d’E. multilocularis ; elle constitue donc un test d’orientation qui doit être complété par l’ELISA ou le Western Blot.1
- Les ELISAs basés sur des antigènes hétérologues (fluide hydatique, E. granulosus) peuvent, au regard de l’homologie génétique qui existe entre E. granulosus et E. multilocularis, contribuer à la détection des cas d’EA, mais ce dépistage est non spécifique de l’EA, il est incapable de différencier entre les deux échinococcoses EA et EK. 1 1 1
- L’utilisation des ELISAs basés sur les antigènes purifiés d'E. multilocularis, tels que l'antigène Em2, l'antigène Em18, l'Em alkaline phosphatase, les antigènes recombinants II/3-10 et Em10 ou l’antigène purifié Em2-Plus, permet d’obtenir une meilleure sensibilité diagnostique avec plus de 95 % des cas d’EA qui peuvent être détectés.1 1 1 1 1 L’ELISA Em2-plus semble être le seul test actuellement commercialisé ; il associe l’antigène polysaccharidique Em2 (extrait de métacestodes d’E. multilocularis) à l’antigène recombinant Em18 (antigène voisin de EmII/3-10 et de Em10), sécrété par la membrane germinative et les protoscolex.
- En cas de suspicion d’EA sur les données d’imagerie, réaliser une recherche sérologique initiale avec une HAI utilisant un Ag d’E. granulosus et un ELISA utilisant un Ag d’E. multilocularis ; l’utilisation combinée de l’HAI et d’un ELISA avec un antigène E. multilocularis (ELISA Em2 PLUS ou L’ELISA Rec Em18) permet d’augmenter la sensibilité à 96 %.
.png/Capture%20d%E2%80%99%C3%A9cran%202020-09-29%20%C3%A0%2016_02_49(1)__800x420.png)
b) Pour l’échinococcose kystique
- Le diagnostic sérologique de l’EK est plus complexe et moins fiable que celui de l’EA. Il est associé à un manque de standardisation des techniques, à un manque de sensibilité, ainsi qu’à une réactivité croisée avec des antigènes d'autres parasites (cestodes (E. multilocularis et Taenia solium), par certaines helminthiases) ou avec des maladies non parasitaires (tumeurs malignes, cirrhose).1 1 1 1 1 1
- La sensibilité de ces différents tests sérologiques dépend de plusieurs facteurs. Ceux-ci pouvant être d’ordre technique comme la qualité de la préparation antigénique, ou inhérents au patient, tels que la variabilité interindividuelle de réponse immunologique ou le stade de développement des kystes, leur site, leur nombre... Les tests qui semblent néanmoins être recommandés à l’heure actuelle au regard de leur sensibilité sont : l’ELISA et l'HAI.1 1 1 1 1 1
- L'IgG-ELISA qui présente des valeurs de sensibilité comprises entre 83 et 96 % selon les organes est considéré comme l'un des tests les plus sensibles pour détecter les anticorps contre E. granulosus.1 1
- L’hémagglutination indirecte (HAI), dont la sensibilité est comprise entre 57 et 90 % selon les organes, est moins spécifique et n’a de valeur qu’une fois associée à d'autres tests tels que l’ELISA ou l'IE.1 1
- Il faut réaliser une recherche sérologique initiale avec l’HAI Ag E. granulosus et l’ELISA Ag E. granulosus. En effet, la sensibilité de l’HAI pour l’EK est inférieure à celle de l’EA (80 % pour les kystes hépatiques, 50-60 % pour les kystes pulmonaires et 90-100 % pour les kystes à organes multiples).1 L’utilisation concomitante des deux techniques (HAI et ELISA) avec un Ag d’E. granulosus permet d’atteindre des taux de sensibilité diagnostique allant de 85 à 96 %. 1 1 1
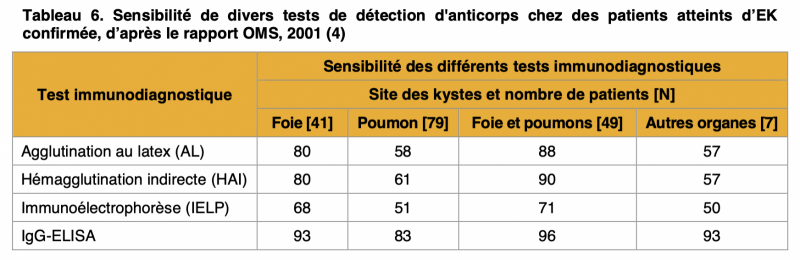
3) Concernant la confirmation du diagnostic :
-
Une recherche initiale positive (de l’ELISA/EIA et/ou de l’HAI) doit systématiquement être confirmée par immunoempreinte (IE/Western Blot) pour les deux échinococcoses EA et EK. Les autres techniques, coélectrosynérèse (COES) et d’immunoélectrophorèse (IELP) ne sont plus à utiliser.
- En se référant au dernier consensus d’experts européen publié en 20101, le CNR-E considère que l’IE constitue également une technique très sensible pour la recherche initiale. Ce test, selon le CNR-E est à réaliser si les données cliniques et radiologiques sont évocatrices d’une échinococcose (notamment pour l’EK de diagnostic plus difficile) et que les tests de dépistages habituels (HAI et ELISA) sont négatifs.
- L’IE est réalisée sur le même échantillon que la recherche initiale et il n’est pas nécessaire de réaliser un nouveau prélèvement.
-
Concernant le test d’IE actuellement commercialisé, il permettrait, selon les experts du CNR-E, d’identifier, pour chacune des deux espèces d’échinococcoses, des bandes spécifiques. Trois bandes de bas poids moléculaire (BPM) 7, 26 et 28 kDa sont communes à E. granulosus et E. multilocularis, deux bandes individualisées de 16 et 18 kDa spécifiques d’E. multilocularis et une bande de 17 kDa spécifique d’E. granulosus.1
-
L’IE est très spécifique et permettrait un diagnostic différentiel entre EA et EK de l’ordre de 90 %.
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
ÉTIOLOGIE
Votre texte ici
COMPLICATIONS
Votre texte ici
PRISE EN CHARGE THÉRAPEUTIQUE
L’échinococcose kystique et l’échinococcose alvéolaire sont toutes deux souvent coûteuses et compliquées à traiter, nécessitant parfois une intervention chirurgicale lourde et/ou un traitement médicamenteux prolongé.
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
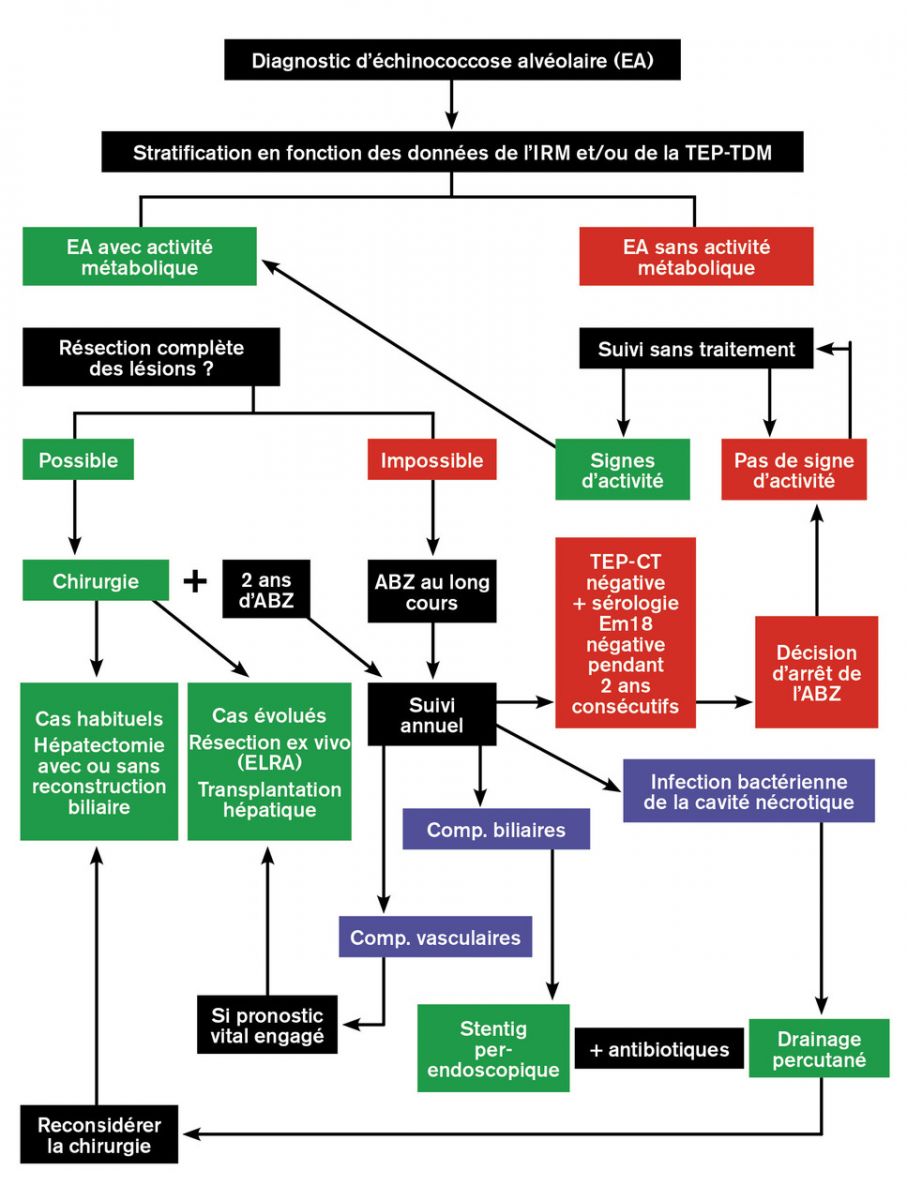
D'après des recommandations internationales, le traitement de l’échinococcose alvéolaire confirmée et métaboliquement active repose sur le traitement antiparasitaire par albendazole au long cours, associé à une résection complète des lésions lorsque cela est possible, sur des données anatomiques évaluées par l’imagerie, en fonction de l’âge et de l’état clinique du patient.1 Les interventions palliatives qui ne résèquent pas la totalité des lésions, génératrices de complications postopératoires à répétition, sont désormais proscrites.1
1) Traitement antiparasitaire : Albendazole
- Albendazole : la dose est de 15 mg/kg/24h lors d’un repas riche en graisses pour améliorer sa biodisponibilité.
- Le traitement médicamenteux à l’albendazole est pris, quelle que soit l’option thérapeutique : 1 1 1
- soit après une ablation chirurgicale considérée par comme « complète » avec une marge de sécurité de 0,5 cm et maintenu durant au moins deux ans afin d’éviter la poursuite de la maladie parasitaire.1
- Il est administré en principe à vie chez tous les autres patients (lésion est inextricable...).1 1 1 1
- En France, l’albendazole dans sa formulation adaptée au traitement des échinococcoses (Eskazole) est dispensé par les pharmacies hospitalières.
- Effets indésirables : alopécie mais surtout hépatite cytolytique et leucopénie, plus fréquents en cas de cholestase et/ou d’hypertension portale, et peut-être aussi chez les immunodéprimés,1 nécessitent un suivi de l’hémogramme et des transaminases au cours des premières semaines de traitement, puis tous les 3 mois.1
- Les variabilités interindividuelles de pharmacocinétique de l’albendazole et les possibles interférences (avec des médicaments mais aussi avec le tabac, le cannabis, et d’autres xénobiotiques des plantes…) justifient un suivi pharmacologique par dosage de l’albendazole sulfoxide, réalisé en France par le CNR-échinococcoses, et à la disposition des médecins qui en font la demande.1 1 Ces dosages permettent un ajustement des doses, pour une efficacité optimale.
- Un arrêt du traitement peut être tenté après plusieurs années d’administration à dose utile. Dans l’état actuel des connaissances et faute d’une étude prospective contrôlée sur un nombre adéquat de patients, il ne peut se faire que sur la base d’une double négativité pendant 2 ans : celle de la TEP-TDM et celle de la sérologie spécifique d’E. multilocularis, l’antigène de détection le plus adapté au suivi en ELISA étant la protéine recombinante Em18, qui semble témoin de la viabilité parasitaire.1 1 1
- Le suivi des patients atteints d’échinococcose alvéolaire, traités ou non, demeure cependant une obligation à vie, car des reprises évolutives ont été décrites plusieurs années après une intervention chirurgicale ou un arrêt de l’albendazole ; l’immunosuppression peut être une circonstance de récidive.1 1
2) Traitement Chirurgical
- La résection chirurgicale à visée curative, possible dans 30 à 40 % des cas, est réalisée par différents types d’hépatectomie conventionnelle de la chirurgie hépatobiliaire, avec ou sans reconstruction de la voie biliaire et des vaisseaux porte, sus-hépatiques et/ou cave inférieur en fonction des données anatomiques.1 Elle est représente comme le traitement chirurgical de choix.1 1
- La transplantation hépatique est devenue une indication d’exception pour l’échinococcose alvéolaire, en raison du type de cas d’échinococcose alvéolaire diagnostiqués en Europe actuellement, et en raison du risque lié à l’immunosuppression thérapeutique (qui évite le rejet du foie mais favorise la récidive dans le greffon ou les métastases à distance).1 1 Dans certaines formes très évoluées, elle permet une survie très acceptable (plus de 30 ans chez des patients transplantés dans les années 1980), au prix d’un traitement continu par albendazole, indispensable.1
- Pour pallier la nécessité de recourir à la transplantation hépatique, la technique ELRA (ex vivo liver resection and auto-transplantation), qui consiste à effectuer les différents gestes de résection hépatique et de reconstruction biliaire et vasculaire en dehors du corps du patient, puis à réimplanter le foie, a été développée par les chirurgiens chinois, avec des résultats très satisfaisants (sur plus de 100 patients) dans les mêmes situations de « sauvetage » que la transplantation allogénique.1 L’applicabilité de cette technique à la situation européenne est sujet à débat.1
3) Traitement par radiologie interventionnelle
Elles permettent habituellement le traitement des complications infectieuses bactériennes et biliaires sans recourir à la chirurgie :1
- drainage transhépatique transcutané pour les infections du pseudokyste formé par la nécrose au centre des lésions évoluées.
- drainage biliaire perendoscopique par l’insertion de plusieurs stents plastiques après lavage extensif de la voie biliaire en cas d’obstruction.1
Un traitement antibiotique adapté s’impose dans tous ces cas. L’intérêt d’une administration au long cours d’acide ursodésoxycholique dans les cas de cholestase chronique et/ou après un geste interventionnel reste encore débattu.1 1
B) L’échinococcose kystique (EK) due à E. granulosus
Il existe 4 options thérapeutiques pour traiter l’échinococcose kystique :
- la chirurgie : exérèse complète du/des kystes chaque fois que possible (possibilité à terme de complications). Précautions ++ pour éviter tout essaimage parasitaire au cours de l’intervention (imprégnation des champs de solution salée hypertonique)
- le traitement percutané des kystes hydatiques par la technique PAIR (ponction, aspiration, injection, réaspiration) sous contrôle échographique. Alternative moins invasive à la chirurgie conventionnelle. Utilisation d'éthanol à 70-95 %. Non utilisée en dehors des pays d'endémie.
- le traitement médicamenteux antiparasitaire (albendazole) : 15 mg/kg/24h (maximum 800 mg/24h ; surveiller les ALAT) : encadrer le geste opératoire (1 mois avant et après) pour éviter l’essaimage parasitaire. Dans certains cas : rupture pré ou per-opératoire, patients ne pouvant être opérés : traitement prolongé, par cures de 1 mois espacées d'1 mois ou en continu, pendant plusieurs mois voire à vie dans certains cas d’échinococcose secondaire. Nitazoxanide (ATU nominative) : si échec de la chirurgie ou patient inopérable et échec, intolérance ou contre-indication à albendazole + praziquantel
- la surveillance.
Afin de faciliter la prise de décision thérapeutique, les experts du groupe de travail de l'OMS dédié aux échinococcoses (WHO-IWGE9) ont suggéré une approche spécifique pour l'EK non compliquée du foie. Celle-ci tient compte de plusieurs facteurs qui déterminent la modalité de prise en charge thérapeutique, notamment le type de kyste (selon la classification de l’OMS), sa taille, son emplacement ainsi que la présence ou l’absence de complications. Une expérience clinique spécifique est nécessaire pour la réalisation des traitements, les patients sont référés à des centres reconnus, de référence nationale ou régionale.1 1
Selon l’Organisation mondiale de la santé (OMS), seule la chirurgie a le potentiel d’enlever les kystes de E. granulosus et de mener à la guérison complète, le taux de succès étant de l’ordre de 90 %, si le kyste ne présente pas une localisation à risque ou si la maladie n'est pas trop avancée. Néanmoins, la chirurgie peut être impraticable chez les patients atteints de plusieurs kystes localisés dans plusieurs organes et chez les patients avec un risque chirurgical élevé. L'introduction du traitement médicamenteux et de la technique PAIR peut constituer une alternative pour ces patients.1
ÉVOLUTION/PRONOSTIC
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
- Maladie mortelle dans 95 % des cas dans les 5 ans après le diagnostic dans les années 1980, l’échinococcose alvéolaire est devenue une maladie chronique, avec un traitement efficace et un suivi contraignant, mortelle dans moins de 5 % des cas.
- La courbe de survie des patients rejoint celle de la population générale en Europe. 1 1 1
- La parasitose reste cependant très préoccupante dans les zones d’endémie où l’accès aux soins est moins favorable.1
PRÉVENTION
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
- La prévention de l’échinococcose alvéolaire est difficile car le cycle du parasite se déroule majoritairement dans la nature.
- Le chauffage et a fortiori la cuisson des aliments potentiellement contaminés détruisent les œufs, mais la congélation est sans effet.
- La prévention au plan individuel impose des précautions dans les contacts avec les carnivores, hôtes définitifs (ne jamais toucher un renard à mains nues), la protection des jardins potagers dont on sait maintenant qu’ils peuvent être infectés par des fèces de carnivores contaminants, y compris de chats et de chiens,1 1 1 1 et les mesures générales d’hygiène comme le lavage des mains et le rinçage des aliments consommés crus (éviter de consommer crus des baies sauvages, et des légumes ou fruits tombés provenant de jardins et vergers non clos pouvant être contaminés par des renards ou des chiens parasités).
- En cas de doute sur une contamination éventuelle, en particulier en contexte professionnel, une échographie hépatique et une sérologie sont recommandées dans un délai de 2 ans.
B) L’échinococcose kystique (EK) due à E. granulosus
- En zone d’endémie : pâturages clôturés, contrôle vétérinaire en abattoir des moutons abattus, élimination des viscères parasités, traitement des chiens errants/domestiques
- Sur un plan individuel : lavage des mains, lavage des légumes, éviter la promiscuité avec les chiens susceptibles d’être parasités.
SURVEILLANCE
A) Réseau
- Depuis 2003, la surveillance de l’EA est assurée en France via le réseau FrancEchino qui fonctionne depuis 2012 sous l’égide du Centre national de référence de l’échinococcose alvéolaire (CNR-EA) au CHRU de Besançon. Le périmètre du CNR a été étendu aux deux types d’échinococcoses pour le mandat 2017-2021, il devient désormais Centre national de référence échinococcoses (CNR-E).1
- Le réseau XUUB est constitué de deux centres de référence chinois, à Urumqi, région autonome du Xinjiang, et Xining, province du Qinghai, Chine, et de deux centres de référence européens, Besançon, Bourgogne-Franche-Comté, France, et Ulm, Baden Württemberg, Allemagne.
B) Suivi des patients traités :
-
Concernant le suivi des patients traités : il est réalisé par une technique EIA, associée ou non à une technique HAI en fonction des patients et des traitements. Ce suivi comporte un examen itératif du sérum ayant servi à la recherche initiale. Le suivi est réalisé une à deux fois par an.
-
Dans la nouvelle formulation de la nomenclature, il est indiqué que les tests à utiliser doivent être quantitatifs, mais les techniques ne sont pas précisées. Si l’utilité de cet examen semble être discutée dans la littérature analysée, les techniques quantitatives qui sont néanmoins mentionnés sont les suivantes :
-
pour l’EA : l’ELISA basé sur l’antigène recombinant Em18 serait plus utile pour le suivi des patients traités par albendazole au long cours car les anticorps anti-Em18 sont corrélés à l’activité et à la viabilité parasitaire ;
-
pour l’EK : l’ELISA serait approprié pour surveiller les progrès de la maladie.
-
- Selon le CNR, l’HAI présente un intérêt pour la détection précoce des récidives. Sa négativation est un élément important d’aide à la décision d’arrêt de l’albendazole chez certains patients (immunodéprimés, faible réactivité contre les antigènes spécifiques d’E. multilocularis...). Un grand nombre de patients atteints d’EA est suivi également par HAI jusqu’à négativation.
Le CNR a précisé la stratégie de suivi pour les deux échinococcoses EA et EK, dans deux situations cliniques différentes :
1) Patients sans intervention radicale
- Pour l’EA, le suivi est réalisé à l’aide d’une technique ELISA utilisant un antigène recombinant Em18 plus performant que l’antigène Em2plus pour évaluer la viabilité parasitaire et différentier entre les lésions actives, inactives ou abortives.
- Pour l’EK, pour le suivi des cas n’ayant pas eu d’ablation radicale du/des kystes, il serait légitime d’utiliser un ELISA utilisant des antigènes spécifiques d’E. granulosus (AgB en particulier). Le CNR précise qu’il n’existe pas actuellement de kit commercial utilisant ces préparations antigéniques purifiées ou recombinantes. À défaut, le suivi est réalisé avec un ELISA E. granulosus standard.
2) Patients avec intervention radicale
- Le CNR indique que dans sa pratique, la technique HAI est également utilisée pour le suivi, car l’utilisation d’un antigène hétérologue (commun à E. granulosus et à E. multilocularis) permet une détection plus précoce des récidives, lorsque le kyste dans l’EK ou les lésions dans l’EA ont fait l’objet d’une ablation jugée « radicale » par le chirurgien.
- En effet, les anticorps dirigés contre les antigènes « partagés » sont détectés les premiers, en particulier lors de récidive chez les patients transplantés. Un suivi par HAI peut également rendre service chez les patients immunodéprimés qui n’expriment que des anticorps contre les antigènes « partagés ».
THÉRAPIES FUTURES
A) L’échinococcose alvéolaire (EA) due à E. multilocularis
- Les pistes thérapeutiques incluent l’utilisation de l’immunothérapie associée à l’albendazole ; une observation clinique et des études expérimentales avaient montré l’intérêt possible de l’interféron alpha-2a ; des études plus récentes se sont intéressées à l’intervention sur les « check-points » dans les réponses immunitaires, déjà développée en cancérologie, comme celle ciblant les systèmes PD-1/PD-L1 (programmed cell death protein-1/PD-ligand 1) ou TIGIT (T-cell immunoreceptor with immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain) ; des études cliniques de phase I-II devraient être initiées dans un proche avenir.1 1 1
- Des études prospectives sont requises pour mieux définir l’intérêt de la chirurgie dans les circonstances actuelles de diagnostic en Europe, et les modalités d’un éventuel arrêt du traitement au long cours par albendazole. 1
CAS PARTICULIERS
A) Particularités de l’échinococcose alvéolaire chez les patients immunodéprimés.
- La sensibilité du métacestode d’E. multilocularis à l’immunosuppression est bien démontrée expérimentalement . A contrario, l’homme est un hôte naturellement résistant au développement larvaire.
- Depuis le début du xxie siècle, une augmentation significative des cas d’échinococcose alvéolaire observés chez des patients immunodéprimés a pu être constatée.1 1
- Il s’agit surtout de patients recevant un traitement immunosuppresseur après une transplantation ou pour un cancer, une hémopathie maligne, ou une maladie inflammatoire chronique. Parmi ces traitements figurent aussi des biothérapies, en particulier les anti-tumor necrosis factor alpha (anti-TNF-α).
- L’échinococcose alvéolaire se comporte donc comme une infection opportuniste, particulièrement insidieuse car elle est découverte généralement lors des examens morphologiques de suivi de l’affection traitée par immunosuppresseur, et les lésions, récemment évolutives, peuvent mimer les lésions tumorales dont on effectue le suivi (formes pseudo-métastatiques, « tumeurs » positives en TEP-TDM…), et entraîner retard diagnostique et erreurs thérapeutiques.1
- L’immunosuppression est aussi à l’origine d’une évolution rapide des lésions, avec parfois des douleurs hépatiques aiguës.
- L’absence d’anticorps détectables et donc l’observation de sérologies négatives dans près de 15 % des cas complique le diagnostic, qui repose alors sur les aspects pathognomoniques à l’IRM et l’identification du parasite par biologie moléculaire.1 1
