Insuffisance cardiaque chronique de l'adulte

INTRODUCTION/GÉNÉRALITÉ
A) Définition
L’insuffisance cardiaque (IC) est un syndrome clinique où les patients présentent les caractéristiques suivantes (ESC, 2008) :
- Des symptômes (dyspnée, fatigue)
- et des signes physiques caractéristiques d’insuffisance cardiaque (tachycardie, polypnée, râles crépitants pulmonaires, épanchement pleural, turgescence jugulaire, œdèmes périphériques, hépatomégalie)
- et une preuve objective d’une anomalie cardiaque structurelle ou fonctionnelle du cœur au repos (cardiomégalie, 3e bruit cardiaque, souffle cardiaque, anomalie à l’échocardiogramme, élévation du dosage des peptides natriurétiques).
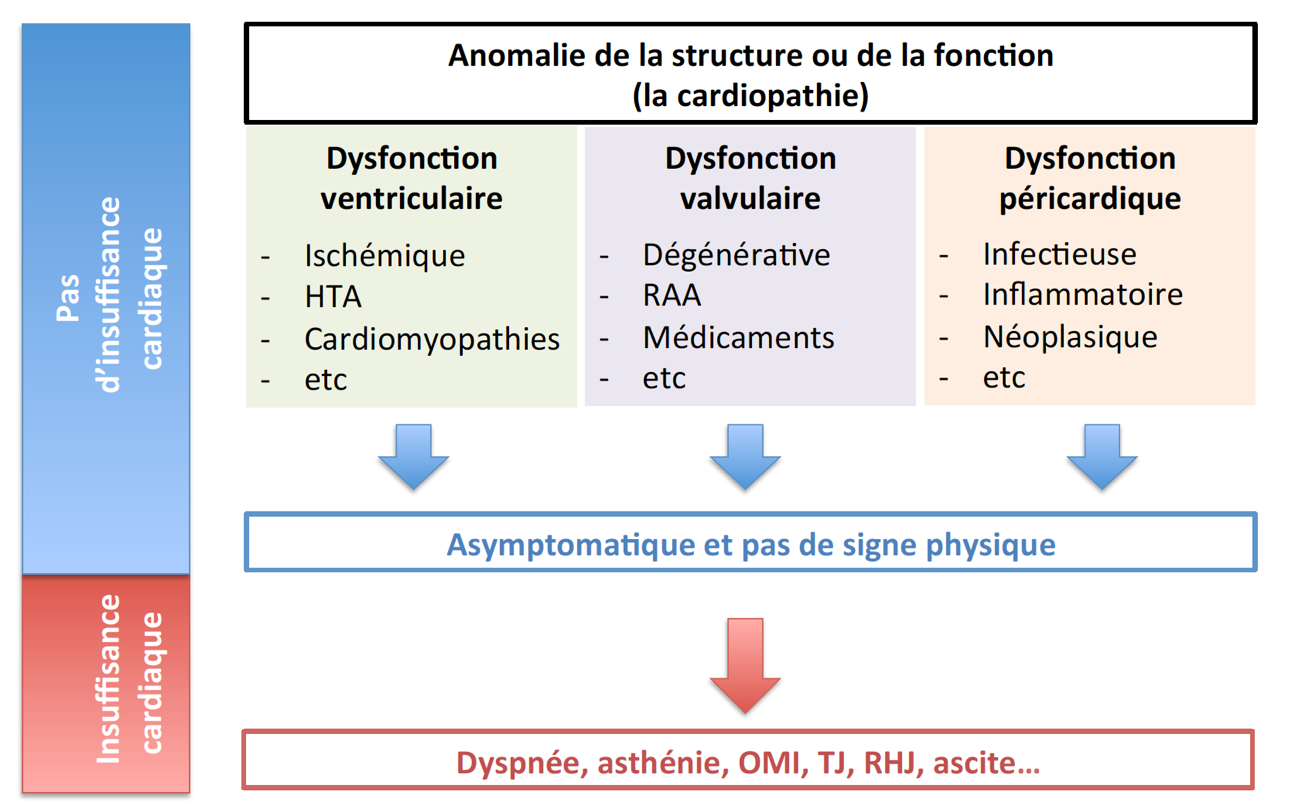
- À l’échocardiographie, une FE < 40 - 50 % affirme l’IC systolique (ICS).
- Sinon, des critères de trouble de la relaxation et de dysfonction diastolique précis doivent être mesurés par un échographiste expérimenté pour affirmer l’insuffisance cardiaque à fraction d’éjection préservée (ICFEP).1
HISTORIQUE
Votre texte ici
PHYSIOPATHOLOGIE
A) Déterminants du débit cardiaque
Le débit cardiaque est le produit du volume d’éjection systolique (volume de sang éjecté lors de chaque systole) par la fréquence cardiaque : DC = VES x FC
Ses trois principaux déterminants sont :
- la précharge correspondant au volume télédiastolique du ventricule gauche. Elle dépend de la volémie ainsi que du tonus veineux ;
- la contractilité du myocarde (inotropisme) : force de contraction « intrinsèque » du myocarde indépendante des conditions de charge ;
- la post-charge : forces s’opposant à l’éjection du ventricule en systole, c’est-à-dire essentiellement la pression systémique pour le ventricule gauche et la pression artérielle pulmonaire pour le ventricule droit.
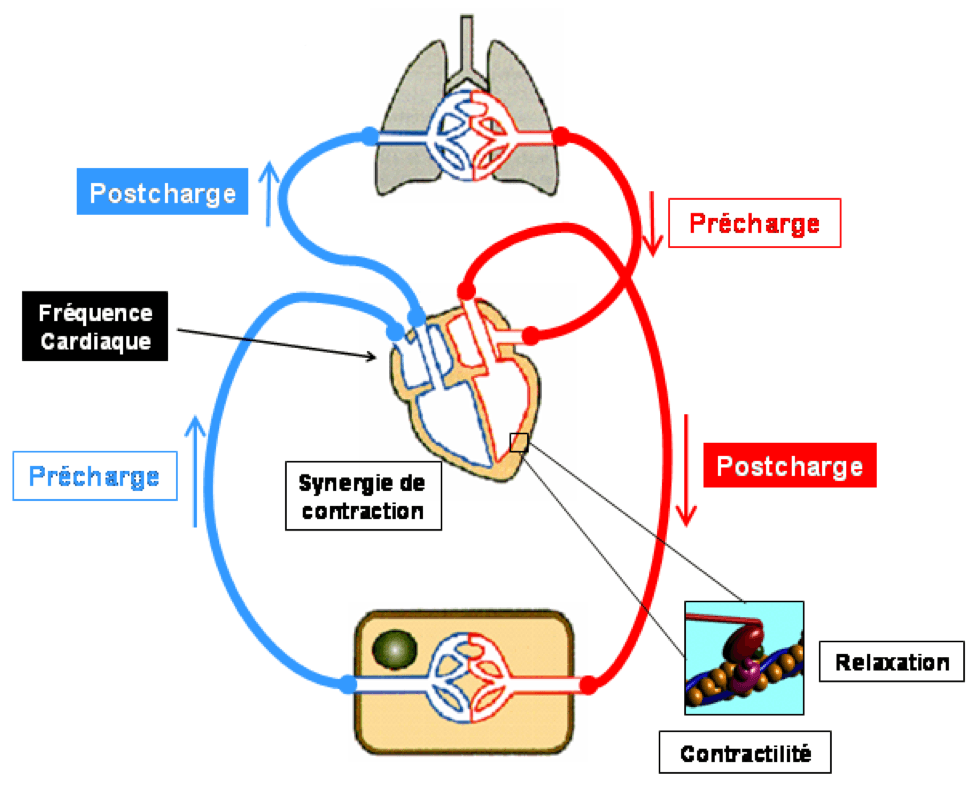
B) Mécanismes d’apparition des symptômes
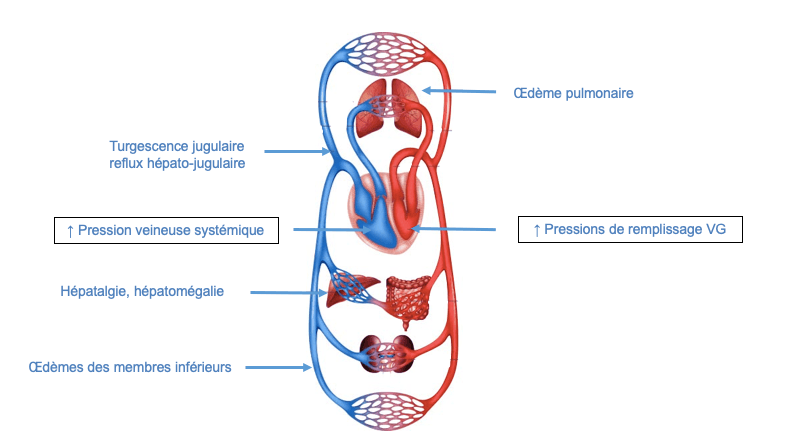
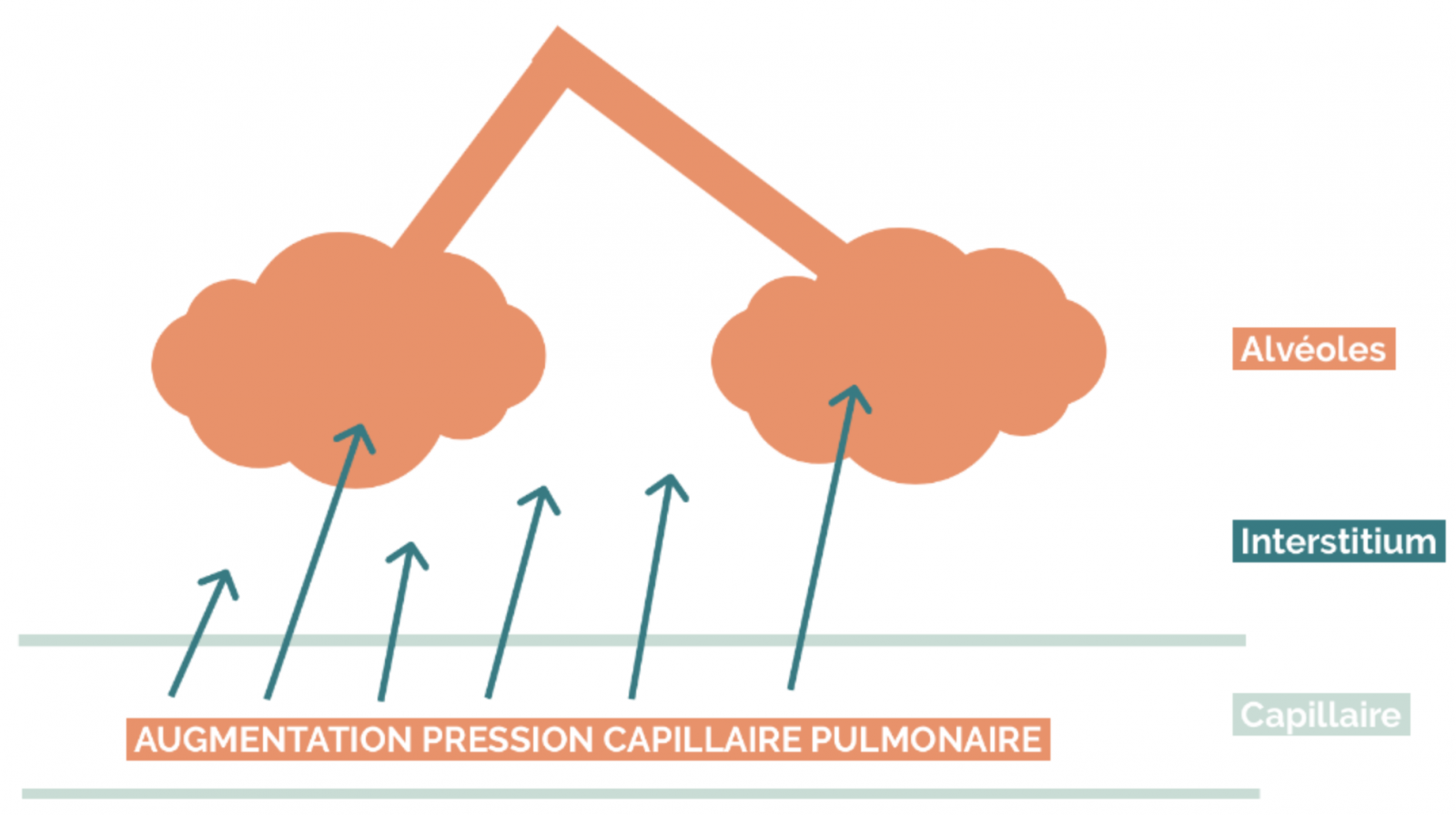
- La symptomatologie de l’insuffisance cardiaque est liée à l’augmentation de pression « en amont » responsable de signes congestifs, et à la diminution du débit « en aval » responsable de signes d’hypoperfusion.
C) Retentissement en amont : signes congestifs
D) Mécanismes compensateurs
- En cas de dysfonctionnement cardiaque, l’organisme va réagir en mettant en jeu un certain nombre de mécanismes compensateurs.
- Tous ces mécanismes compensateurs sont bénéfiques à court terme car ils ont pour objet de maintenir le débit cardiaque et les pressions de perfusion des différents organes
- Mais leurs effets sont le plus souvent délétères à long terme car ils contribuent à augmenter le travail et la consommation en oxygène du cœur.
- On distingue des mécanismes compensateurs cardiaques et extracardiaques.
1) Mécanismes compensateurs cardiaques
Le remodelage cardiaque se définit comme les changements de la géométrie des cavités cardiaques :
a) La dilatation ventriculaire :
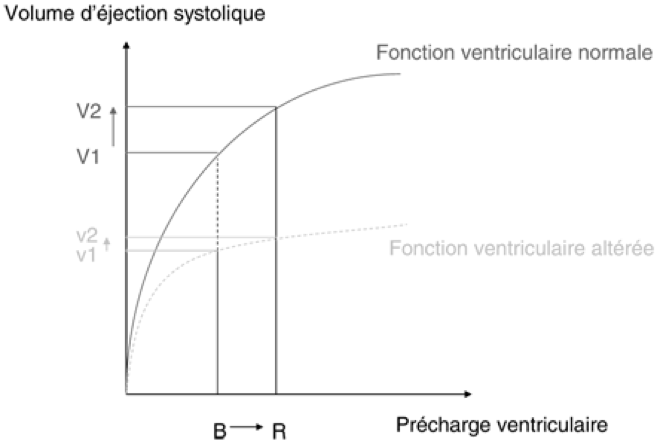
- En cas d’altération de la fraction d’éjection, le volume télésystolique (volume résiduel après l’éjection ventriculaire) est augmenté. Lors de la diastole suivante, la pression télédiastolique va avoir tendance à augmenter, d’où une augmentation de la contrainte sur les parois, qui va progressivement contribuer à augmenter le volume télédiastolique (remodelage ou hypertrophie excentrique).
- Cette dilatation ventriculaire est un processus très important dans la compensation. (ex: si un volume télédiastolique passe de 100 mL à 200 mL lorsque la FEVG chute de 60 % à 30 %, le volume d’éjection ventriculaire reste conservé à 60 mL).
- Effet délétère : augmentation de la contrainte pariétale (proportionnelle au rayon de la cavité).
b) L hypertrophie des parois pour faire face à une augmentation de pression systolique (ex : HTA, sténose aortique) :
- L’augmentation de l’épaisseur des parois permet de normaliser la contrainte de la paroi ventriculaire selon la loi de Laplace (hypertrophie concentrique) : contrainte = P développée × rayon de la cavité/épaisseur.
- Effet délétère : augmentation du travail cardiaque et augmentation de la rigidité des parois.
- Selon la loi de Starling, l’étirement des fibres lié à l’augmentation de la pression au moment du remplissage cardiaque (précharge) s’accompagne d’une augmentation de l’inotropie du ventricule jusqu’à une certaine limite de dilatation.
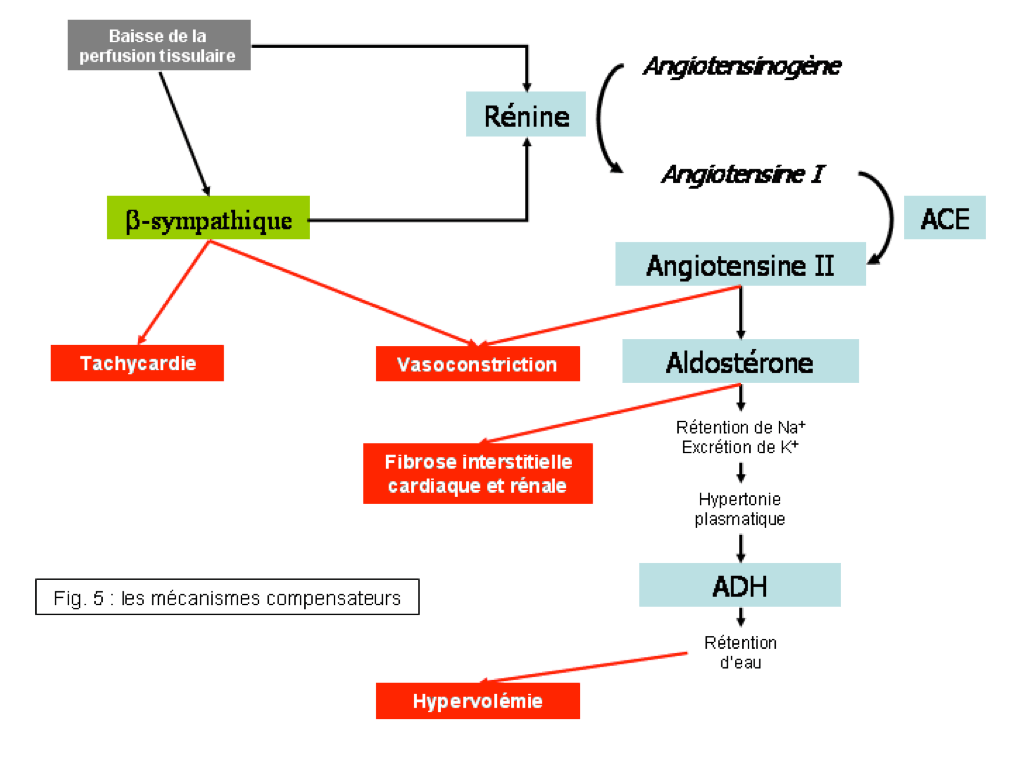
- La tachycardie sous la dépendance de l’activation du système sympathique contribue également à maintenir le débit cardiaque (DC = VES ×FC). Cela s’accompagne d’un effet délétère par augmentation du travail cardiaque et de la consommation en oxygène du cœur.
2) Mécanismes compensateurs extracardiaques
a) La vasoconstriction :
- En réponse à l’activation du système sympathique et du système rénine angiotensine
- Contribue à maintenir une pression de perfusion. Elle épargne certains territoires (circulation cérébrale et coronaire) aux dépens d’autres (cutanés, muscles, rate, rein…)
- Effet délétère : augmentation du travail cardiaque.
b) La rétention hydrosodée :
- Liée à la baisse de la perfusion rénale et à la diminution de l’excrétion sodée (liée à l’activation du système rénine angiotensine).
- Contribue à augmenter le volume circulant et à augmenter la précharge (loi de Starling).
- Effet délétère : signes congestifs cliniques (œdèmes, épanchements…).
c) L’ activation neurohormonale :
- De nombreux systèmes neurohormonaux sont activés mais les plus importants sont le système sympathique et le système rénine angiotensine aldostérone avec les conséquences déjà vues.
- Effets délétères : augmentation du travail cardiaque, effets proarythmiques, effets toxiques directs des catécholamines sur les myocytes…
3) Mécanismes adaptatifs neurohormonaux
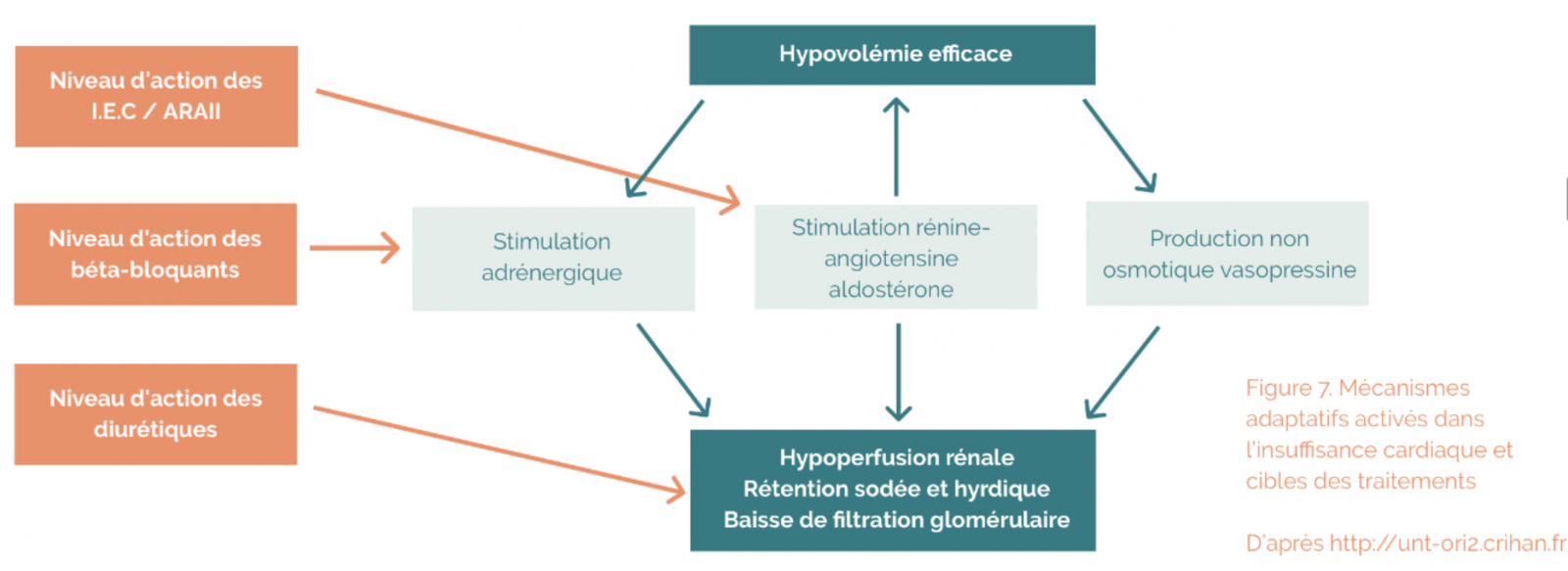
a) Stimulation sympathique
- Effets inotrope et chronotrope positifs, vasoconstriction périphérique permettant une redistribution vasculaire aux organes nobles (cerveau, cœur)
- Mais augmentation de la post-charge et du travail cardiaque
b) Stimulation du système rénine-angiotensine-aldostérone
- Rétention hydrosodée qui contribue à l’apparition de signes congestifs
- Vasoconstriction qui contribue à l’augmentation de la post-charge et donc du travail cardiaque.
Classification
A) Insuffisance cardiaque à FE altérée/préservée


1) Insuffisance cardiaque à FEVG préservée
- L’insuffisance cardiaque à fonction systolique préservée (également parfois appelée insuffisance cardiaque diastolique) correspond à la présence de symptômes et signes d’insuffisance cardiaque malgré la présence d’une fraction d’éjection du ventricule gauche normale ou subnormale avec FEVG ≥ 50%.
- Elle représente environ 50% des patients atteints d’insuffisance cardiaque, c’est la forme clinique la plus fréquente chez les sujets âgés et les femmes.
- Elle semble être favorisée par l’hypertension artérielle et/ou une hypertrophie du ventricule gauche, plus rarement un diabète.
- L’échocardiographie permet d’en faire le diagnostic en mettant en évidence une fraction d’éjection du ventricule gauche normale ou subnormale et en retrouvant des critères en faveur d’une élévation des pressions de remplissage du ventricule gauche.
B) Insuffisance cardiaque aiguë / chronique
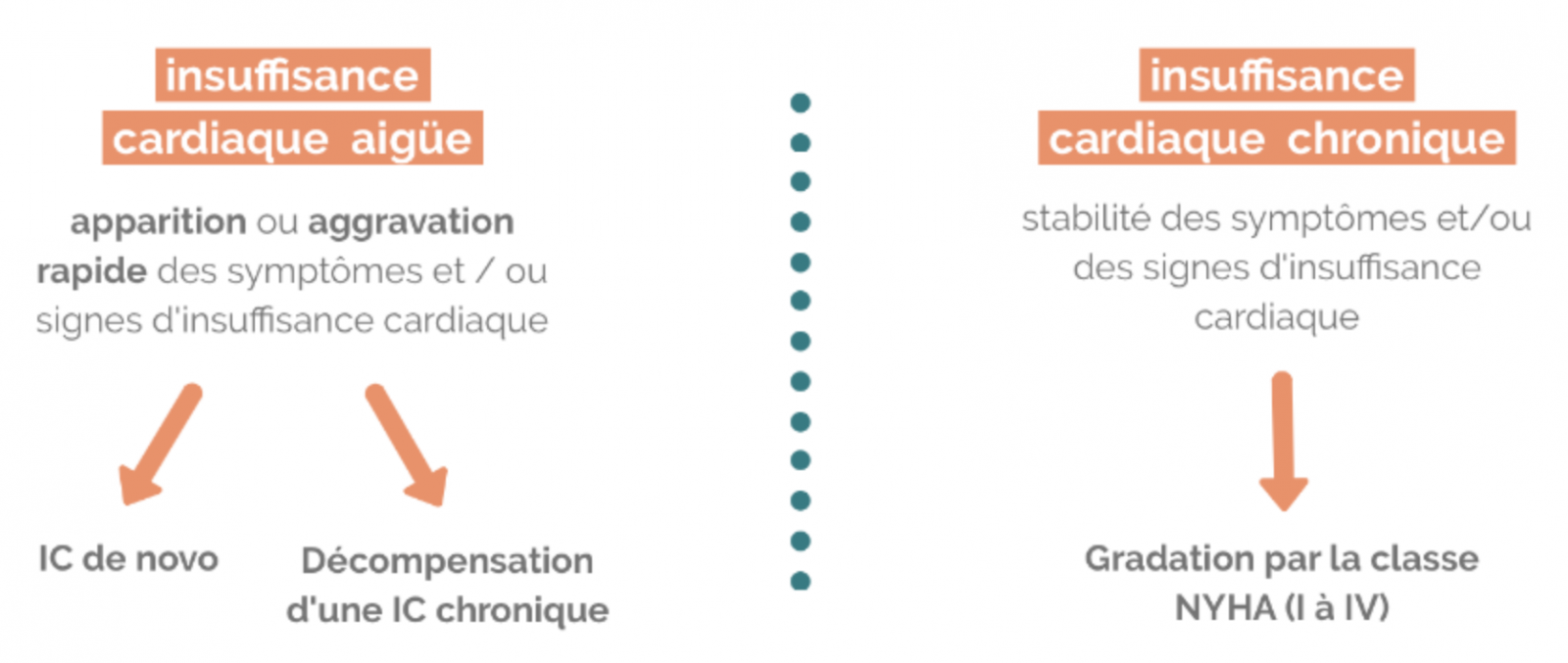
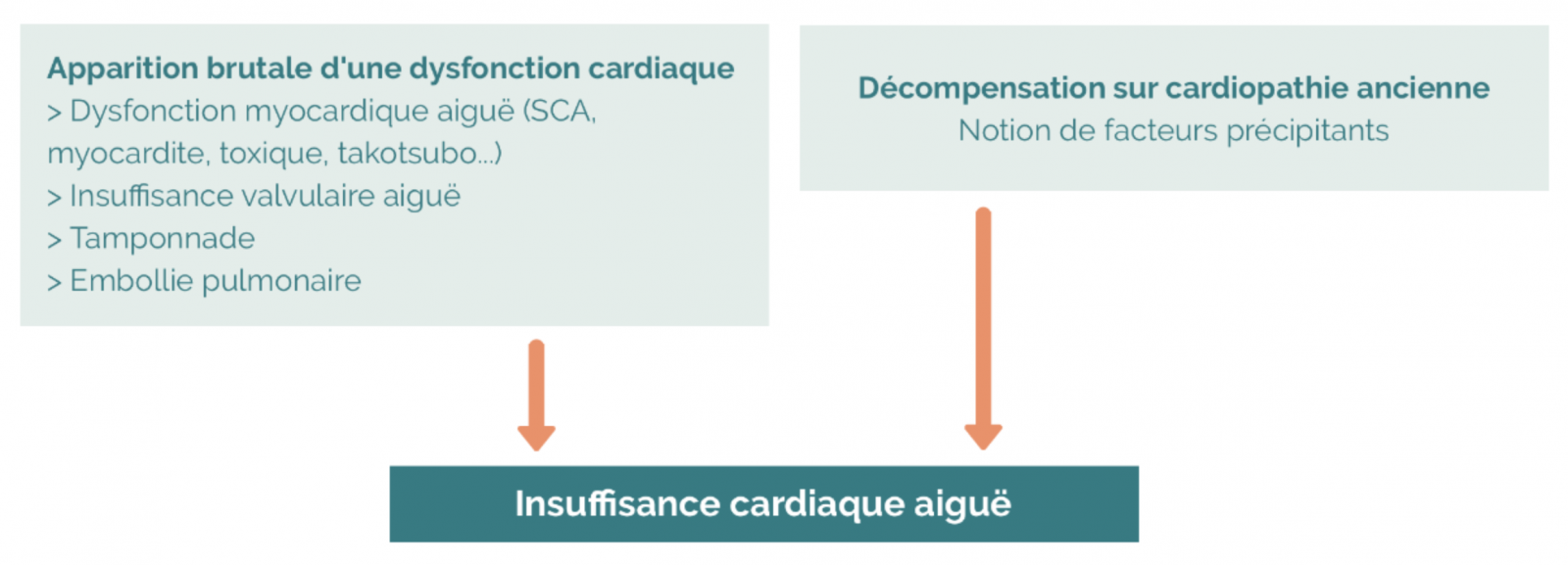
1) Insuffisance cardiaque aiguë
- L’insuffisance cardiaque aiguë est définie comme l’apparition ou l’aggravation rapide de symptômes et de signes d’insuffisance cardiaque.
- Il peut s’agir parfois d’une symptomatologie de novo chez un patient sans cardiopathie connue et d’autres fois, c’est l’aggravation des symptômes chez un patient qui est porteur d’une cardiopathie connue. Insuffisance cardiaque aiguë
- La forme la plus typique est l’œdème aigu pulmonaire (OAP) qui représente une des grandes urgences cardiovasculaires.
- Parfois, le tableau est moins aigu : il s’agit d’une aggravation progressive de la dyspnée qui devient invalidante et qui est associée à l’apparition ou l’aggravation de signes congestifs (œdèmes).
- Dans d’autres cas, il peut s’agir d’un tableau d’insuffisance cardiaque droite isolée.
2) Insuffisance cardiaque chronique
- L’insuffisance cardiaque chronique définit l’état du patient en dehors d’une décompensation aiguë.
- Le patient est ambulatoire (n’est plus hospitalisé), il garde une gène fonctionnelle plus ou moins important en fonction de la gravité de sa maladie.
C) Selon le type d’atteinte myocardique
ÉPIDÉMIOLOGIE
- La fréquence de la maladie a doublé en 10 ans, notamment en raison du vieillissement de la population et de la meilleure prise en charge des pathologies cardiaques.
- 2 à 3% de la population française soit plus d’un million de personnes en France sont atteintes d’une insuffisance cardiaque.
- 300 000 à 400 000 ont du mal à mener une « vie normale » à cause de la maladie.
- Au-delà de 80 ans, plus de 15 personnes sur 100 décèdent d’une insuffisance cardiaque chaque année.
- Avec 150 000 hospitalisations par an, l’insuffisance cardiaque est la première cause d’hospitalisation chez l’adulte en France.
FACTEURS DE RISQUES
Certains facteurs démographiques et comorbidités sont fréquemment associées à une IC à FEVG préservée :
- Âge avancé
- Hypertension artérielle
- FA
- Sexe féminin
- Insuffisance rénale
- Syndrome métabolique, obésité, déconditionnement physique
- Pathologie pulmonaire (BPCO, Hypertension pulmonaire, Apnées du sommeil)
EXAMEN CLINIQUE
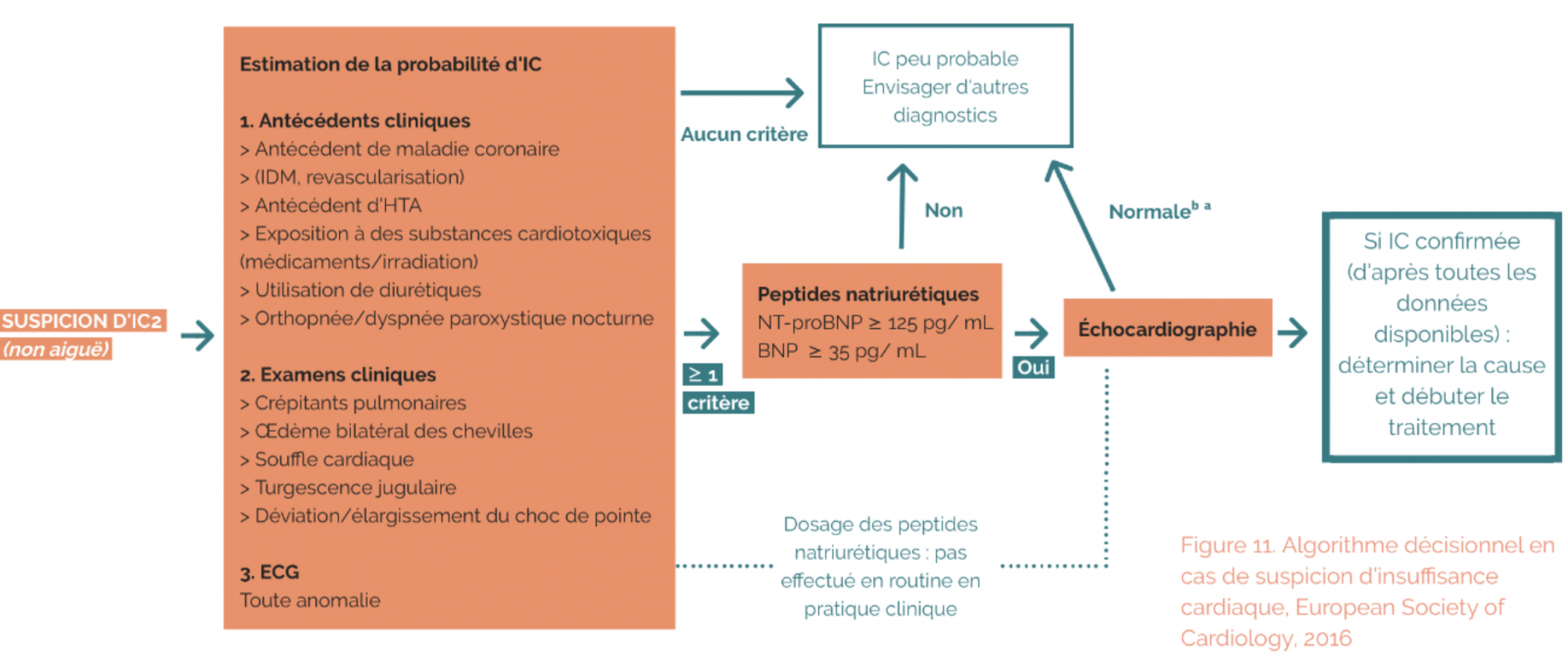
Le diagnostic d’insuffisance cardiaque (IC) est évoqué devant : 1
- des symptômes évocateurs d’IC
- des symptômes non spécifiques chez la personne très âgée
- des signes physiques évocateurs d’IC
- des signes constatés à la radiographie thoracique (cardiomégalie, épanchement pleural).
Il doit être évoqué systématiquement, à fréquence régulière, chez les patients atteints de maladies cardiaques connues, notamment antécédent d’infarctus du myocarde, et lors de la survenue de facteurs susceptibles de favoriser une décompensation.
A) Signes fonctionnels et signes physiques
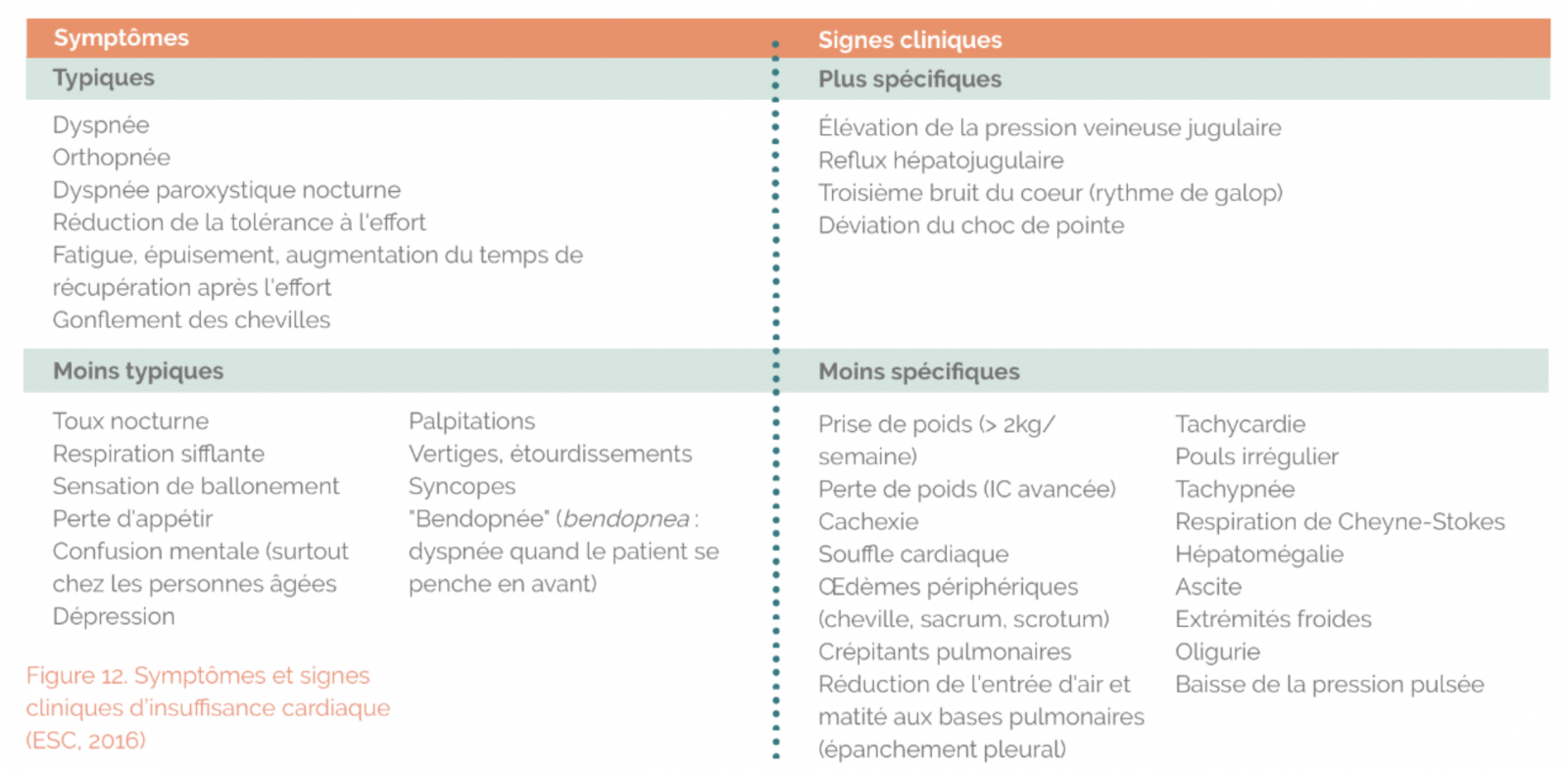
Insuffisance cardiaque gauche :
- Dyspnée d’effort puis de repos
- Orthopnée
- Toux
- Asthénie, intolérance à l’effort, anorexie
Insuffisance cardiaque droite :
- Œdèmes des membres inférieurs
- Hépatalgie
Symptômes non spécifiques chez la personne très âgée :
- Asthénie, confusion, troubles du comportement, désorientation, troubles du sommeil, chutes, perte d’autonomie, prise de poids rapide
- La sévérité des symptômes est mal corrélée à l’altération de la fonction ventriculaire gauche mais aide à estimer la qualité de vie du patient et à adapter le traitement.
- La limitation de l’activité prend en compte l’incapacité fonctionnelle liée aux problèmes articulaires, musculaires et neurologiques qui rendent difficile la cotation
La sévérité est appréciée par le stade fonctionnel de la Classification de la New York Heart Association (NYHA) :
- stade I : pas de symptôme ni de limitation de l’activité physique ordinaire ;
- stade II : limitation modeste de l’activité physique : à l’aise au repos, mais l’activité ordinaire entraîne une fatigue, des palpitations, une dyspnée ;
- stadeIII : réduction marquée de l’activité physique: à l’aise au repos, mais une activité physique moindre qu’à l’accoutumée provoque des symptômes et des signes objectifs de dysfonction cardiaque ;
- stade IV : limitation sévère : symptômes présents même au repos.
La sévérité des symptômes est mal corrélée à l’altération de la fonction ventriculaire gauche mais aide à estimer la qualité de vie du patient. La limitation de l’activité prend en compte l’incapacité fonctionnelle liée aux problèmes articulaires, musculaires et neurologiques qui rendent difficile la cotation.
1) Signes fonctionnels respiratoires
- La dyspnée d’effort est le signe clinique le plus fréquent mais le moins spécifique, souvent révélateur de la maladie. Le degré d’effort pour lequel apparaît la dyspnée permet de quantifier la tolérance fonctionnelle de la maladie.
- L’orthopnée, plus spécifique, survient lors du décubitus et oblige le patient à dormir en ayant la tête surélevée par des oreillers, voire en position assise.
- La dyspnée paroxystique nocturne, également plus spécifique, réveille le patient au cours de la nuit et l’oblige à se lever pour reprendre son souffle.
Certains signes respiratoires peuvent être trompeurs :
- Une bradypnée expiratoire avec respiration sifflante pouvant faussement orienter vers une cause pulmonaire
- La toux survenant électivement à l’effort ou au décubitus
- Les hémoptysies, rarement isolées, traduisent l’hypertension veineuse pulmonaire.
- La dyspnée aiguë de repos, au cours de l’œdème aigu pulmonaire, s’accompagne d’anxiété, de sueurs, d’un grésillement laryngé, avec toux ramenant une expectoration mousseuse.
2) Autres signes fonctionnels
L’insuffisance cardiaque peut aussi s’accompagner de :
- fatigue de repos liée à l’hypotension artérielle, ou à l’effort.
- faiblesse musculaire, qui doit parfois faire rechercher une myopathie associée, surtout dans le cas d’une cardiomyopathie dilatée.
- palpitations
En cas d’insuffisance cardiaque sévère ou terminale, on peut observer des troubles :
- respiratoires (syndrome d’apnée du sommeil avec respiration de Cheynes-Stokes). La prévalence du syndrome d’apnée du sommeil est augmentée dans l’IC ;
- neurologiques (confusion liée à un bas débit cérébral) ;
- digestifs (douleurs abdominales, nausées, vomissements).
3) Signes physiques
- Insuffisance cardiaque gauche : Œdème pulmonaire : crépitants, sibilants
- Insuffisance cardiaque droite : Œdèmes des membres inférieurs, Turgescence jugulaire, Reflux hépato-jugulaire
- Signes d’hypoperfusion : Confusion, extrémités froides, cyanose, marbrures, Hypotension tardive. La présence de signes d’hypoperfusion constitue un élément de gravité marquant l’évolution vers le choc cardiogénique et justifiant une prise en charge hospitalière en urgence.
- En dehors d’une poussée aiguë de la maladie, l’examen physique de l’insuffisant cardiaque est souvent assez pauvre. La présence de signes physiques d’insuffisance cardiaque traduit une rétention hydrosodée ou un bas débit périphérique.
Au niveau cardiaque, l’auscultation peut retrouver :
- une tachycardie souvent modérée, absente chez les patients sous bêtabloquant, parfois un rythme irrégulier en cas de fibrillation ou flutter auriculaire ou d’extrasystoles auriculaires ou ventriculaires ;
- un éclat du B2 au foyer pulmonaire en cas d’hypertension artérielle pulmonaire ;
- un souffle d’insuffisance mitrale ou d’insuffisance tricuspidienne fonctionnelles liées à la dilatation de l’anneau mitral ou de l’anneau tricuspide ;
- enfin, un souffle anormal en faveur d’une valvulopathie organique (insuffisance mitrale, insuffisance aortique, rétrécissement aortique, rétrécissement mitral).
Au niveau pulmonaire, l’auscultation pulmonaire recherche :
- la présence de râles crépitants ou sous-crépitants, qui sont le plus souvent bilatéraux ;
- l’existence d’un éventuel épanchement pleural (de caractère transsudatif mis en évidence à la ponction pleurale)
Les signes périphériques d’insuffisance cardiaque droite se manifestent par :
- la turgescence jugulaire est une dilatation anormale de la veine jugulaire, chez un patient en décubitus en position demi-assise ;
- le reflux hépatojugulaire est une dilatation anormale de la veine jugulaire après compression manuelle du foie, due à la congestion hépatique et à l’incapacité́ du cœur droit à assimiler le volume sanguin supplémentaire ainsi déplacé́ par la compression ; elle se recherche dans la même position que précédemment.
- l’hépatomégalie est régulière, ferme et douloureuse à la compression ;
- les œdèmes périphériques sont mous, blancs, indolores, prennent le godet et prédominent au niveau des parties déclives du corps (membres inférieurs, région lombaire chez le patient alité) ;
- l’ascite est souvent tardive, sauf dans les atteintes organiques de la valve tricuspide ou la péricardite chronique constrictive. Elle peut faussement orienter vers une cause hépatique
EXAMENS COMPLÉMENTAIRES
A) Evoquer le diagnostic
1) Electrocardiogramme
- Non systématique, pourra être réalisé lors de la consultation de cardiologie ;
- Un ECG normal ne doit pas faire douter du diagnostic d’insuffisance cardiaque ;
- Il recherche des signes d’hypertrophie auriculaire ou ventriculaire gauche ou droite sont parfois notés ;
- Il permet parfois d’orienter vers une étiologie (onde Q de nécrose en faveur d’un infarctus ancien ou trouble du rythme par exemple).
2) Radiographie du thorax
- Elle peut être normale
- Elle peut mettre en évidence : Cardiomégalie, Œdème pulmonaire, Epanchement pleural
- Elle permet l’exclusion de diagnostics différentiels ou associés pouvant contribuer à la dyspnée (pneumopathie…).
- En cas de dilatation cardiaque, la silhouette cardiaque est augmentée de volume, et le rapport cardiothoracique (RCT) est augmenté (> 0,5). L’absence de cardiomégalie ne doit pas faire remettre en cause le diagnostic d’insuffisance cardiaque (insuffisance cardiaque à fraction d’éjection préservée).
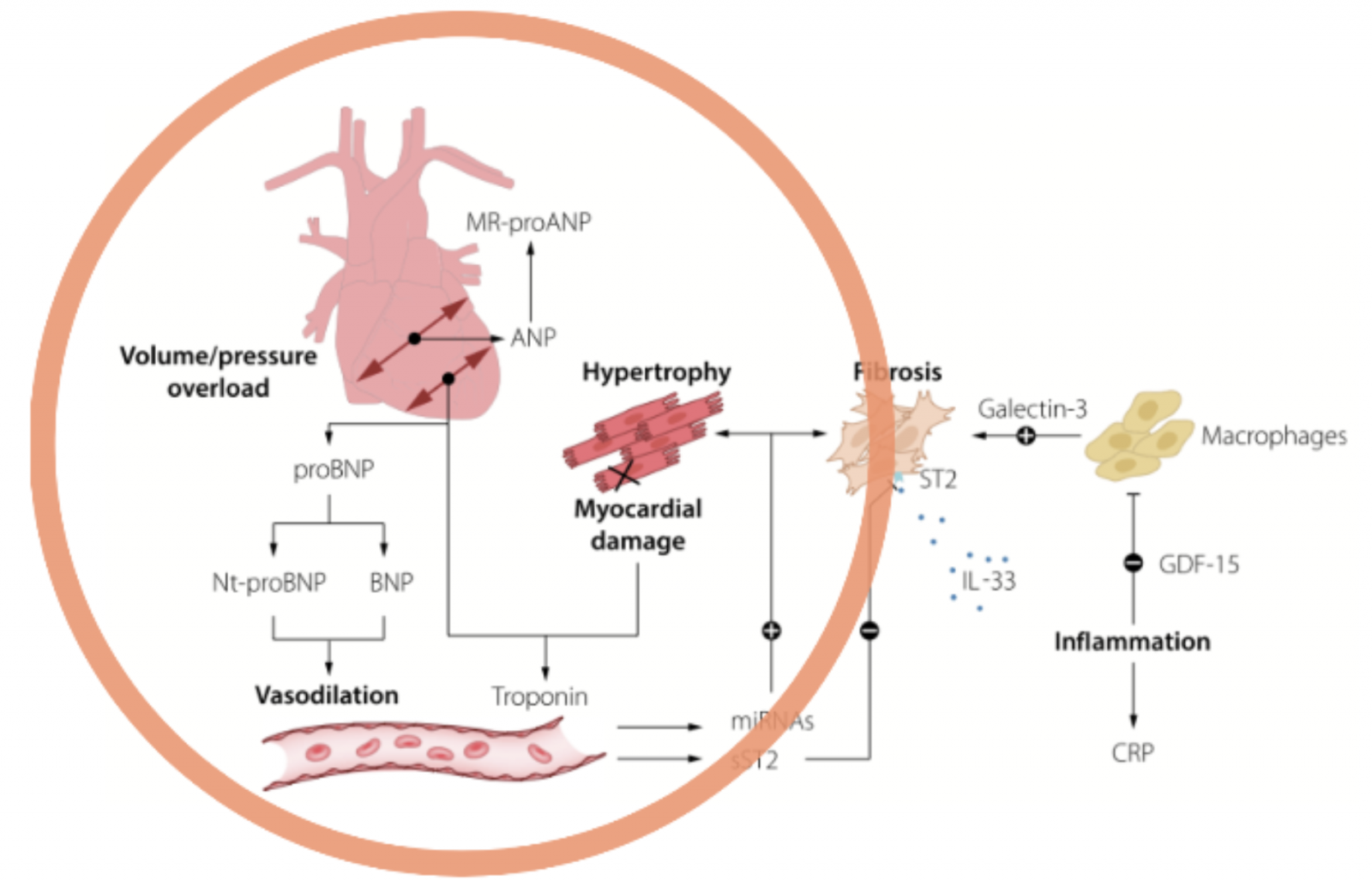
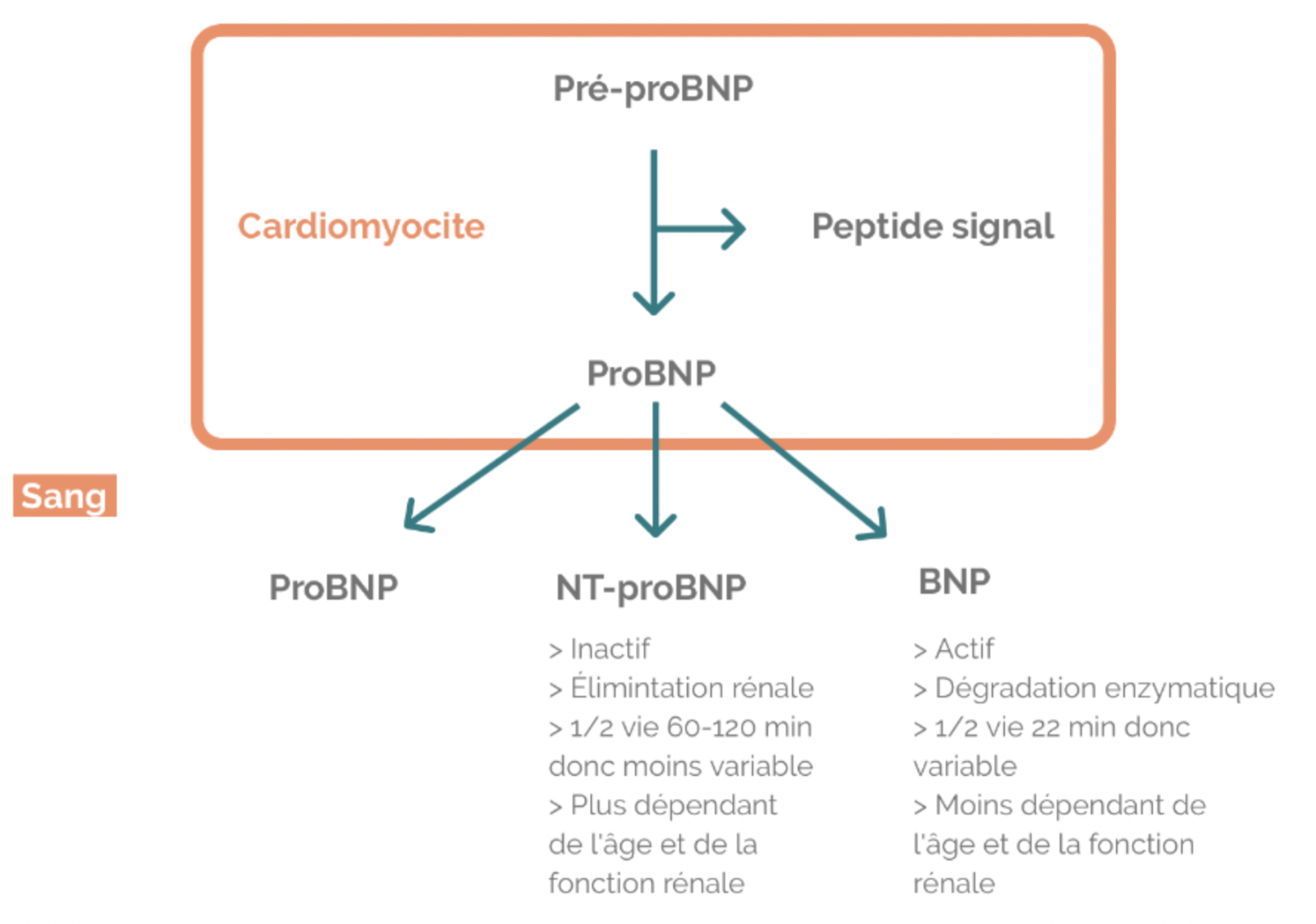
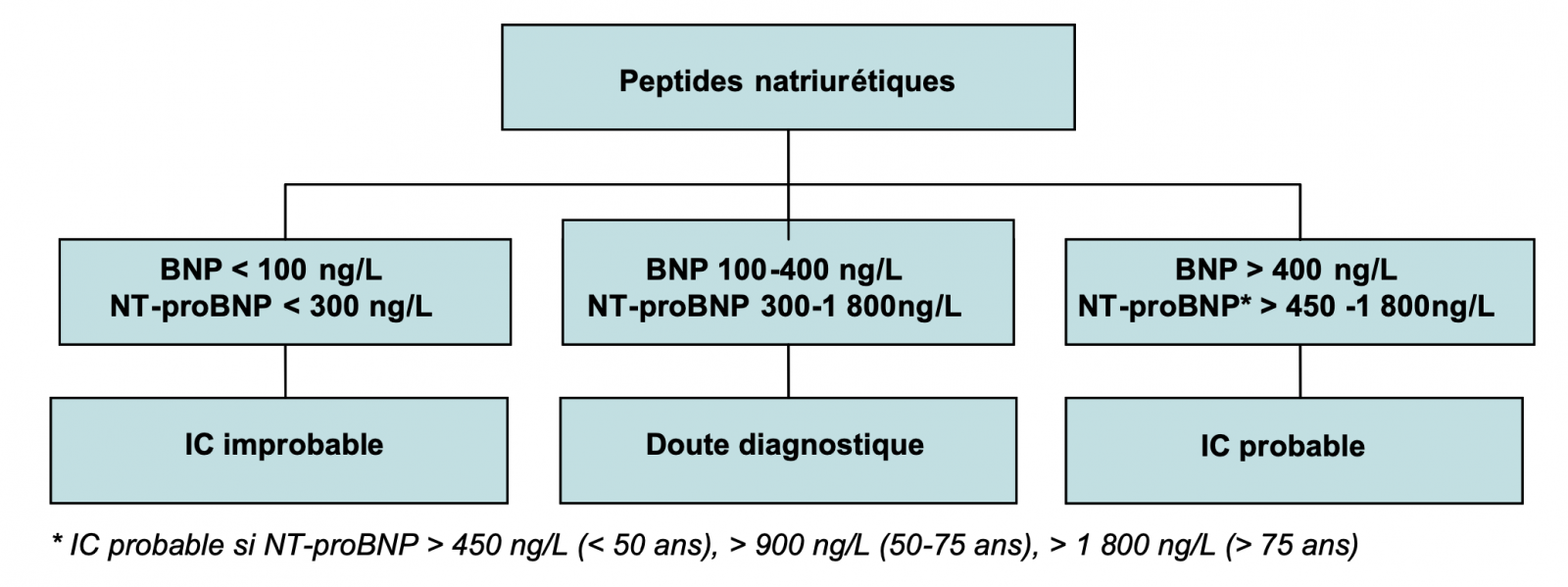
3) BNP et NT-proBNP
- Peptides natriurétiques produits pat le clivage du proBNP majoritairement secrétés par les cardiomyocytes en réponse à l’augmentation du stress pariétal.
- Action antagoniste du système rénine-angiotensine- aldostérone-vasopressine : effets diurétique, natriurétique et vasodilatateur.
- Résultats du dosage du NT-proBNP comparables chez un même patient d’un laboratoire à l’autre contrairement à ceux du BNP (les techniques de dosage du BNP utilisent chacune des anticorps reconnaissant différents épitopes du BNP)
Formation et caractéristiques des peptides natriurétiques :
Valeur diagnostique :
- Valeur prédictive négative excellente : Donc un outil pour écarter le diagnostic en cas de valeur inférieure au seuil
- Valeur prédictive positive moyenne : nombreuses autres causes d’élévation : Ne confirme pas le diagnostic si BNP élevé

Nombreuses autres causes d’élévation :
Causes cardiaques :
- IC
- SCA
- Embolie pulmonaire
- Myocardite
- Hypertrophie ventriculaire gauche
- Cardiomyopathie hypertrophique ou restrictive
- Valvulopathie
- Cardiopathie congénitale
- Tachyarythmie atriale ou ventriculaire
- Contusion cardiaque
- Cardioversion, choc délivré par un DAI
- Intervention chirurgicale cardiaque
- Hypertension pulmonaire
Causes non-cardiaques :
- Âge avancé
- Accident vasculaire cérébral
- Hémorragie méningée
- Insuffisance rénale
- Insuffisance hépatique (principalement cirrhose hépatique avec ascite)
- Syndrome paranéoplasique
- BPCO
- Infections graves (pneumonie, sepsis…)
- Brûlures graves
- Anémie
- Maladies endocriniennes ou métaboliques sévères (thyrotoxicose, acidocétose diabétique…)
B) Confirmer le diagnostic
1) Objectifs de la consultation de cardiologie
- Le diagnostic, suspecté sur la clinique et la biologie, doit être confirmé par une preuve objective de dysfonction cardiaque au repos, structurelle ou fonctionnelle, grâce à l’échocardiographie Doppler qui permet notamment de calculer la fraction d’éjection du ventricule gauche (FEVG) et de mesurer la taille du ventricule gauche (VG), l’épaisseur pariétale, la qualité de l’éjection et du remplissage ventriculaire gauche.
- Confirmer le diagnostic : Echocardiographie-Doppler
- Programmer le bilan étiologique orienté par la clinique / ECG / écho : Exploration coronaire (Coronarographie, CoroTDM, Test d’ischémie), Echographie trans-œsophagienne si valvulopathie, IRM cardiaque, Consultation génétique
2) Echocardiographie cardiaque transthoracique-doppler (ETT) :
- Examen clé indispensable en cas de suspicion d’insuffisance cardiaque
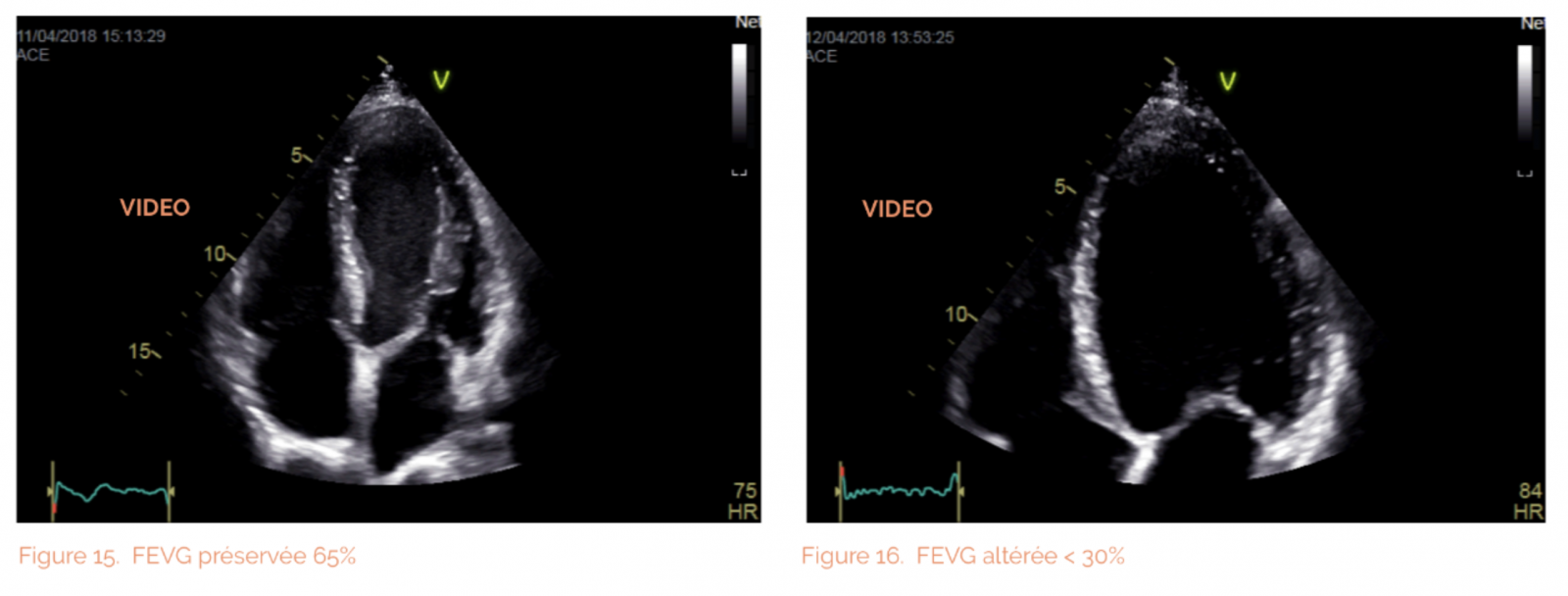
- Confirme le diagnostic d’insuffisance cardiaque : Une fraction d’éjection (FE < 40 - 50 %) affirme l’IC systolique (ICS).
- Différencie IC à FE préservée > 50%, modérément altérée 40-50%, à FE altérée < 40% : en cas de FE > 40 - 50 %, on évoque l’insuffisance cardiaque à fraction d’éjection préservée (ICFEP). Des critères précis de trouble de la relaxation et de dysfonction diastolique doivent être présents pour affirmer le diagnostic.
- Oriente vers l’étiologie de l’insuffisance cardiaque.
L’ETT renseigne sur :
- la taille du ventricule gauche qui peut être mesurée par les diamètres (diamètre diastolique [DDVG] et systolique [DSVG] du VG) ou les volumes.
- la fonction systolique du ventricule gauche mesurée notamment par la fraction d’éjection ventriculaire gauche (FEVG), et par la déformation longitudinale (Strain).
- la taille et la fonction du ventricule droit, la taille des oreillettes.
- l’aspect des valves cardiaques.
- le niveau des pressions de remplissage et la fonction diastolique.
- des indices hémodynamiques (débit cardiaque et pressions artérielles pulmonaires).
L’ETT peut en plus orienter vers une étiologie :
- anomalie de la cinétique segmentaire pouvant évoquer une pathologie ischémique.
- valvulopathie (insuffisance ou rétrécissement).
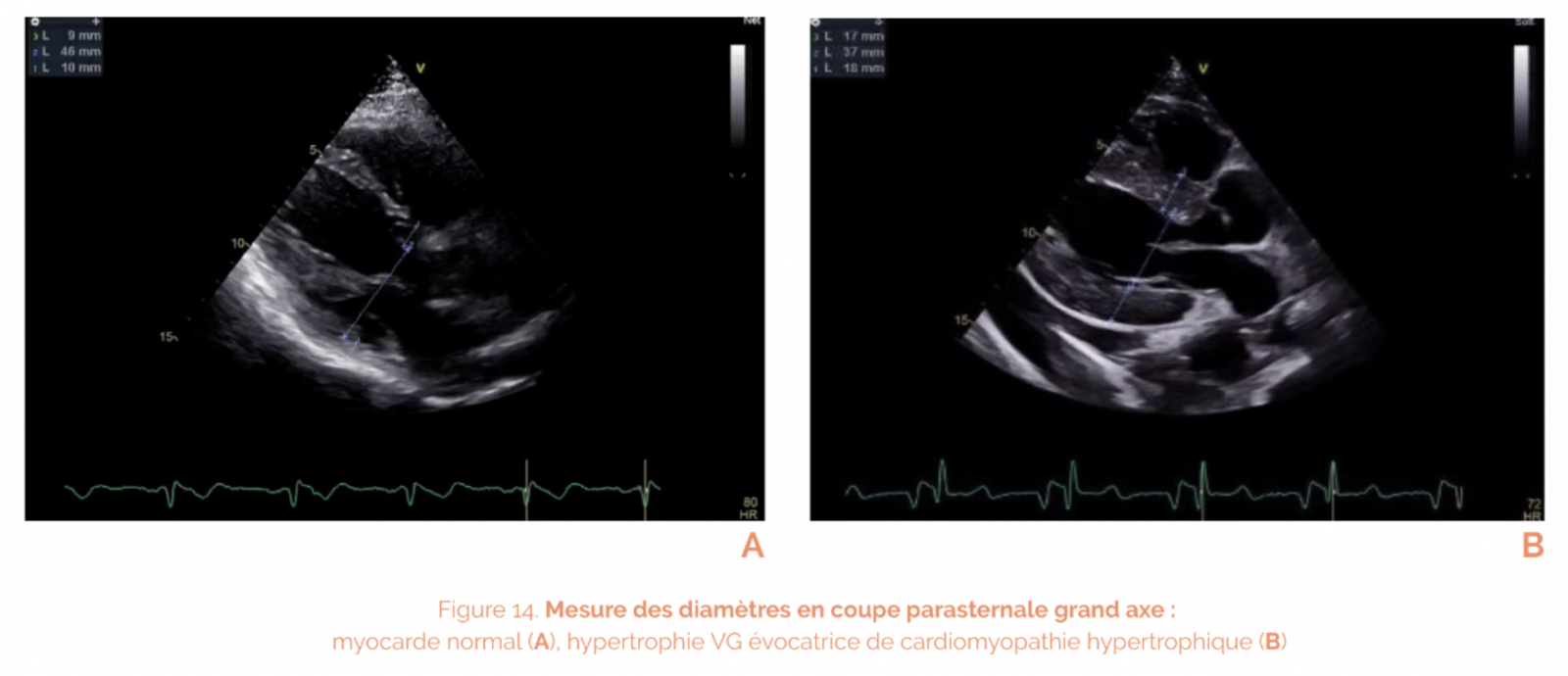
- hypertrophie (symétrique en faveur d’une cardiopathie hypertensive, hypertrophie asymétrique, en faveur d’une cardiomyopathie hypertrophique).
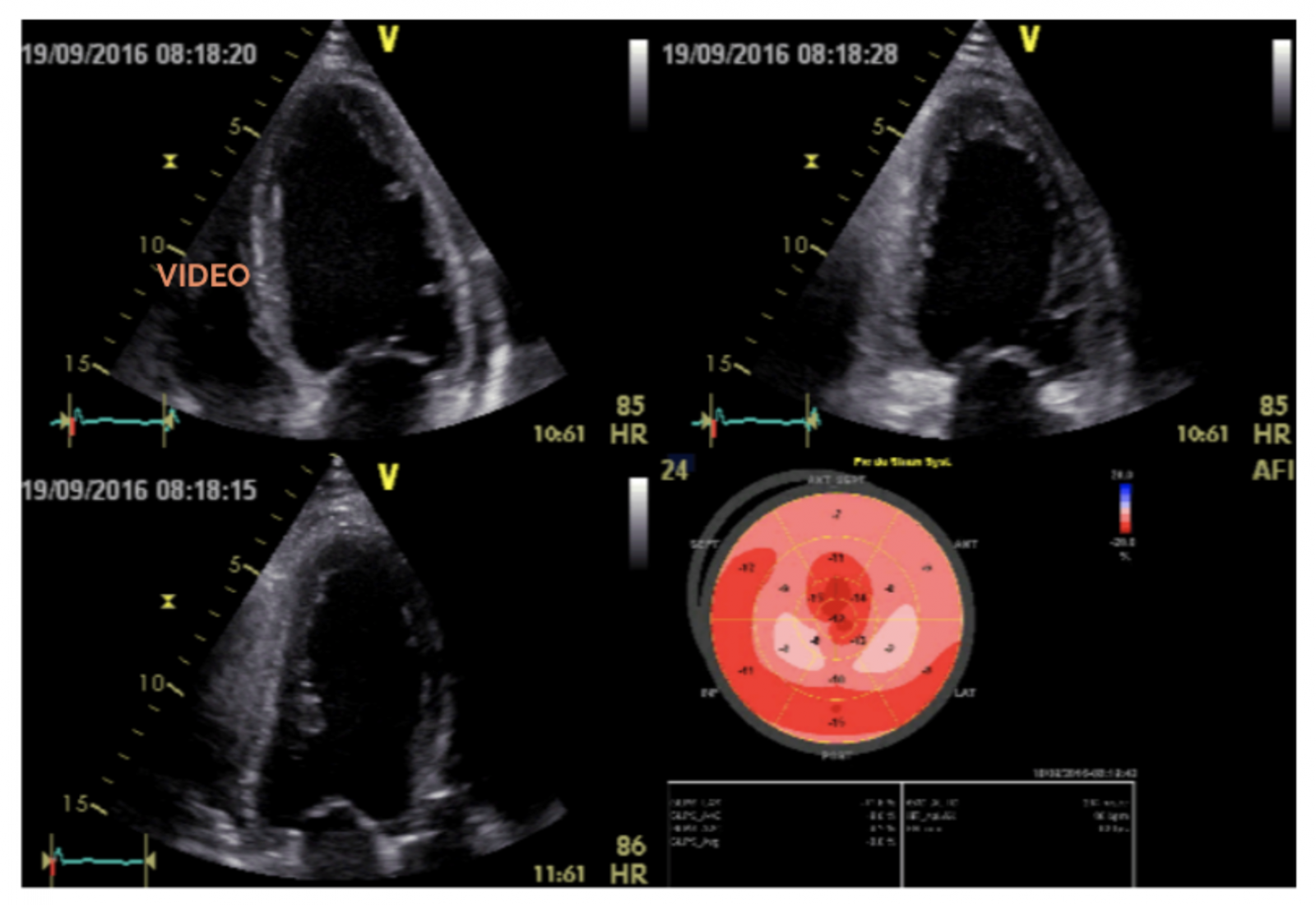
Coupes apicales 4 cavités, 2 cavités, 3 cavités et résultats de l’analyse STRAIN

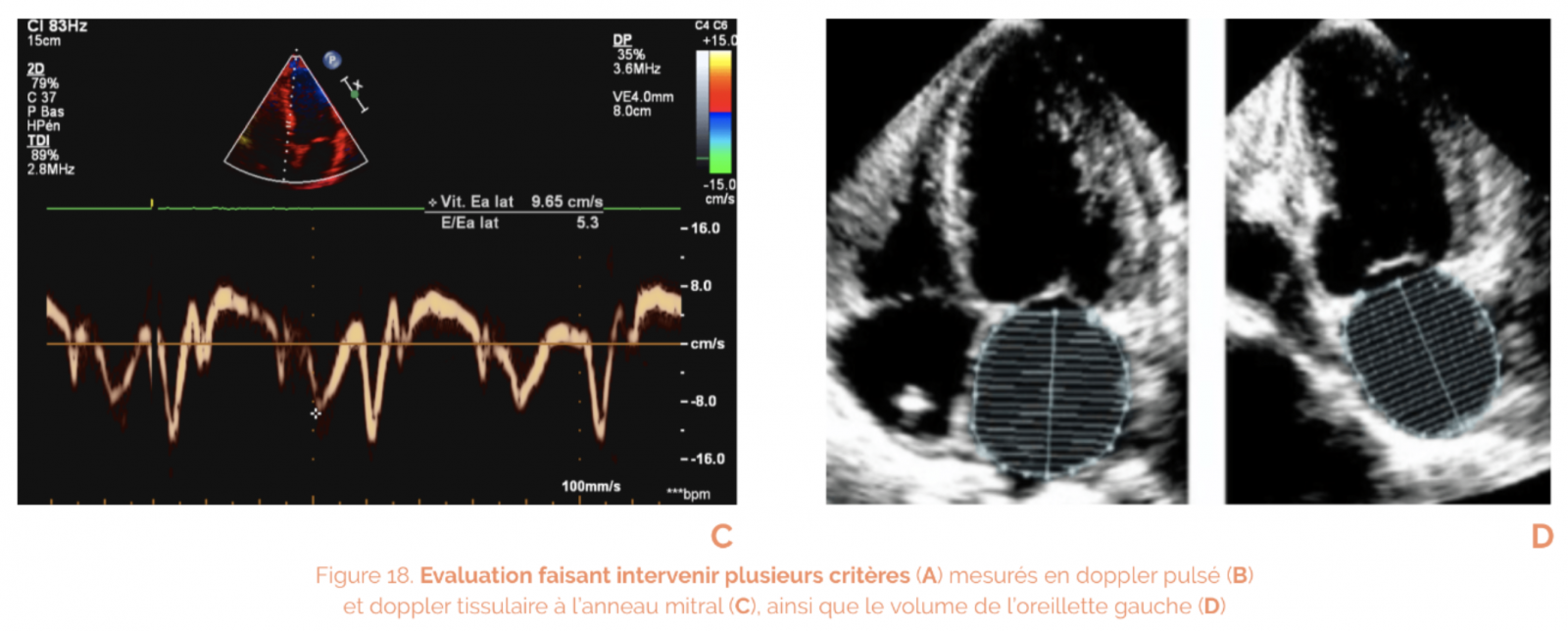
Organiser le bilan initial
A) Annonce du diagnostic et déclaration en ALD
1) Annoncer le diagnostic
- Aux stades peu ou asymptomatiques, l’importance du suivi, l’observance des traitements, l’adhésion au respect d’une bonne hygiène de vie sont présentées au patient comme essentielles.
- Aux stades sévères, l’annonce peut parfois nécessiter une consultation dédiée qui pourra aborder les aspects relatifs à la désignation d’une personne de confiance et la rédaction de directives anticipées.
- Si l’annonce est faite par le cardiologue, le médecin généraliste sera informé de cette consultation d’annonce. Il devra être en contact avec l’établissement de santé, en cas de diagnostic lors d’un premier épisode de décompensation, pour s’assurer de la coordination et de la cohérence de l’information fournie au patient.
- Mise en place d’un Plan Personnalisé de Santé si âge > 75 an
2) Déclaration en ALD
a) Insuffisance cardiaque systolique (ICS) symptomatique chronique associant :
- Des symptômes de l’insuffisance cardiaque (au repos ou à l'effort) présents ou retrouvés dans les antécédents
- Et une preuve objective d’une dysfonction cardiaque systolique au repos avec une fraction d’éjection (FE) < 40 %
b) Insuffisance cardiaque à fonction systolique préservée (ICFSP) symptomatique chronique associant :
- Des symptômes de l’insuffisance cardiaque (au repos ou à l'effort) présents ou retrouvés dans les antécédents objectivés par une poussée d’insuffisance cardiaque congestive sous forme d’œdème pulmonaire ;
- Et un signe objectif de dysfonction cardiaque au repos avec une fonction systolique préservée ou modérément altérée (FE > 40%) ;
- Et une réponse pharmacologique au traitement de l’insuffisance cardiaque
L'exonération initiale est accordée pour une durée de 5 ans, renouvelable.
B) Bilan clinique
- Recherche de cardiopathies sous jacentes
- Recherche de causes de décompensation
- Recherche de comorbidités
- Évaluation des besoins du patient et modalités de suivi
1) Recherche de cardiopathies sous-jacentes
- Cardiopathie ischémique : antécédents coronariens, facteurs de risque cardiovasculaires
- Cardiopathie valvulaire, rythmique, congénitale, hypertensive
- Cardiotoxicité : consommation excessive d’alcool, antécédent de chimiothérapie (anthracyclines)
- Antécédent de radiothérapie thoracique
- Atteinte infectieuse (RAA dans l’enfance, endocardite infectieuse)
- Maladie générale : phéochromocytome, maladies de système, hyperthyroïdie…
2) Recherche de causes déclenchantes de décompensation
- Mauvaise observance du traitement ou prise hydrosodée excessive, abus d’alcool
- Fibrillation atriale (FA), trouble du rythme ventriculaire
- Ischémie myocardique
- HTA non contrôlée
- Introduction récente de médicaments contre-indiqués, intoxication digitalique
- Anémie
- Infections intercurrentes (bronchopneumopathie, infection virale)
- Apparition d’une insuffisance rénale, déshydratation intracellulaire avec hypernatrémie
- Embolie pulmonaire
- Hyperthyroïdie, hypothyroïdie.
Ces causes peuvent souvent être corrigées, permettant de faire régresser les signes d’insuffisance cardiaque et d’éviter les décompensations.
3) Recherche de comorbidités
- Facteurs de risque cardio-vasculaire (diabète, tabagisme, surpoids, anomalie du bilan lipidique)
- Dénutrition
- Insuffisance rénale
- Syndrome d’apnées obstructives du sommeil (SAOS)
Ces causes peuvent souvent être corrigées, permettant de faire régresser les signes d’insuffisance cardiaque et d’éviter les décompensations.
4) Évaluation des besoins du patient et des modalités de suivi
Il sera nécessaire d’évaluer :
- le retentissement de l’insuffisance cardiaque sur les activités de la vie quotidienne
- les problèmes posés par les comorbidités associées
- ses attentes, ses motivations au changement
- sa capacité à moduler son mode de vie
- les freins à une prise en charge efficace (psychologiques et sociaux).
Une évaluation gérontologique peut être nécessaire chez la personne âgée :
- évaluation des fonctions cognitives
- évaluation de l’autonomie
- évaluation de l’état nutritionnel
Questionnaire de qualité de vie du Minnesota :

C) Bilan paraclinique systématique
1) Bilan biologique
- Hémogramme
- Natrémie, kaliémie. créatininémie et DFG
- Bilan hépatique
- Bilan lipidique, glycémie, HbA1c
- Ferritine, CST, TSH
- BNP / NT-proBNP
2) ECG 12 dérivations
- Recommandé chez tous les patients en IC afin de déterminer le rythme et la FC, la morphologie et la durée de QRS, et de détecter d’éventuelles anomalies. Cette information est nécessaire pour l’élaboration et le suivi du traitement (I, C)
3) Radiographie thoracique
- Recommandée chez les patients en IC afin de détecter/exclure d’autres maladies, pulmonaires ou autres, qui pourraient contribuer à la dyspnée. Elle peut aussi permettre d’identifier un œdème pulmonaire ou une congestion, et elle est pls utile chez les patients suspectés d’ICA (I, C)
4) Bilan étiologique
Bilan étiologique organisé lors de la consultation de cardiologie selon l’étiologie suspectée : coronarographie, IRM myocardique, cathétérisme cardiaque droit
a) Epreuve d’effort
- Une épreuve d’effort est recommandée dans le cadre du bilan avant greffe cardiaque ou assistance circulatoire (I, C) ;
- Elle doit être envisagée afin d’optimiser la prescription d’activité physique (IIa, C) ;
- Elle doit être envisagée afin d’identifier la cause d’une dyspnée inexpliquée (IIa, C) ;
- Elle peut être envisagée afin de détecter une ischémie myocardique réversible (IIb, C).
b) IRM cardiaque
- Elle peut parfois orienter l’échocardiographie notamment dans les rares cas où le patient n’est pas suffisamment échogène, pour mesurer la fraction d’éjection
- Elle peut parfois orienter le bilan étiologique : diagnostic de myocardite, dysplasie arythmogène du VD, sarcoïdose cardiaque, amylose cardiaque. L’IRM peut également aider au diagnostic de cardiopathie ischémique (rehaussement tardif sous-endocardique en faveur d’une séquelle d’infarctus du myocarde) et à l’évaluation de la viabilité afin d’orienter un geste de revascularisation. Enfin, dans la cardiomyopathie dilatée, la présence et l’importance du rehaussement tardif (marqueur de fibrose) pourraient représenter un facteur pronostique péjoratif
- Une IRM cardiaque est recommandée pour évaluer la structure et la fonction myocardiques (y compris le cœur droit) chez les patients peu échogènes et chez les patients atteints de cardiopathies congénitales complexes (en prenant en compte les risques et les contre-indications de l’IRM) (I, C).
- Si les données cliniques et les images obtenues auparavant ne sont pas concluantes, une IRM avec rehaussement tardif du gadolinium doit être envisagée chez les patients atteints de CMD afin de distinguer les atteintes myocardiques ischémiques et non ischémiques (en prenant en compte les risques et les contre-indications de l’IRM) (IIa, C).
- Une IRM est recommandée pour caractériser les tissus myocardiques en cas de suspicion de myocardite, d’amylose, de sarcoïdose, de maladie de Chagas, de maladie de Fabry, de NCVG ou d’hémochromatose (en prenant en compte les risques et les contre-indications de l’IRM) (I, C).
c) Coronarographie
- Elle est en général proposée en cas d’altération de la fonction systolique (fraction d’éjection diminuée) pour éliminer une maladie coronaire.
- Les cardiopathies ischémiques représentent la première cause d’insuffisance cardiaque, et si une ou des sténoses coronaires s’accompagnent d’une ischémie documentée, une revascularisation devra être discutée.
- À l’opposé, la normalité du réseau coronaire et l’absence d’autres causes orienteront vers une cardiomyopathie dilatée (maladie primitive du muscle cardiaque).
- Chez le sujet jeune, la coronarographie peut être remplacée par un coroscanner.
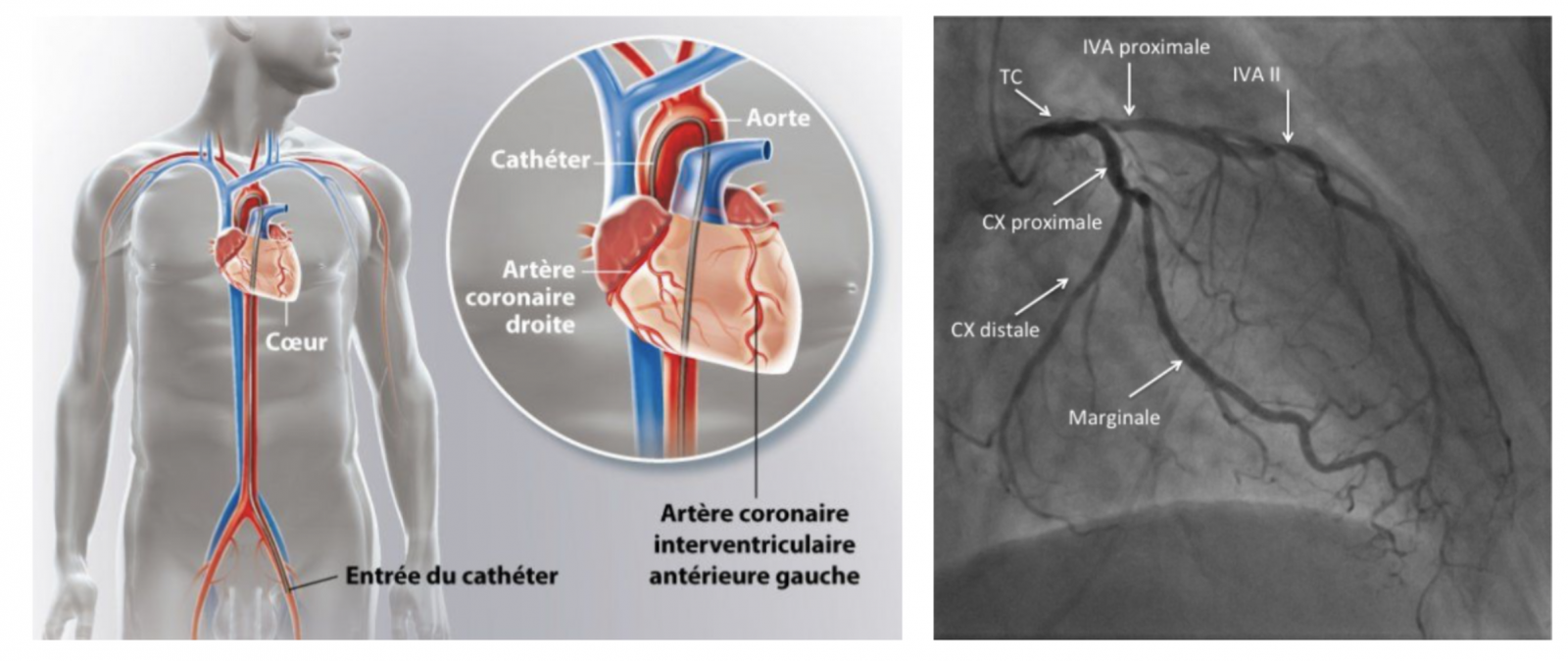
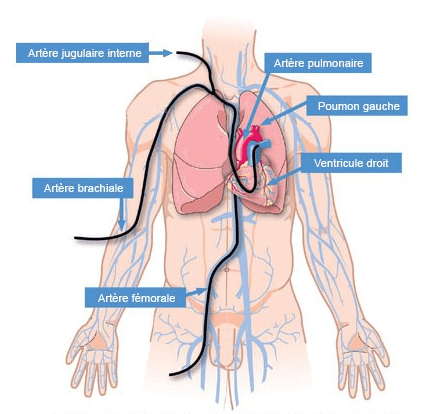
d) Cathétérisme cardiaque droit
- Le cathétérisme cardiaque droit consiste à introduire un cathéter par voie veineuse qui est monté dans l’artère pulmonaire via les cavités droites, puis dans une branche artérielle pulmonaire.
- est recommandé chez les patients en IC grave chez lesquels on envisage une greffe cardiaque ou une assistance circulatoire (I, C) ;
- doit être envisagé chez les patients chez lesquels une hypertension pulmonaire probable a été repérée par échocardiographie, afin de confirmer cette hypertension et d’évaluer sa réversibilité avant de procéder à la correction d’une atteinte cardiaque valvulaire/structurale (IIa, C) ;
- peut être envisagé afin d’ajuster le traitement des patients en IC qui resten trè symptomatiques malgré un traitement initial conventionnel et chez lesquels l’état hémodynamique est difficile à déterminer (IIb, C).
- Il permet de mesurer la pression dans l’oreillette droit, dans le ventricule droit, dans l’artère pulmonaire, puis dans le capillaire pulmonaire. L’hypertension artérielle pulmonaire est définie comme une PAP moyenne supérieure à 25 mmHg au repos (alors que chez le sujet sain, elle est comprise entre 10 et 15 mmHg)
- La mesure simultanée de la pression et du débit permet de mesurer les résistances pulmonaires.
- Il mesure directement le débit cardiaque par la technique de thermodilution (débit cardiaque normal est de 5 L/min, l’index cardiaque de 3 L/min/m2).
DIAGNOSTICS DIFFÉRENTIELS
Votre texte ici
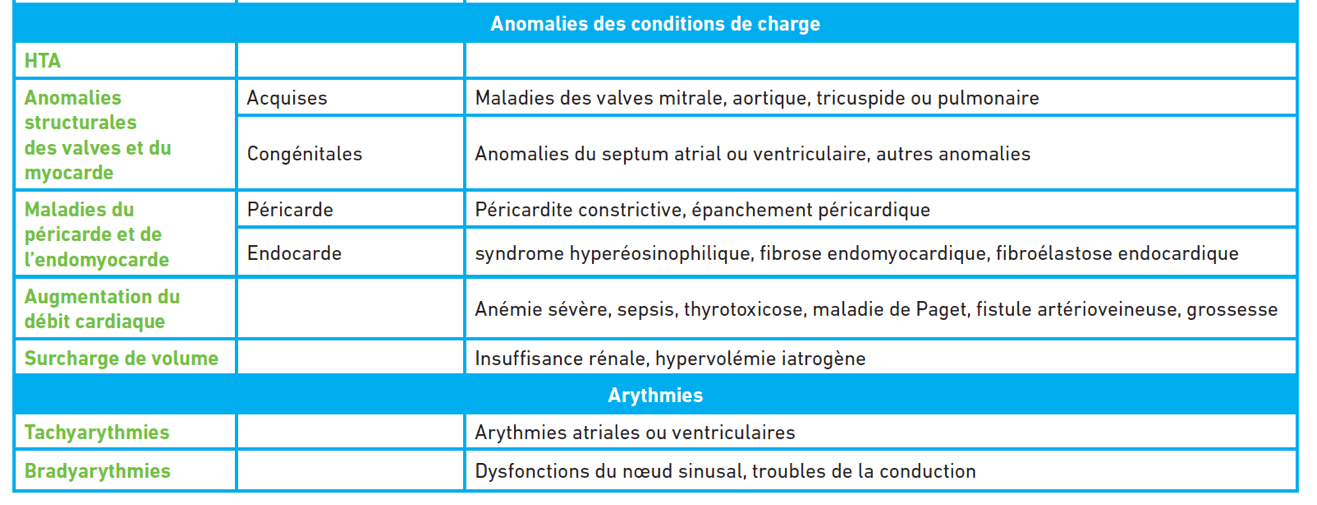
ÉTIOLOGIE

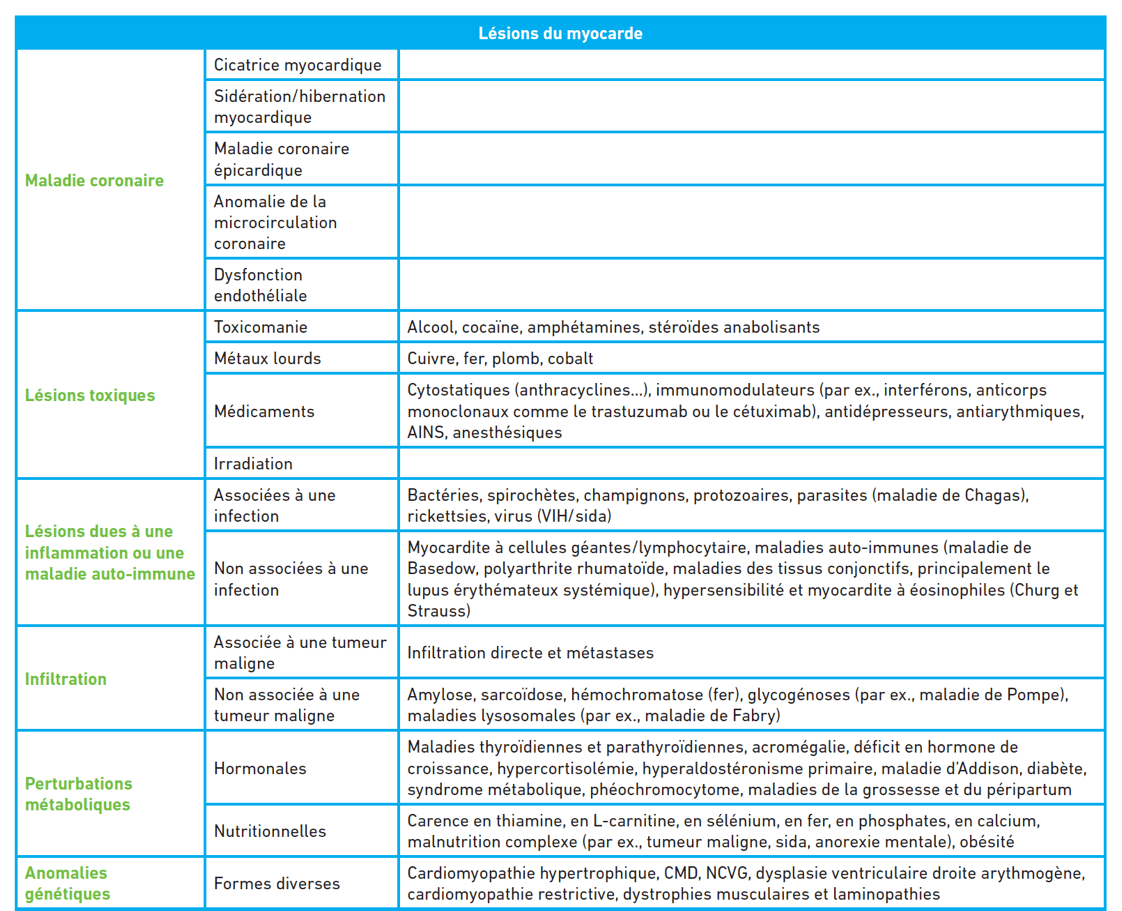
A) Cardiopathie ischémique
- Elle représente aujourd’hui la première cause d’insuffisance cardiaque à FEVG altérée.
- Il s’agit le plus souvent de la conséquence d’un ou de plusieurs infarctus du myocarde qui vont diminuer le nombre de myocytes fonctionnels, les remplacer par de la fibrose et entrainer une perte de la contractilité́ d’un ou plusieurs segments du ventricule gauche, d’où une baisse de la FEVG.
- L’ischémie chronique provoquée par la maladie coronaire peut être réversible lorsque le patient est revascularisé (viabilité myocardique).
B) Hypertension artérielle
- L’HTA est un facteur ou un cofacteur important d’insuffisance cardiaque.
Elle agit par l’intrication de plusieurs mécanismes :
- par le développement d’une hypertrophie cardiaque souvent associée à de la fibrose qui va provoquer une altération de la fonction diastolique et du remplissage ventriculaire. Ce mécanisme est fréquemment en cause dans l’insuffisance cardiaque à fonction systolique préservée
- en favorisant le développement de l’athérome coronaire classique à l’origine d’infarctus du myocarde ou d’une atteinte des petites artères coronaires ;
- en entraînant une altération tardive de la fraction d’éjection du fait de l’augmentation chronique de la postcharge.
C) Valvulopathies
- Toutes les valvulopathies gauches peuvent se compliquer d’insuffisance cardiaque (insuffisance mitrale ou aortique, rétrécissement mitral ou aortique).
- Il s'agit toujours d’un tournant évolutif grave qui justifie une prise en charge radicale de la valvulopathie (remplacement valvulaire, plastie ou traitement percutané).
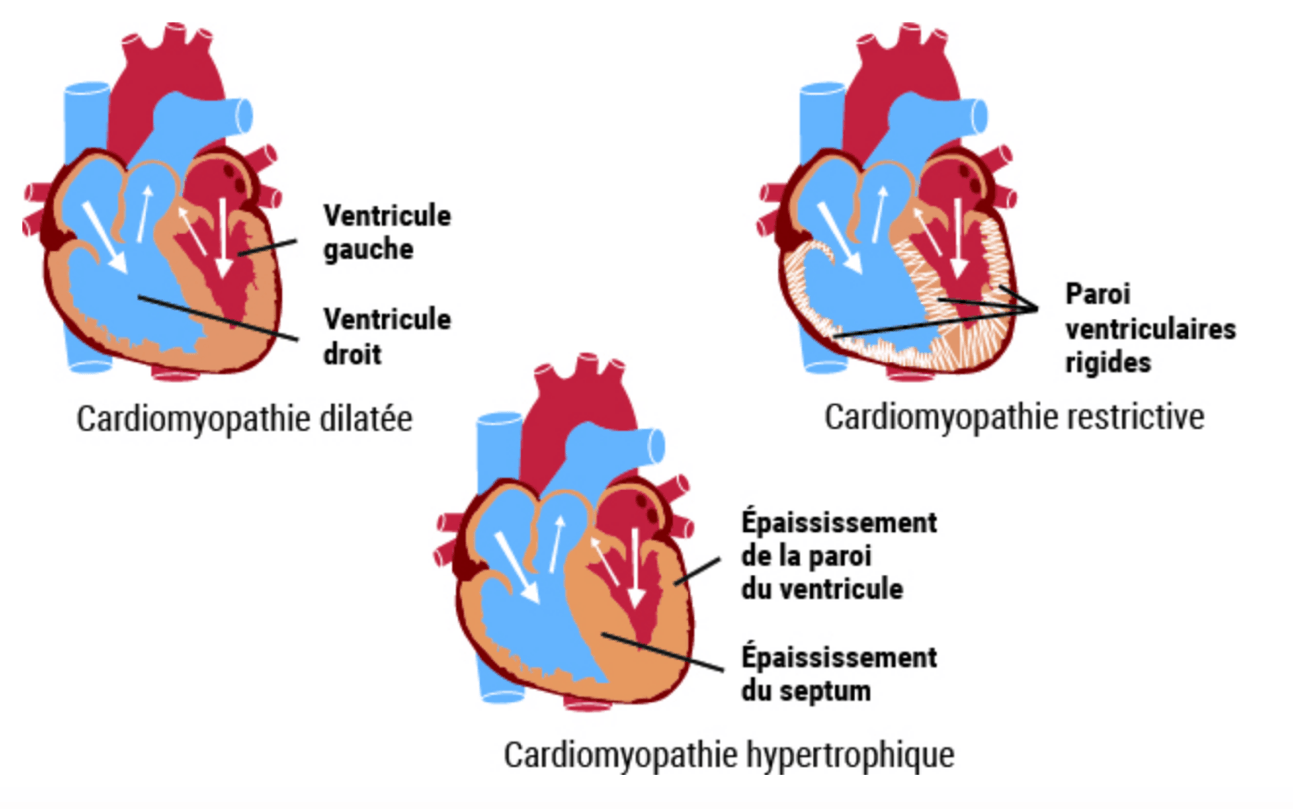
D) Cardiomyopathies
- Ce sont des maladies du muscle cardiaque, leur diagnostic suppose donc qu’on ait éliminé une cause ischémique, valvulaire, congénitale ou une HTA.
- Les cardiomyopathies dilatées (CMD) sont définies par une atteinte du muscle cardiaque qui aboutit à une dilatation et une baisse de la fraction d’éjection du VG.
- Les cardiomyopathies hypertrophiques (CMH) : elles sont caractérisées par une hypertrophie anormale des parois le plus souvent asymétrique, une fraction d’éjection conservée et un trouble du remplissage cardiaque.
- Les cardiomyopathies restrictives sont plus rares : la plus fréquente est représentée par l’amylose cardiaque dont les dépôts amyloïdes vont progressivement entrainer une infiltration extracellulaire à l’origine d’une augmentation d’épaisseur diffuse des parois, qui deviennent rigides et moins compliantes, d’où une difficulté majeure du remplissage cardiaque, la fonction systolique étant généralement atteinte dans un deuxième temps.
COMPLICATIONS
Votre texte ici
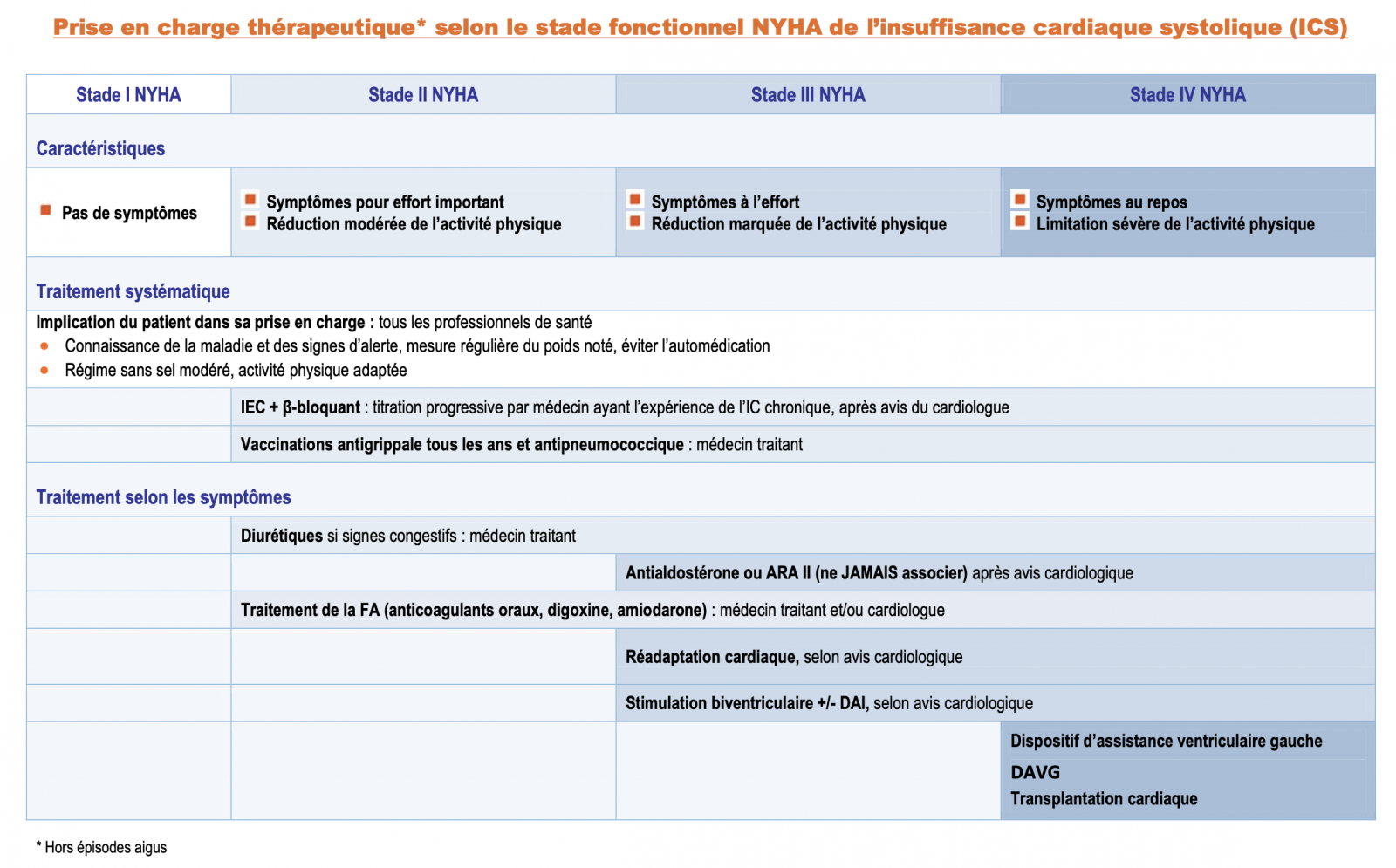
PRISE EN CHARGE THÉRAPEUTIQUE
A) Rôle du médecin généraliste dans l’insuffisance cardiaque
1) Diagnostic et traitement
- Il évoque le diagnostic et le fait confirmer.
- Il reconduit ou adapte le traitement non médicamenteux et médicamenteux.
- Il prescrit le traitement diurétique en cas de besoin (décompensation, œdèmes)
2) Suivi
- Il accompagne son patient dans sa prise en charge.
- Il fait le point sur les actions entreprises par le patient afin de parvenir aux objectifs convenus.
- Il s’assure du respect des consultations auprès du cardiologue. Il adresse au cardiologue ou à la structure hospitalière en cas d’instabilité clinique, de persistance ou de réapparition de symptômes malgré le traitement.
- Il fait appel aux autres spécialistes (pneumologue, gériatre, MPR) et professionnels de santé (infirmière, diététicien, kinésithérapeute) si nécessaire et coordonne tous les intervenants autour du malade.
- Il assure le recueil des données, la tenue du dossier médical et la transmission d’informations.
B) Objectifs du traitement de l’insuffisance cardiaque
- Améliorer la qualité́ de vie : soulager les symptômes (essoufflement, fatigue, œdèmes, etc.) et permettre les activités de la vie quotidienne.
- Prévenir les épisodes de décompensation et réduire le nombre et la durée des hospitalisations.
- Ralentir la progression de la maladie et réduire la mortalité.
- Le traitement de l’insuffisance cardiaque comprend toujours un traitement non pharmacologique, avec prescription de nouvelles habitudes alimentaires et d’activité́ physique régulière et un traitement pharmacologique.
- Le traitement par dispositifs intracardiaques (stimulation biventriculaire) prend une place croissante dans l’ICS demeurant symptomatique malgré un traitement optimal. En cas de résultat insuffisant, chez certains patients, une indication d’assistance ventriculaire gauche ou de greffe cardiaque est discutée. À un stade très avancé, (stade IV réfractaire de la NYHA), de soins palliatifs doivent être proposés.
- L’éducation thérapeutique est complémentaire des traitements et peut permettre au patient d’acquérir, de maintenir des compétences dont il a besoin.
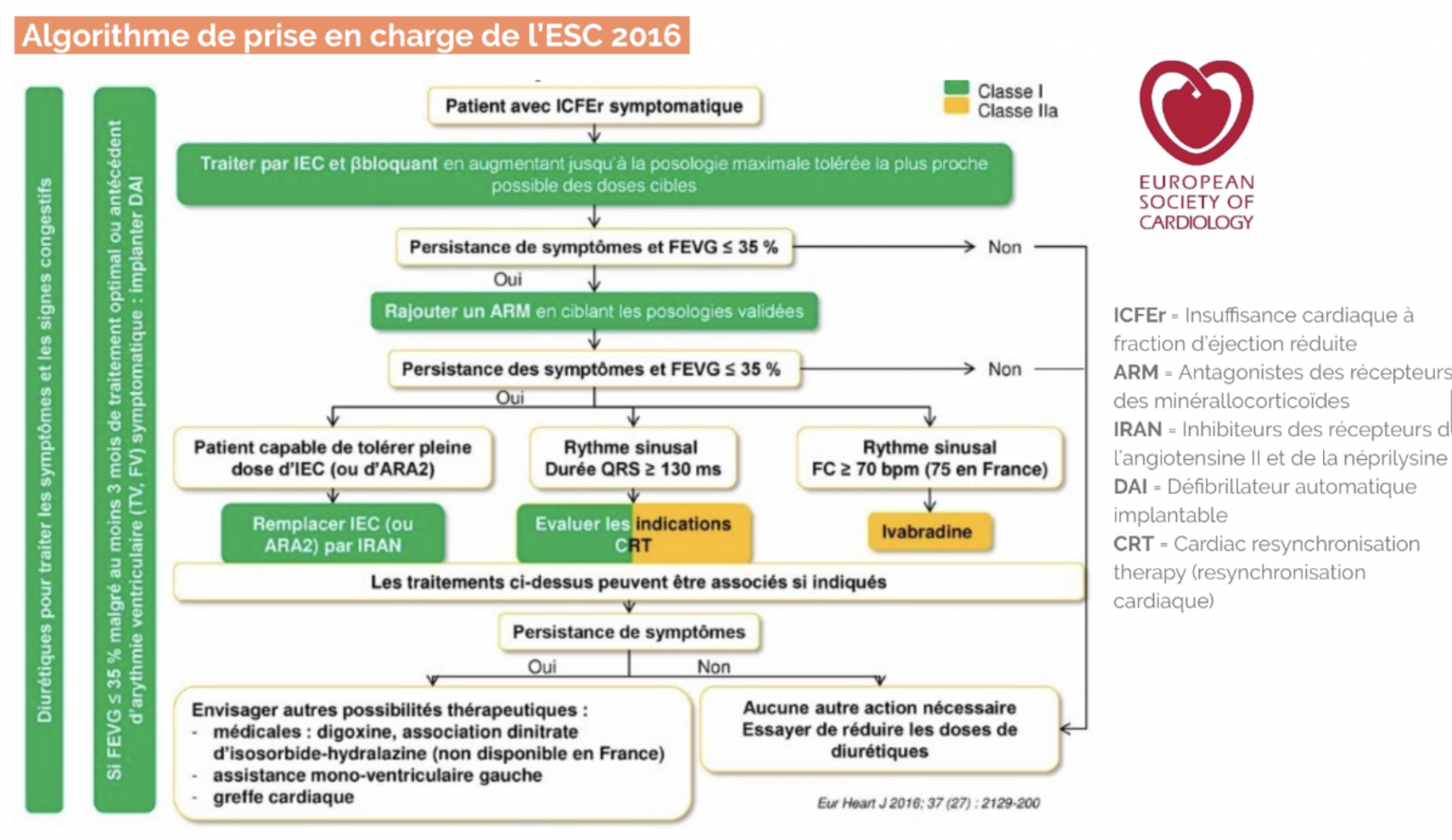
C) Traitement médicamenteux de première intention
1) Traitement de première intention
- Diurétique de l’anse + Bétabloquant + Inhibiteur de l’enzyme de conversion
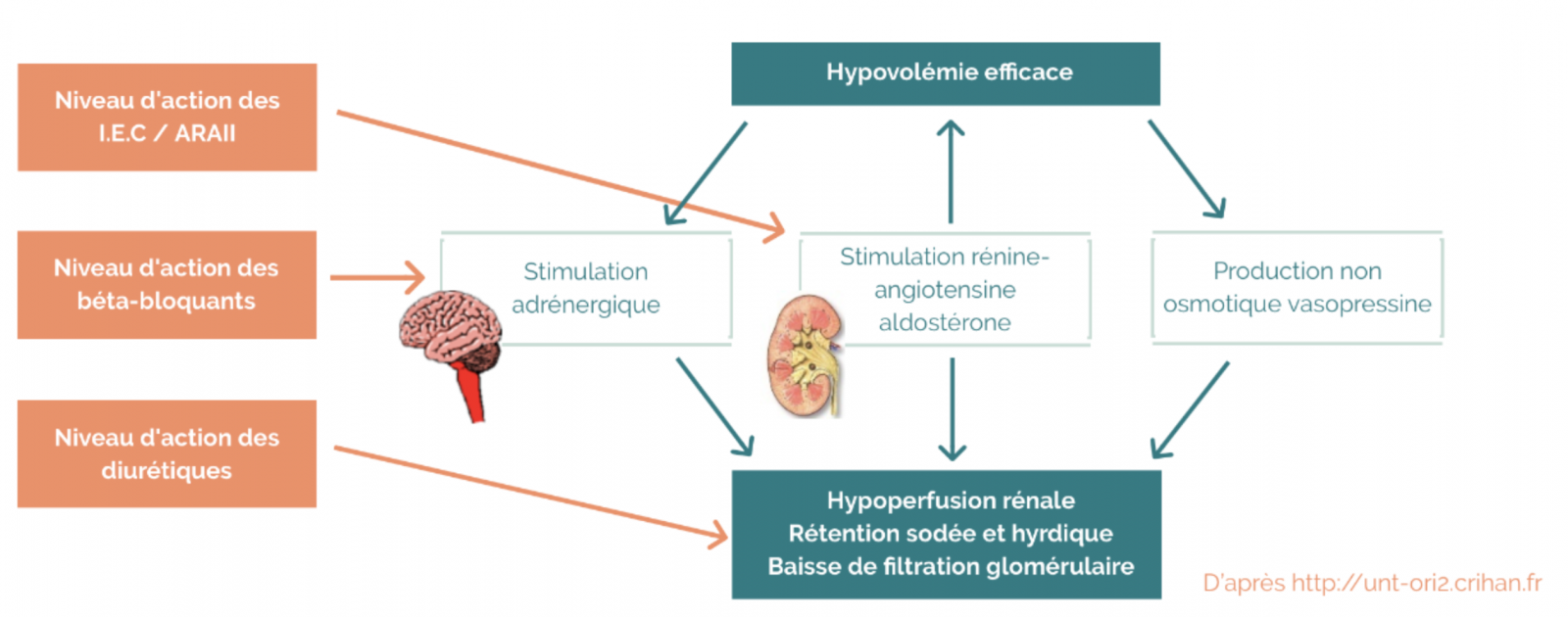
2) Cibles des traitements médicamenteux
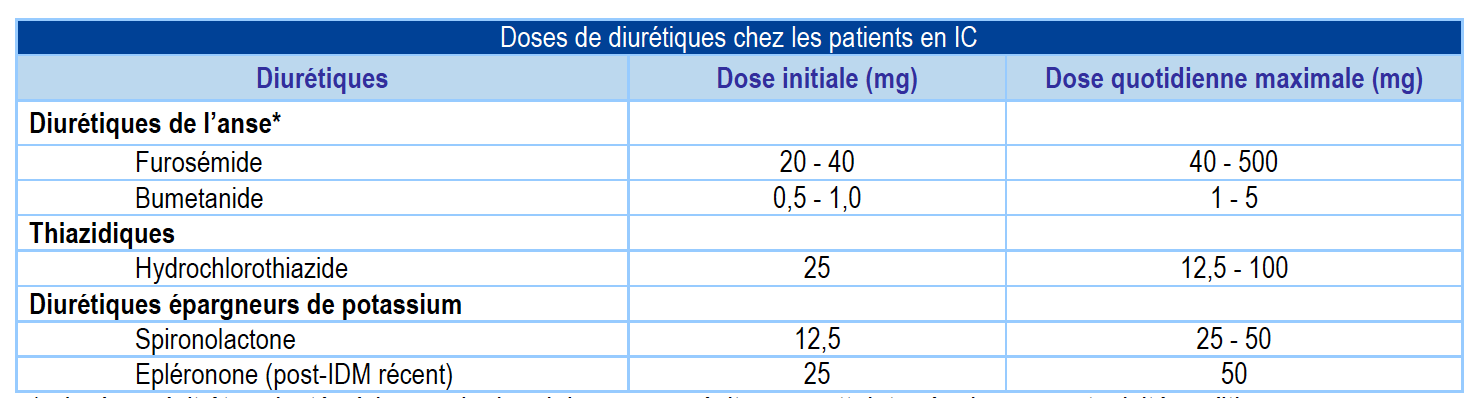
3) Diurétiques
a) Bénéfice
- Amélioration des symptômes et de la capacité fonctionnelle chez les patients présentant des signes congestifs
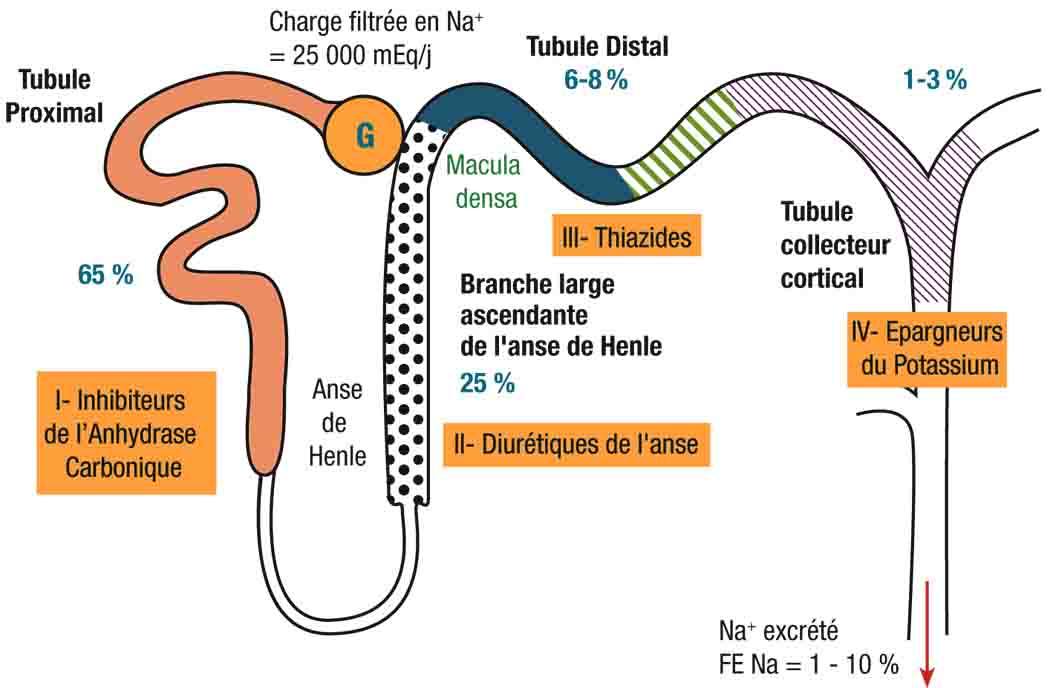
b) Diurétiques de l’anse
- Traitement de référence en cas de rétention hydrosodée.
c) Diurétiques thiazidiques
- Peuvent être prescrits en association avec les diurétiques de l’anse en cas en cas de résistance aux diurétiques (persistance de signes de rétention hydrosodée malgré de fortes doses de furosémide).
d) Posologie
- Prescrits à dose minimale efficace après régression des signes congestifs
- Dose de fond très variable selon les patients (selon la cardiopathie sous-jacente, la fonction rénale, l’observance du régime sans sel, la dose de traitement antérieure).
e) Surveillance
- kaliémie, natrémie, créatininémie 1 à 2 semaines après initiation/modification de traitement
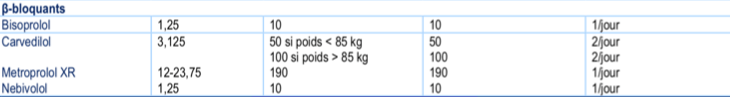
4) Bétabloquants (BB)
a) Indications
- Tous les patients avec FEVG < 40% quelle que soit la classe NYHA, introduction en état stable
b) Bénéfice
- Réduction de la mortalité et du risque d’hospitalisation pour insuffisance cardiaque, et amélioration des symptômes.
- Efficacité démontrée pour quatre molécules (carvédilol, métoprolol, bisoprolol et nébivolol).
c) Contre-indications
- BAV II ou III
- AOMI avec ischémie ischémie critique
- Asthme (CI relative : possible si asthme stable et sous surveillance rapprochée)
- BPCO instable. La BPCO stable n’est pas une contre-indication
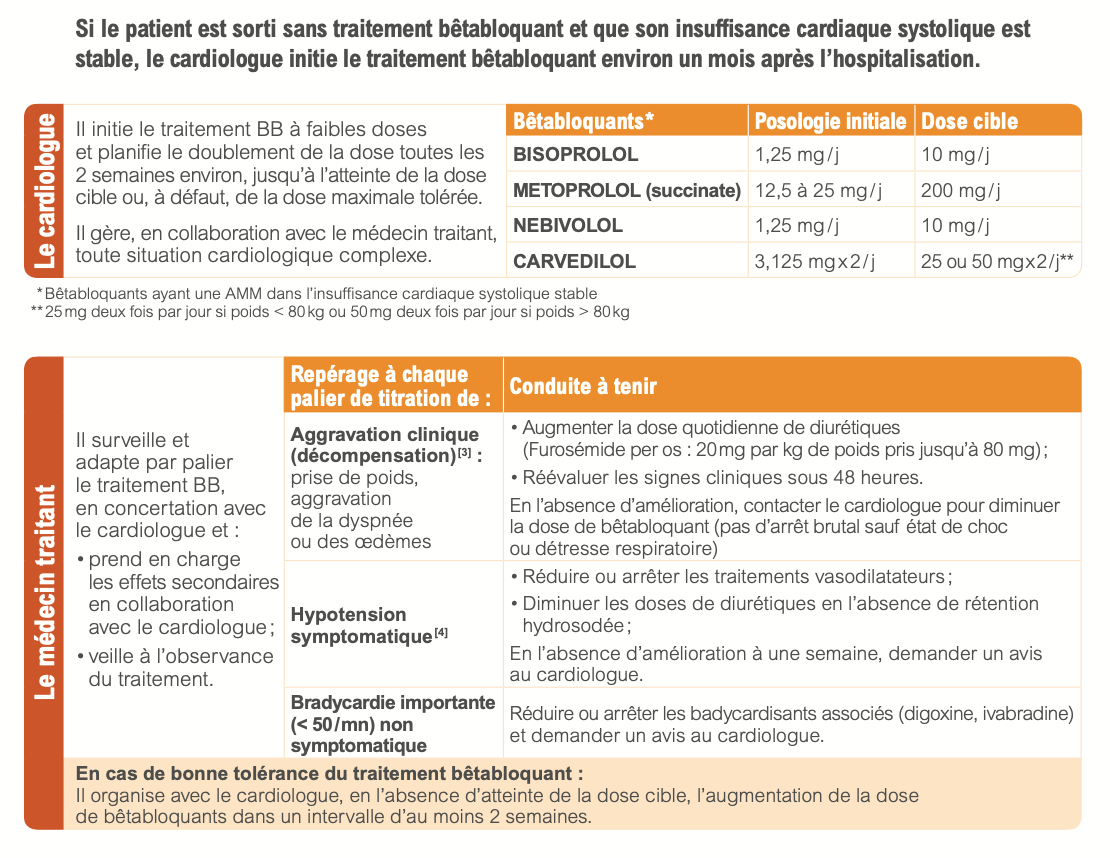
d) Posologie
- Initiation à faible posologie en état stable (en règle générale 1/8ème de la dose maximale, par exemple : 3,125 mg de carvedilol ou 1,25 mg de bisoprolol).
- Augmentation par paliers successifs, par doublement toutes les 2 semaines minimum, jusqu’à la dose cible ou à défaut, jusqu’à la dose maximale tolérée.
- En cas d’hospitalisation pour décompensation cardiaque chez un patient déjà traité par bétabloquant il n’est pas recommandé d’arrêter le bétabloquant, sauf en cas de difficulté de réponse au traitement ou d’état de choc cardiogénique.
e) Surveillance
- Fréquence cardiaque
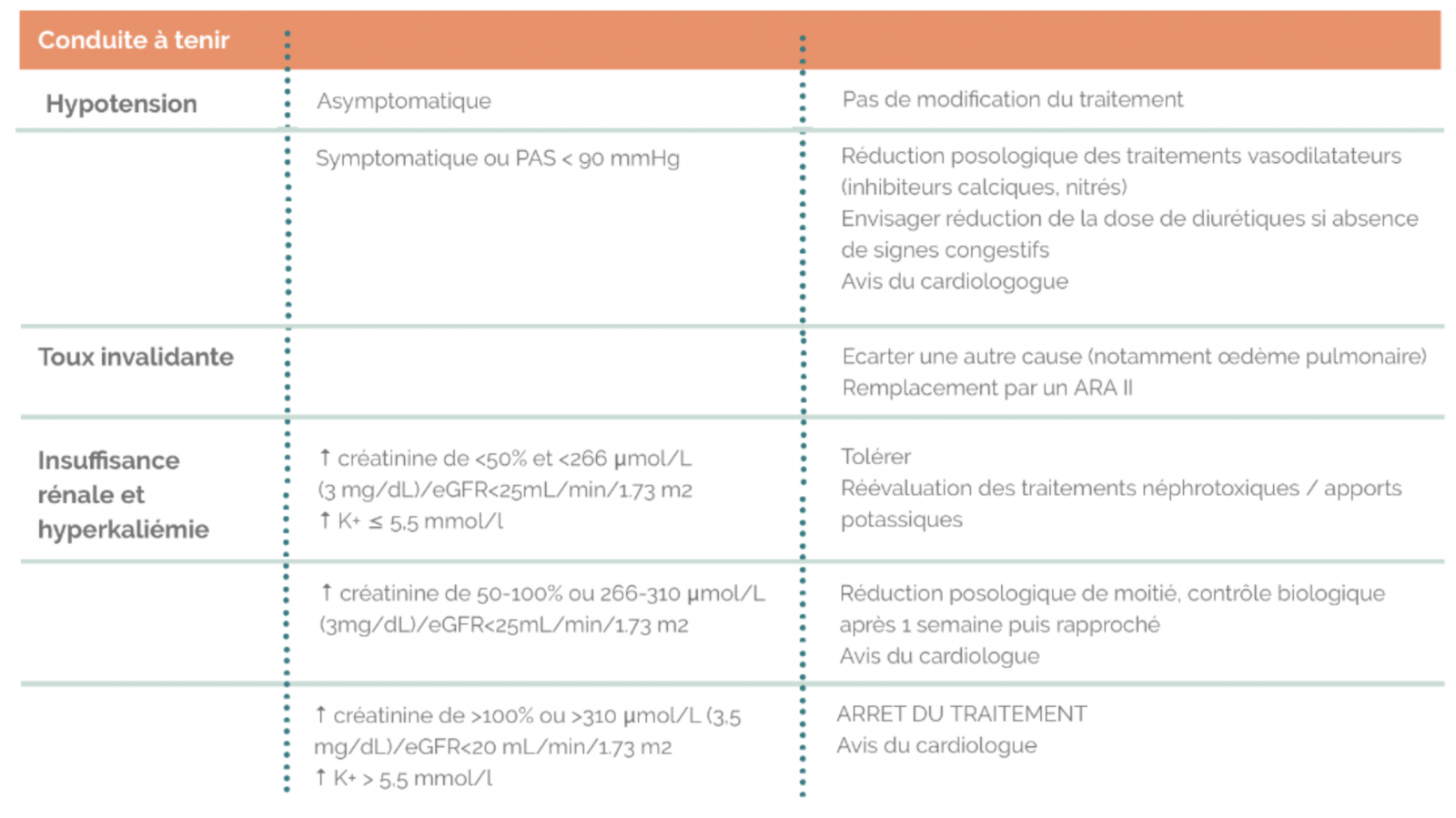
- Pression artérielle : tolérer si hypotension asymptomatique
- Symptômes : Expliquer au patient le risque de sensation temporaire d’asthénie légère lors de la titration, mais amélioration de la qualité de vie sur le long terme. Diminuer de moitié la dose bétabloquant en cas d’asthénie importante.
- En cas de mauvaise tolérance du traitement lors de la titration, après avis du cardiologue, un retour au palier antérieur sera envisage.
f) Adaptation du traitement par bétabloquant
5) Inhibiteurs de l’enzyme de conversion (IEC)
a) Bénéfices
- Réduction de la mortalité et du risque d’hospitalisation pour insuffisance cardiaque, et amélioration des symptômes
b) Indication
- Tous les patients avec FEVG < 40%, symptomatiques ou non
c) Contre-indications
- Sténose bilatérale des artères rénales
- Antécédent d’angioeodème
- Grossesse
d) Posologie
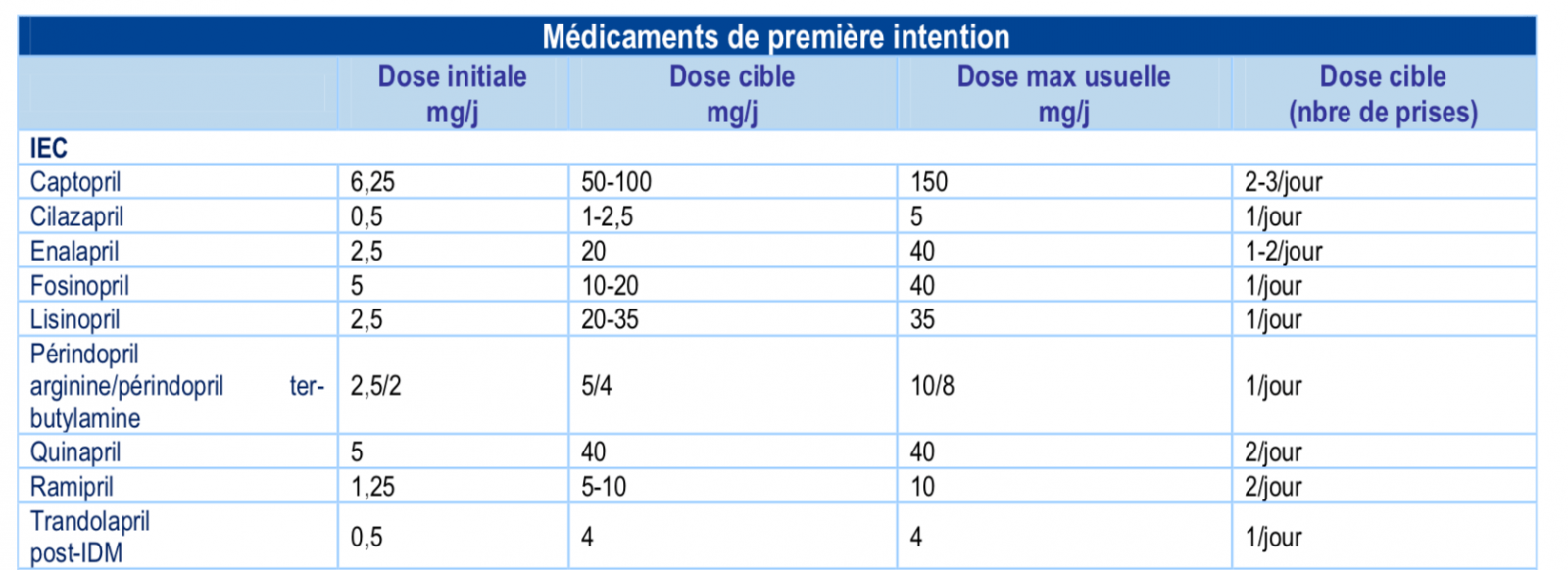
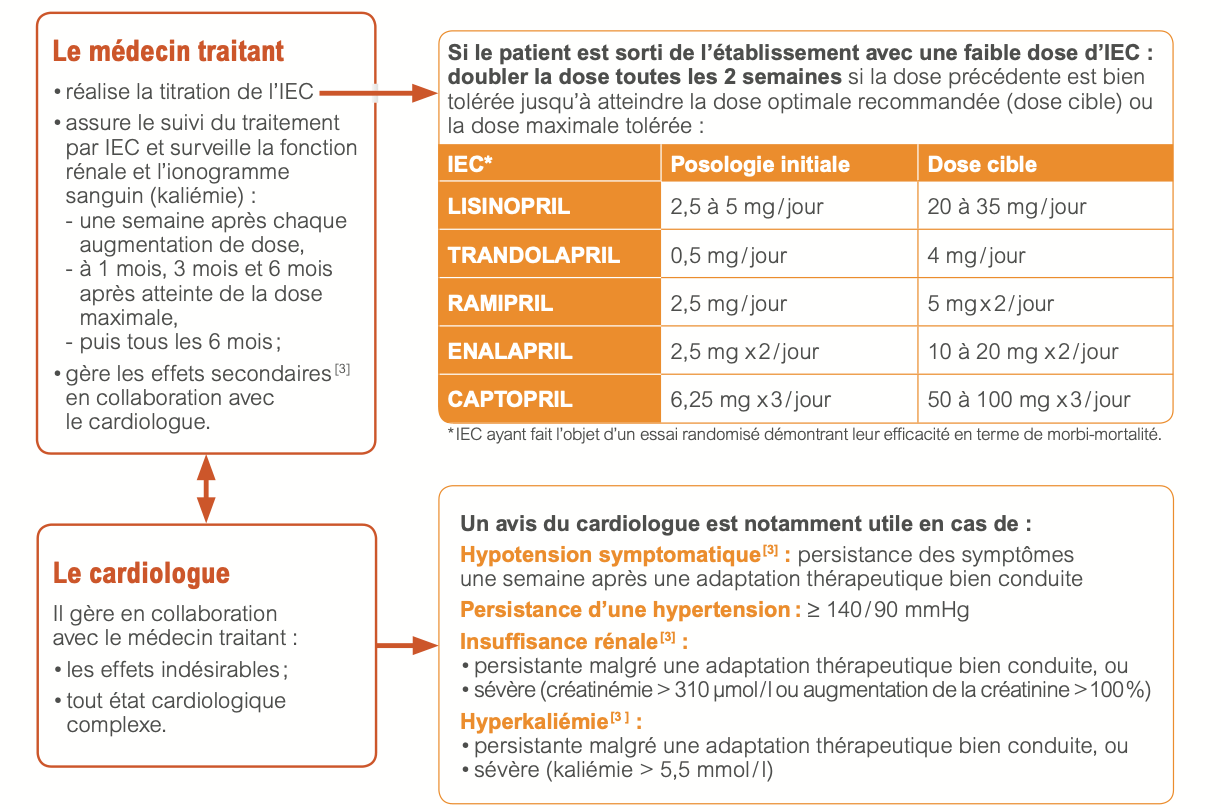
- Initiation à faible posologie en état stable.
- Augmentation par paliers successifs, par doublement toutes les 2 semaines minimum, jusqu’à la dose cible ou à défaut, jusqu’à la dose maximale tolérée.
- La dose initiale d’IEC doit être faible, en particulier en cas de PA normale ou basse au départ, d’insuffisance rénale, d’hyponatrémie, iatrogénique ou non. La dose retenue d’IEC ne devra pas faire abaisser la PAS en orthostatisme au-dessous de 90 mmHg.
e) Surveillance
- Pression artérielle
- Fonction rénale et ionogramme sanguin (kaliémie) : 1 semaine après initiation et chaque titration, à 1, 3, et 6 mois après atteinte de la dose maximale tolérée, puis tous les 6 mois
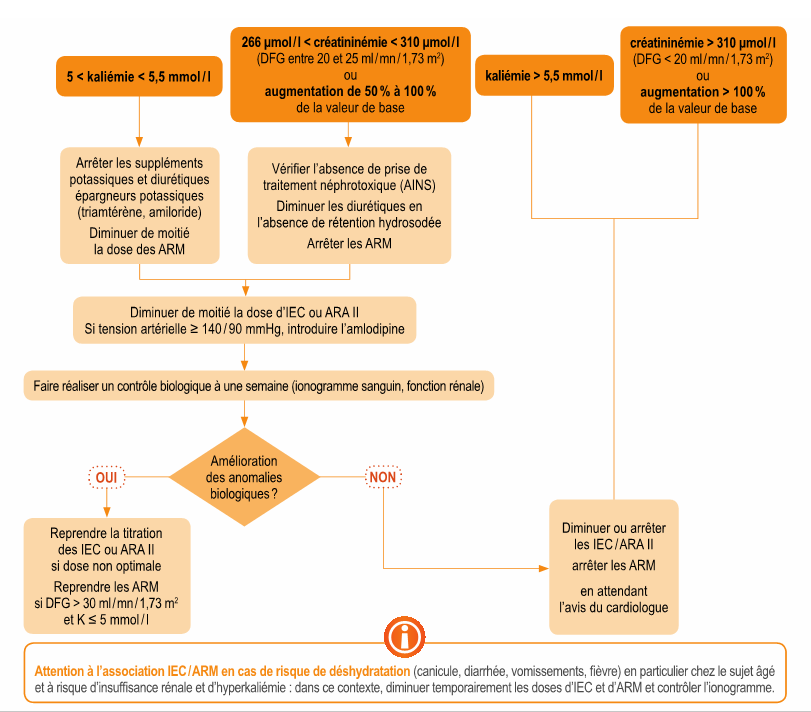
- Une augmentation modérée de la créatinine <50% et <266 μmol/L (3 mg/dL) sous traitement IEC ( ou ARAII ) est habituelle et ne nécessite pas de modification thérapeutique et autorise la poursuite du traitement IEC et diurétique. On réévaluera la prescription des autres traitements néphrotoxiques (AINS)
- Une augmentation de créatininémie de 50 à 100% sous traitement IEC impose une réduction posologique de moitié du traitement par IEC, un contrôle biologique à une semaine puis rapproché, et un avis du cardiologue en cas d’insuffisance rénale persistante.
- Une hyperkaliémie > 6mmol/l impose : l'arrêt des ARM et éventuellement des bloqueurs de système rénine-angiotensine, l'administration de chélateurs du potassium, et discuter d'une hospitalisation.
f) Adaptation du traitement par IEC
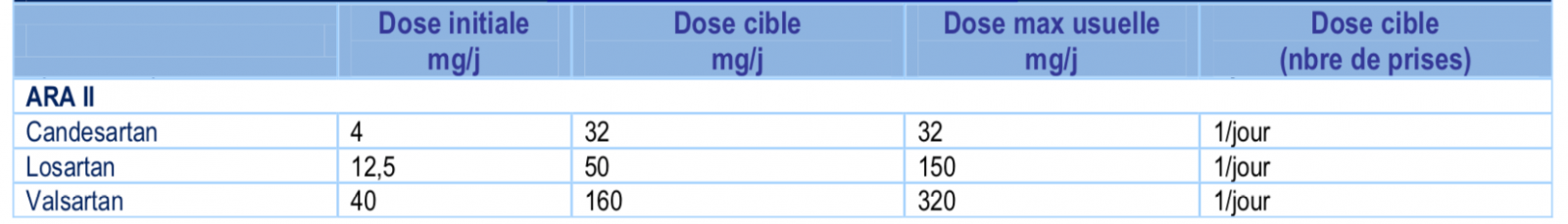
6) Antagonistes des récepteurs de l’angiotensine II (ARA II)
- Bénéfice : réduction de la mortalité, des hospitalisations pour IC, et des symptômes.
- Indication et Contre-indication : similaires aux IEC, ils sont prescrits en cas d’intolérance vraie aux IEC (toux, angioœdème). L’association IEC – ARAII est contre-indiquée.
- Surveillance : PA (absence de symptômes d’hypotension orthostatique, PAS ne doit pas être < 90mmHg en orthostatisme), Créatininémie, Kaliémie.
D) Traitement médicamenteux de seconde intention
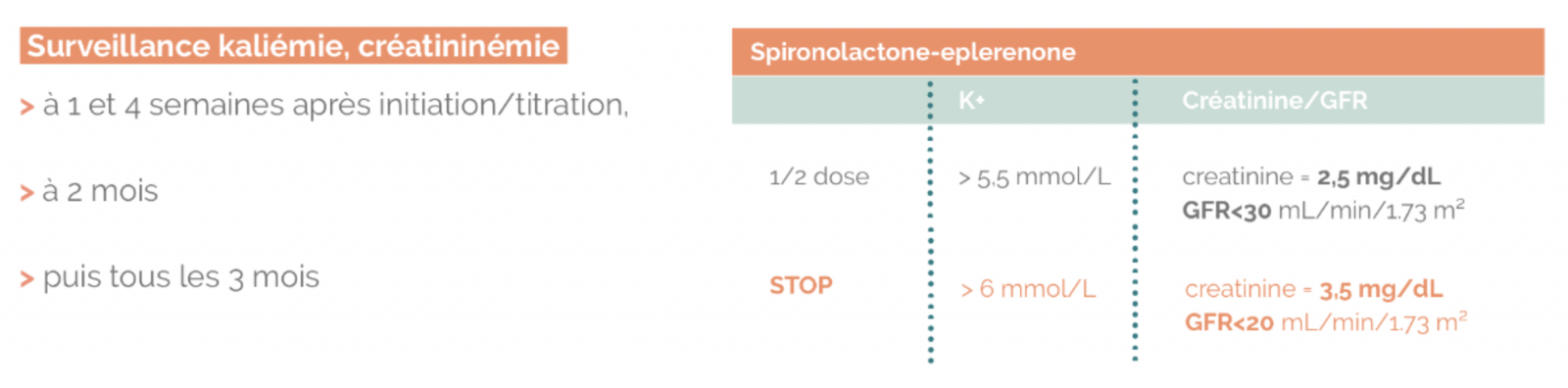
1) Antagonistes des récepteurs des minérallocorticoïdes (ARM) = « anti-aldostérone »
- Bénéfice : Réduction de la mortalité, des hospitalisations pour IC, et des symptômes
- Indication : Patients avec FEVG < 35 % restant symptomatiques sous BB et IEC ou en post-infarctus
- Précautions : Insuffisance rénale chronique avec DFG < 30 ml/min/1,73m2, hyperkaliémie. Risque d’interaction avec AINS, trimethoprime-sulfamethoxazole, suppléments K+.
- Posologie : Introduction à faible dose, titration après 4-8 semaines.

2) Inhibiteur des récepteurs de l’angiotensine II et de la néprilysine (ARNI) : Association Sacubitril + Valsartan (Entresto®).
- Sacubitril : Inhibiteur de la néprilysine (inhibe la dégradation de BNP)
- Valsartan : ARA II
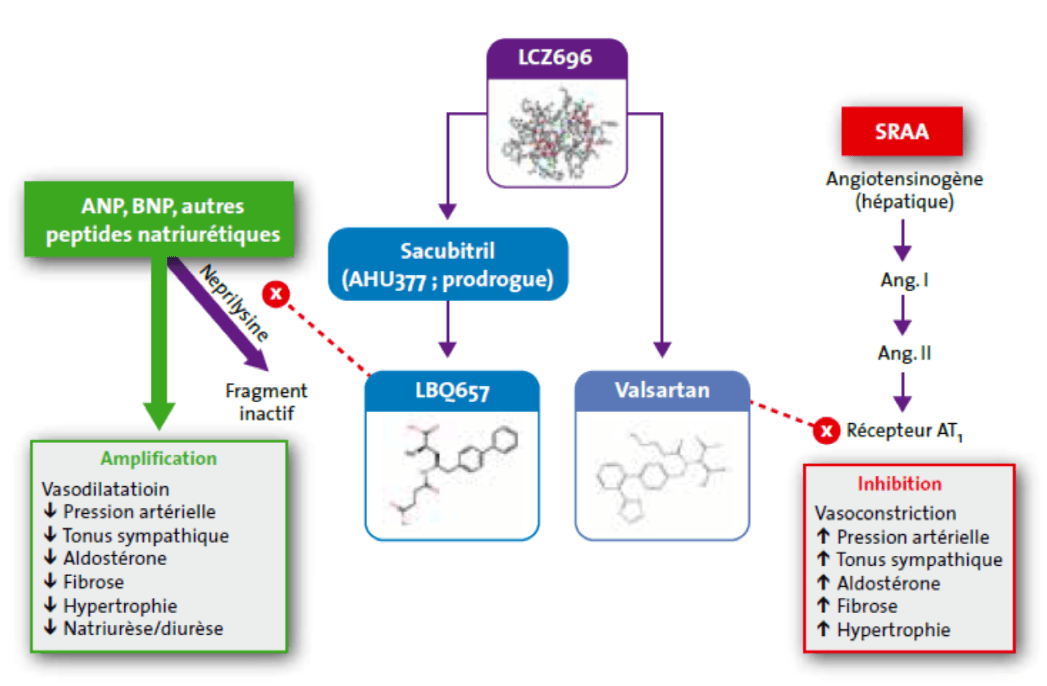
- Indication : en remplacement des IEC chez les patients avec FEVG ≤ 35% toujours symptomatiques sous traitement médical optimal (IEC, BB, ARM).
- Bénéfice démontré : réduction de la mortalité cardiovasculaire et des hospitalisations pour IC.
- Effets secondaires : hypotension artérielle fréquente, insuffisance rénale, hyperkaliémie, toux, angioœdème (CI à la prise IEC).
- Majoration attendue du taux de BNP (mécanisme d’action) : suivi du NT-proBNP. Le NT-proBNP n'est pas un substrat de la néprilysine. Sa diminution sous traitement par ARNI indique de manière fiable l'amélioration de l'état du patient. Le Sacubritil-Valsartan entraine une élévation du taux de BNP liée à son mécanisme d’action par inhibition de la néprilysine dégradant le BNP.
3) Inhibiteur des canaux If : Ivabradine (Procoralan®)
- Indication : symptômes persistants sous traitement médical (BB, IEC, anti-aldosterone) et rythme sinusal avec FC repos ≥ 70/min
- Bénéfice : réduction du risque d’hospitalisation pour IC et de la mortalité cardiovasculaire.
- Contre-indications : Conditions CV instables (SCA, AVC/AIT, hypotension sévère), IR sévère (pas de données pour DFG <15 ml/min/m2), Insuffisance hépatique, Grossesse/allaitement
- Dose initiale : 5 mg x 2/jour (2,5 mg x 3/jour si âge > 75 ans)
- Surveillance : FC : arrêt si FC<50/min ou FA
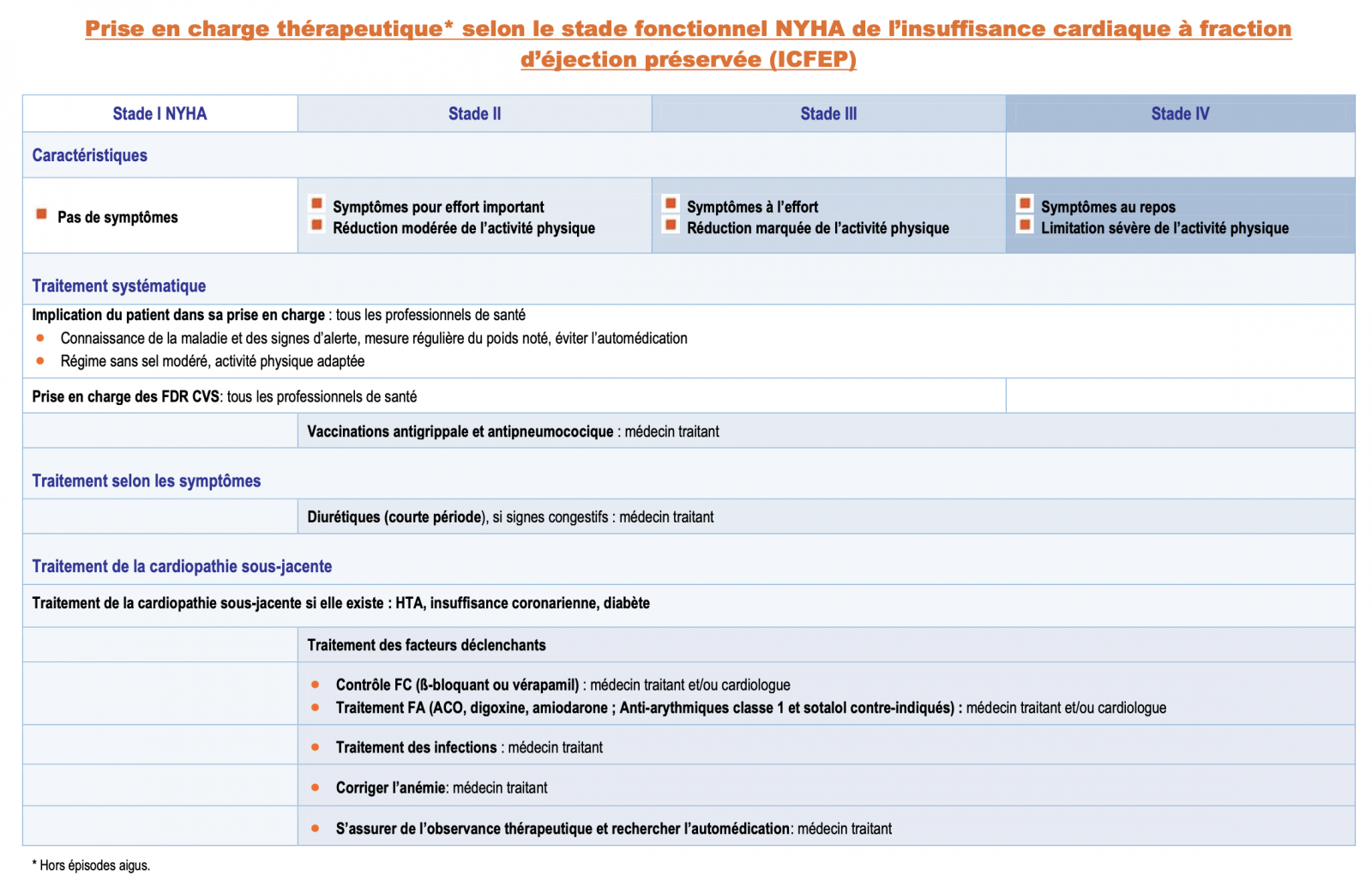
E) Insuffisance cardiaque à fraction d’éjection préservée
- Contrairement au traitement de l’IC à fonction systolique altérée, le traitement de l’IC à fonction systolique préservé est encore très mal codifié.
- Pour l’instant, il n’y a pas de traitement pour lequel il a été démontré, de façon convaincante, qu’il réduisait la morbidité et/ou la mortalité des patients.
- Cependant, parce que ces patients sont souvent âgés et très symptomatiques, et ont souvent une qualité de vie altérée, un but important du traitement est le soulagement des symptômes et l’amélioration du bien-être.
- Les diurétiques sont recommandés chez les patients qui ont de signes et symptômes de congestion, afin de diminuer ceux-ci (I, B).
Le traitement consiste à éviter les facteurs déclenchants qui sont rapidement source de décompensations dans ce type de cardiopathie, en particulier :
- les poussées hypertensives par un meilleur contrôle de la pression artérielle ;
- les épisodes de fibrillation auriculaire ou les autres troubles de rythme ;
- les surcharges volumiques (apports de solutés, examens radiologiques iodés).
F) Traitement étiologique
1) Traitement de première intention
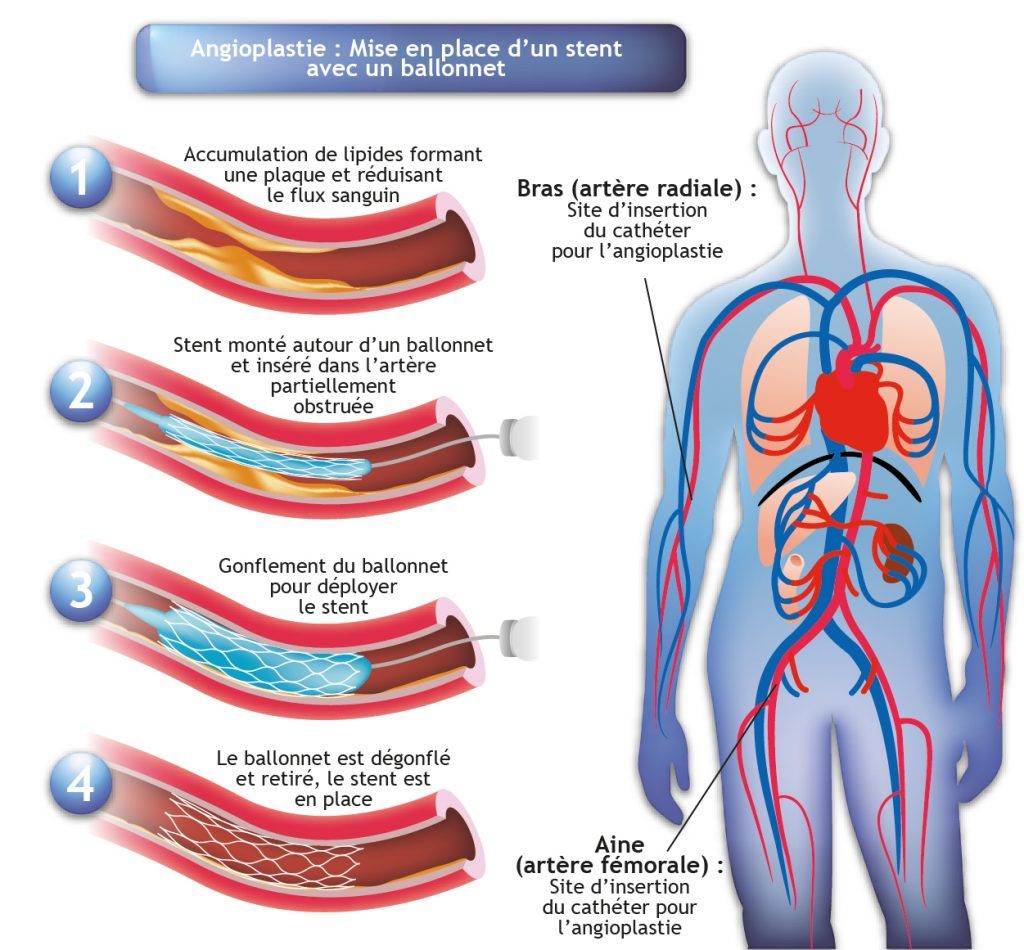
- Une revascularisation myocardique est indiquée dés lors qu’une amélioration de la fonction systolique peut être attendue (viabilité myocardique)
- Le choix entre les 2 techniques dépend de la complexité des lésions coronaires et du risque chirurgical : Angioplastie coronaire percutanée réalisée à la suite d’une coronarographie ou pontage aorto-coronarien réalisée sous circulation extra-corporelle.
2) Cardiopathie valvulaire
- Un remplacement valvulaire est indiqué en cas de valvulopathie sévère et symptomatique ou ayant un retentissement sur la fonction VG.
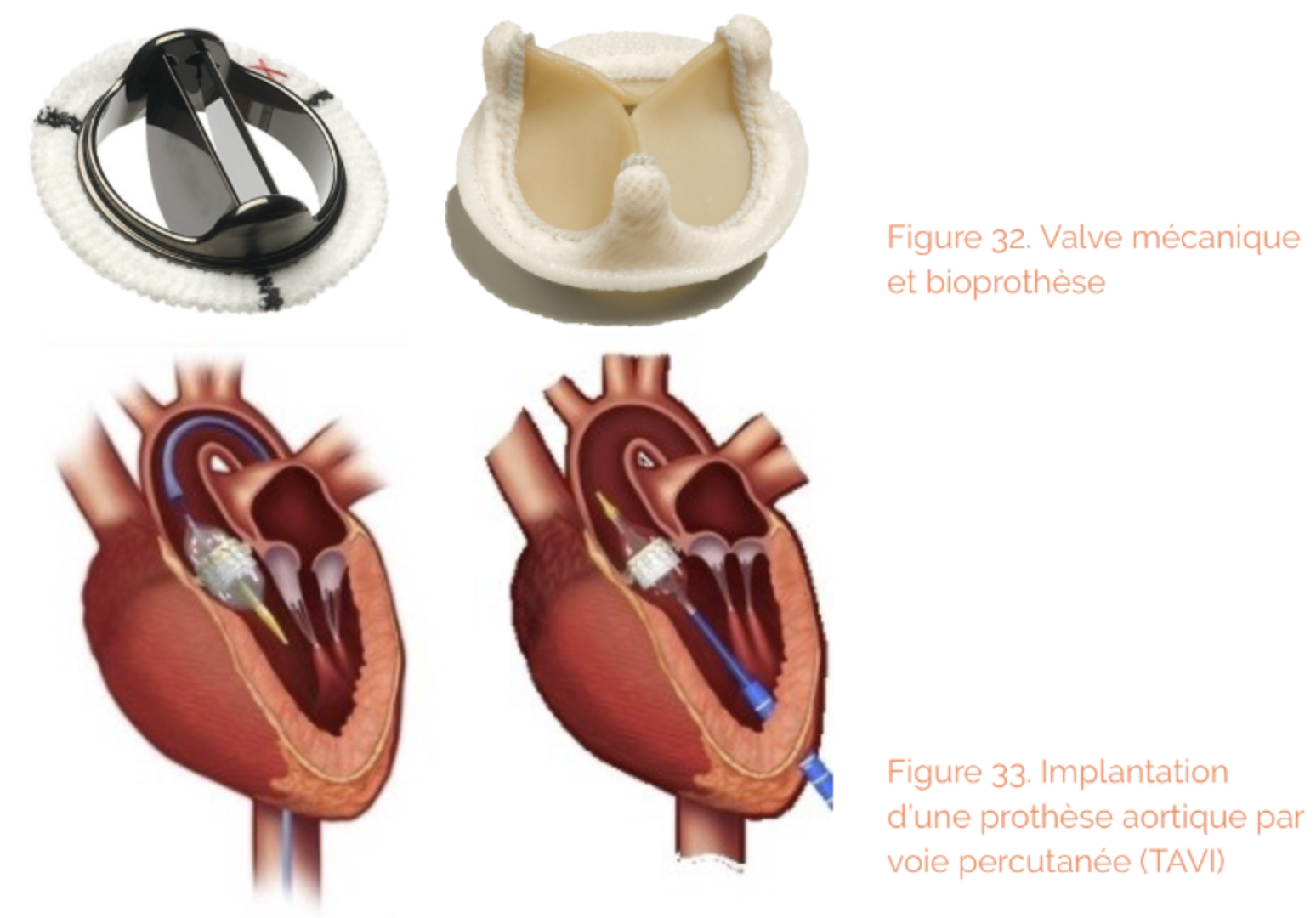
- 2 techniques sont la aussi possibles et leur choix dépend principalement du risque opératoire : Chirurgie conventionnelle (implantation d’une vale mécanique ou d’une bioprothèse sous circulation extracorporelle) et remplacement valvulaire par voie per-cutanée (implantation d’une bioprothèse par voie endovasculaire).
G) Défibrillation et resynchronisation
1) Défibrillateur automatique implantable (DAI)
a) Bénéfice
- Réduction du risque de mort subite et de la mortalité toute cause
b) Prévention secondaire :
- arythmie ventriculaire causant une instabilité hémodynamique ou mort subite par trouble du rythme ventriculaire
- et espérance de vie (avec qualité de vie acceptable) > 1 an
c) Prévention primaire :
- IC symptomatique (NYHA II-III)
- et FEVG ≤ 35% malgré ≥ 3 mois de traitement médical optimal (au moins 40 jours post IDM)
- et espérance de vie (avec qualité de vie acceptable) > 1 an
d) Peuvent associer une thérapie de resynchronisation
e) Implantation de DAI : détail des recommandations ESC 2016
+ En prévention secondaire :
- La pose d’un DAI est recommandée afin de réduire les risques de mort subite et de décès de toutes causes chez les patients qui ont souffert par le passé d’une arythmie ventriculaire ayant entraîné une instabilité hémodynamique et qui ont une espérance de vie en bonne santé d’au moins 1 an (I, A)
- Un défibrillateur cardiaque externe portable (comme un gilet défibrillateur) peut être envisagé pendant un temps limité chez les patints en IC exposés au risque de mort subite ou dans l’attente de la pose d’un DAI (IIb, C).
+ En prévention primaire :
- La pose d’un DAI est recommandée afin de réduire les risques de mort subite et de décès de toutes causes chez les patients qui ont une IC symptomatique (classe NYHA II-III) et une FEVG ≤ 35 % malgré au moins 3 mois de TMO, à condition que leur espérance de vie en bonne santé soit nettement supérieure à 1 an et qu’ils soient atteints de : maladie coronaire (sauf s’ils ont eu un IDM il y a moins de 40 jours) (I, A) ou CMD (I, B).
- La pose d’un DAI moins de 40 jours après un IDM n’est pas recommandée parce qu’une implantation aussi précoce n’améliorerait pas le pronostic (III, A).
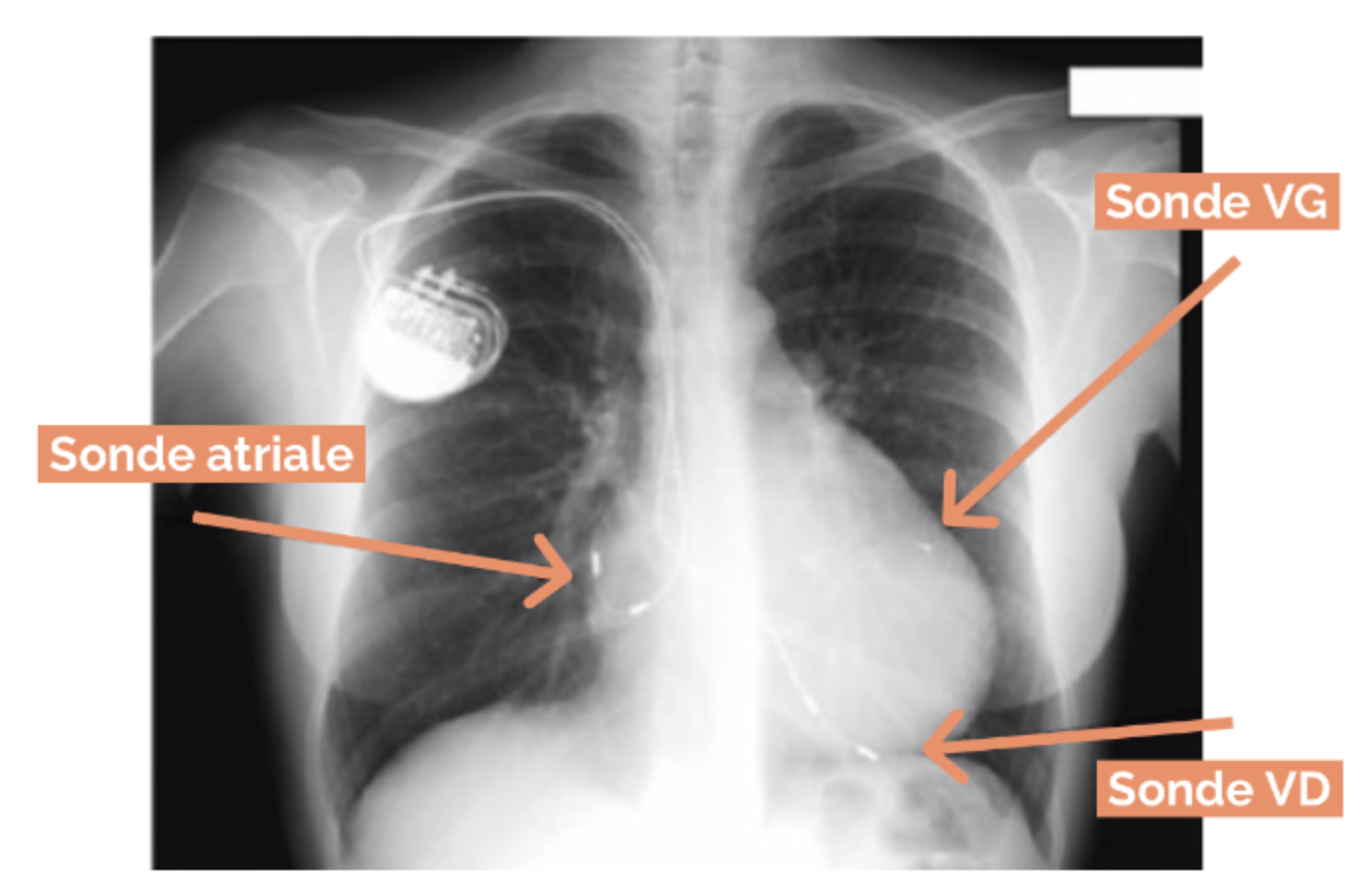
2) Resynchronisation biventriculaire
Resynchronisation des 2 ventricules par une sonde placée dans le VD et une sonde placée dans le sinus coronaire stimulant le VG.
a) Indications
- Patients restant symptomatiques malgré un traitement médical optimal, avec QRS > 120 ms et FEVG ≤ 35 %.
- Réservée aux équipes médicales expérimentées autorisées à pratiquer cette activité.
b) Resynchronisation : détail des recommandations ESC 2016
+ La resynchronisation est recommandée :
- chez les patients en IC, symptomatiques, en rythme sinusal (RS), avec une durée de QRS ≥ 150 ms, une morphologie de QRS caractéristique d’un BBG et une FEVG ≤ 35% malgré un traitement médical optimal (TMO), afin de diminuer les symptômes, la morbidité et la mortalité (I, A).
- chez les patients en IC, symptomatiques, en RS, avec une durée de QRS de 130-149ms, une morphologie de QRS caractéristique d’un BBG et une FEVG ≤ 35 %, malgré un TMO, afin de diminuer les symptômes, la morbidité et la mortalité (I, B)
+ La resynchronisation doit être envisagée :
- chez les patients en IC, symptomatiques, en RS, avec une durée de QRS ≥ 150 ms, une FEVG ≤ 35 % mais pas de morphologie de QRS caractéristique d’un BBG, malgré un TMO, afin de diminuer les symptômes, la morbidité et la mortalité (IIa, B).
- chez les patients en classe NYHA III-IV avec une FEVG ≤ 35 % malgré un TMO, s’ils sont en FA et si la durée de QRS est ≥ 130 ms, afin de diminuer les symptômes, la morbidité et la mortalité, et à condition qu’une stratégie de traitement pour assurer la capture biventriculaire soit en place ou que l’on s’attende à ce que le RS se rétablisse (IIa, B).
3) Transplantation cardiaque et assistance ventriculaire de longue durée
a) Transplantation cardiaque
- Les indications de la greffe sont l’IC sévère définie par de symptômes invalidants, un mauvais pronostic et l’absence d’autre alternative thérapeutique (ce qui suppose que le traitement médical et non médical soit considéré comme maximal et optimal). Cela suppose que le patient soit motivé et capable de suivre le traitement immunosuppresseur en postgreffe.
- Les complications de la greffe sont liées aux épisodes de rejet, aux effets secondaires des immunosuppresseurs (infection, cancers, HTA, insuffisance rénale) et à la maladie coronaire du greffon (sorte d’athérome coronaire précoce et diffus) pouvant entraîner à terme un dysfonctionnement du greffon.

b) Systèmes d’assistance ventriculaire de longue durée
Des progrès importants ont été faits dans ce domaine avec l’apparition de dispositifs de plus en plus petits et de plus en plus fiables.
On distingue :
- les systèmes qui permettent une assistance de courte durée (type ECMO : extracorporeal membrane oxygenation),
- les systèmes permettant une assistance de plus longue durée (mono- ou biventriculaire).Ces systèmes sont mis en place en attente d’une greffe cardiaque, lorsque l’état du patient ne permet pas l’attente d’un greffon compatible disponible. Ils peuvent également être envisagés comme traitement définitif chez un patient ne relevant pas de la greffe cardiaque.
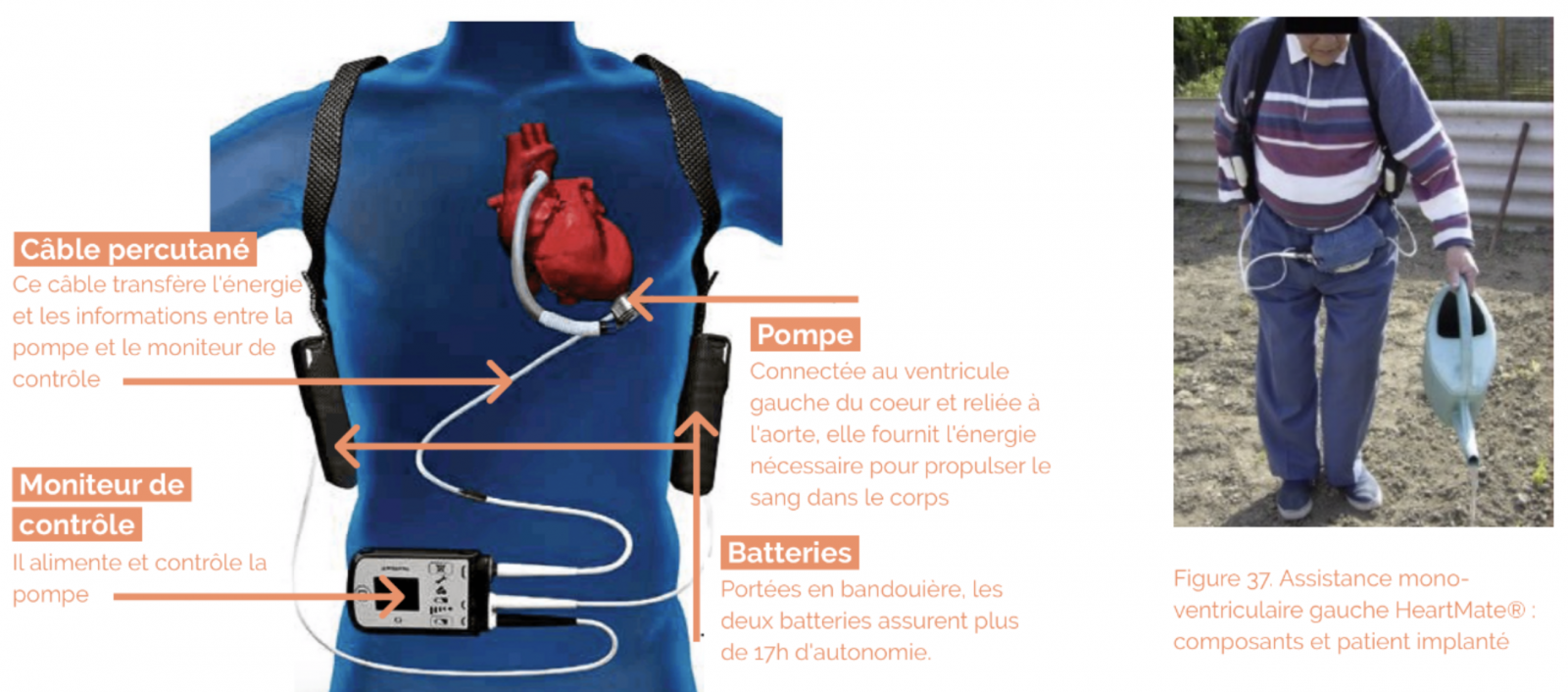
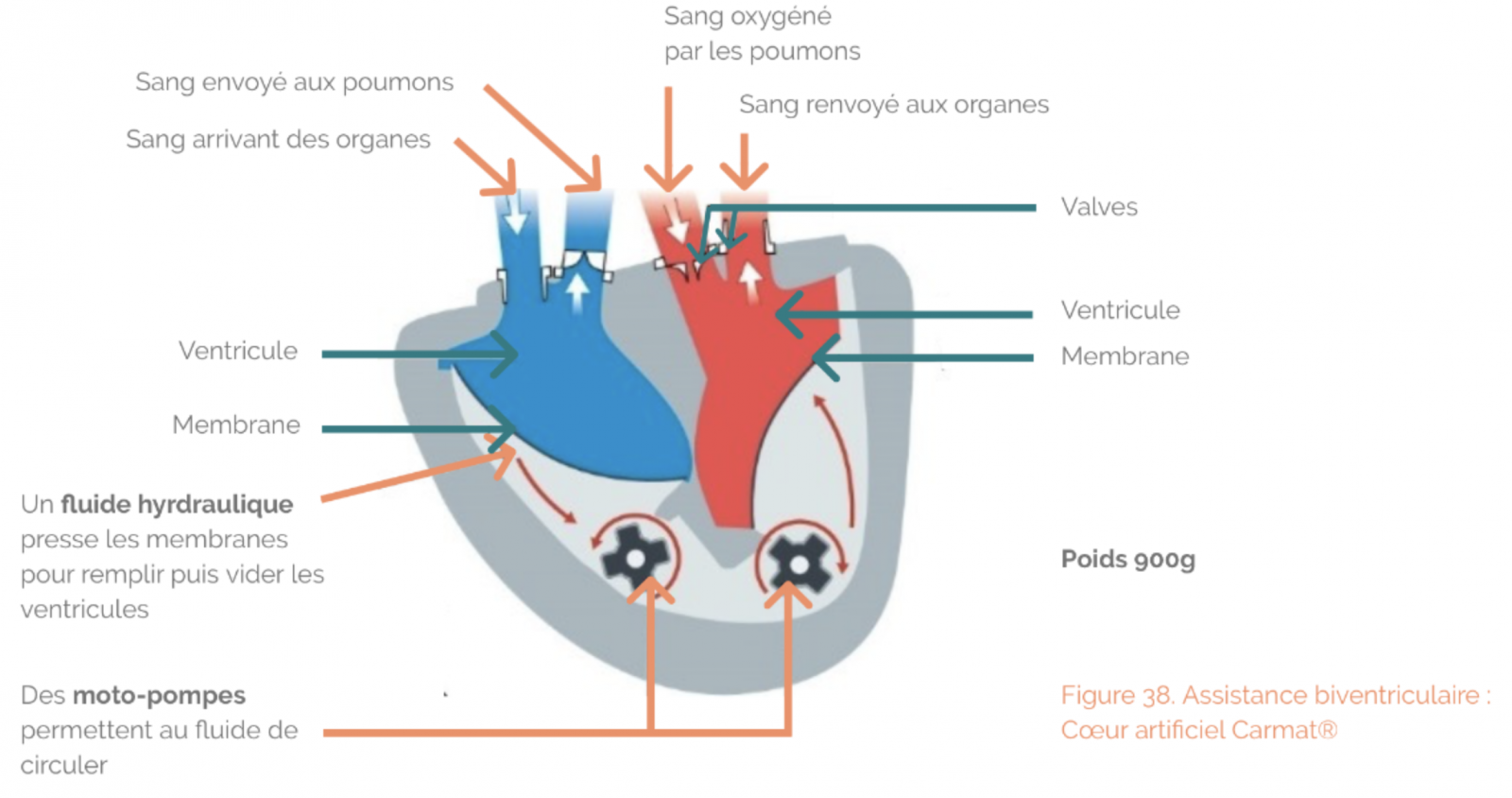
Les critères devant faire discuter une assistance ventriculaire gauche de longue durée sont les suivants :
- Patients présentant des symptôme sévères depuis plus de 2 mois malgré un traitement adéquat (traitement pharmacologique et dispositif médical)
- et qui remplissent au moins deux des conditions suivantes :
- FEVG < 25 % et, si mesurée, VO2max 12 ml/kg/min.
- ≥ 3 hospitalisations pour IC au cours des 12 derniers mois sans facteur déclenchant clairement établi.
- Dépendance aux inotropes IV.
- Défaillance progressive des organes cibles (aggravation de la fonction rénale et/ou hépatique) due à une hypoperfusion et non à une pression de remplissage ventriculaire inadéquate (pression capillaire ≥ 20 mm Hg et PA systolique ≤ 80-90 mm Hg ou index cardiaque ≤ 2 L/min/m2).
- Absence de dysfonction ventriculaire droite sévère et de régurgitation tricuspide sévère.
H) Traitement des comorbidités
Les comorbidités :
- interfèrent avec le processus diagnostique de l’IC (BPCO possible cause de dyspnée).
- aggravent les symptômes d’IC et altèrent la qualité de vie du patient.
- contribuent à l’augmentation du nombre d’hospitalisations et du taux de mortalité.
- Certains médicaments utilisés dans le traitement des comorbidités peuvent entraîner une aggravation de l’IC (AINS, chimiothérapies..).
- L’efficacité et l’innocuité du traitement peuvent ête réduites et des effets secondaires peuvent apparaître à cause d’interactions entre les médicaments utilisés dans le traitement de l’IC et ceux utilisés dans le traitement des comorbidités (interaction entre BB et bêta-agonistes utiisés dans le traitement de l’asthme et de la BPCO)
1) Hypertension artérielle
a) Étape 1 :
- Un IEC (ou un ARAII), un BB ou un ARM (ou une association de ces médicaments) est recommandé pour réduire la PA, respectivement en tant que traitement de première, deuxième et troisième intention, à cause de leur impact positif sur l’IC-FEA (réduction du risque de décès ou d’hospitalisation pour IC). Ils peuvent aussi être utilisés sans danger en cas d’IC-FEP (I, A).
b) Étape 2 :
- Un diurétique thiazidique est recommandé pou réduire la PA si l’HTA persiste malgré un traitement par l’association d’un IEC (ou d’un ARAII, alternativement mais PAS associé à un IEC), d’un BB et d’un ARM (I, C).
c) Étape 3 :
- L’amlodipine ou l’hydralazine sont recommandées pour réduire la PA si l’HTA persiste malgré un traitement par l’association d’un IEC (ou d’un ARAII, alternativement mais PAS associé à un IEC), d’un BB, d’un ARM et d’un diurétique (I, A)
Médicaments non recommandés :
- La moxonidine (augmentation de la mortalité).
- Les alphabloquants (risque d’activation neuro-hormonale, rétention liquidienne, aggravation de l’IC).
- Le diltiazem et le vérapamil (effet inotrope négatif et risque d’aggravation de l’IC qui leur est associé)
2) Diabète
- Metformine en première intention, sauf insuffisance rénale sévère ou insuffisance hépatique
- Sulfamides avec précaution en raison du risque d’aggravation de l’insuffisance cardiaque
- Glitazone non recommandée.
3) Fibrillation atriale
La FA est l’arythmie la plus fréquente dans l’IC, quelle que soit la FEVG. Elle augmente le risque d’événemens thromboemboliques et peut aggraver les symptômes d’IC.
En cas de FA, il faut :
- identifier les causes potentiellement corrigibles (hyperthyroïdie, désordre électrolytiques…) et les facteurs précipitants (intervention chirurgicale récente, infection…).
- évaluer le risque d’AVC et l’indication d’anticoagulation.
- évaluer la fréquence ventriculaire et le besoin de contrôle de la fréquence cardiaque.
Les indications du traitement anticoagulant oral :
- sont indentiques que chez le patient non insuffisant cardiaque
- évaluation du risque thrombotique (score CHADS VASc) et du risque hémoragique (score HASBLED)
- antivitamine K (AVK) ou autres anticoagulants oraux (ACO) indiqués dans la FA.
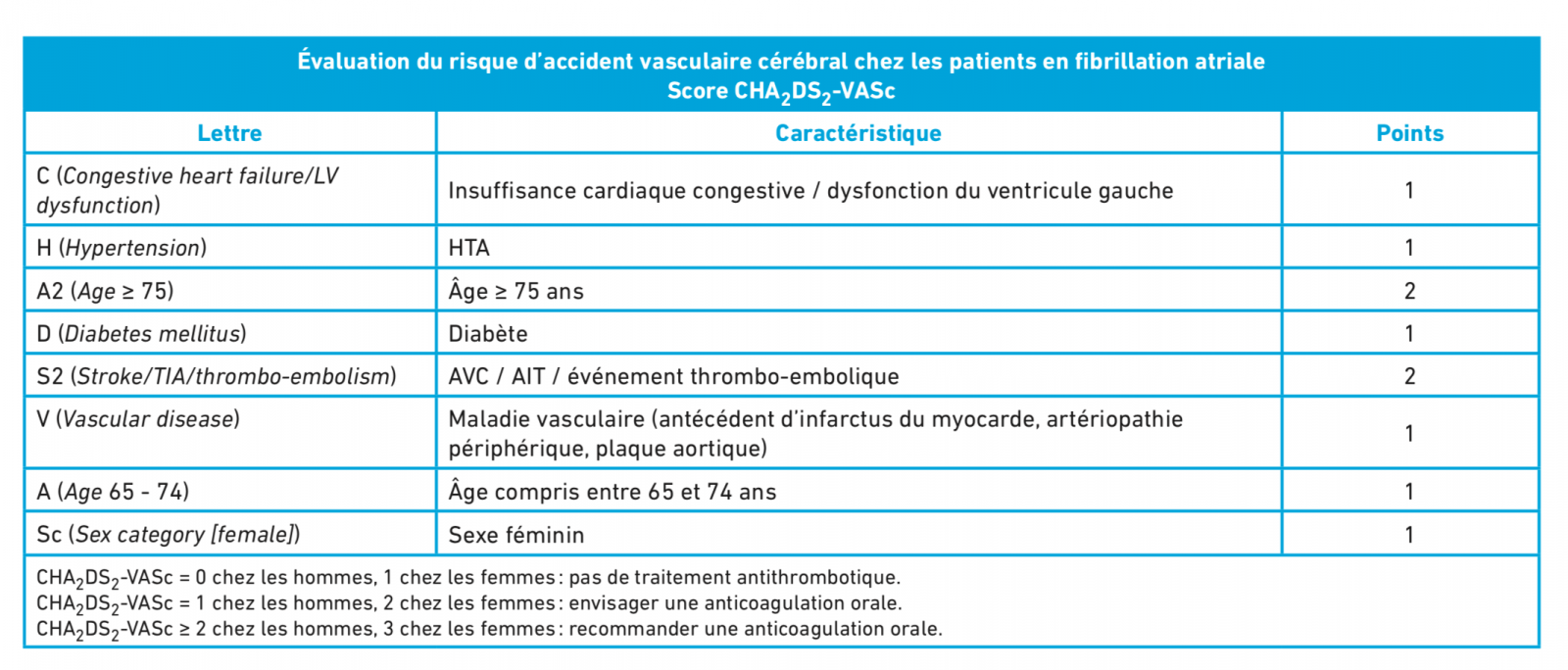
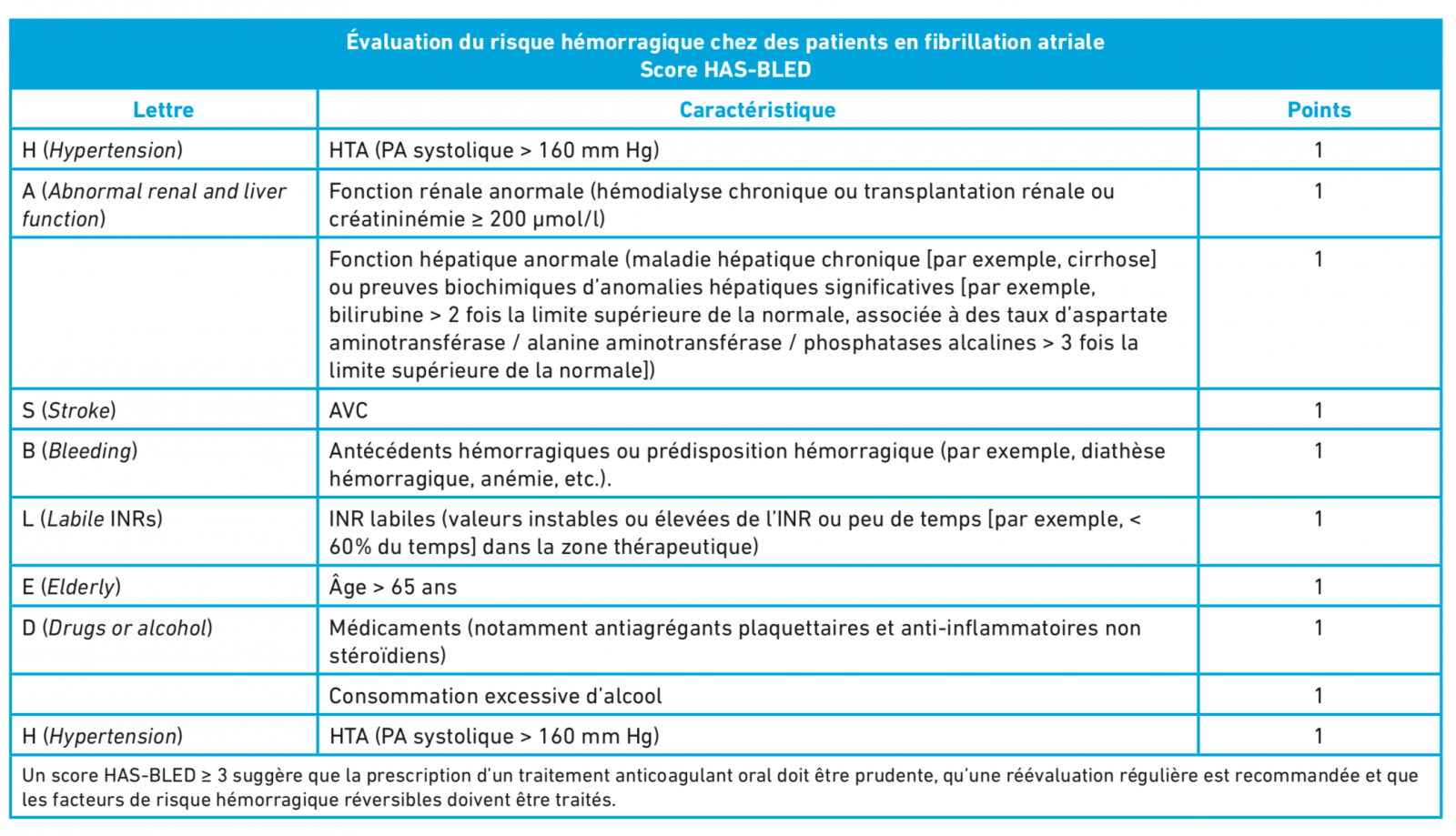
En cas d’insuffisance cardiaque à FE altérée : Traitement bradycardisant
- Bétabloquant au long cours
- En cas de FA rapide mal tolérée, la digoxine peut être utilisée initialement pour contrôler la fréquence cardiaque
Traitement antiarythmique
- Amiodarone seul antiarythmique autorisé en cas d’IC
- Contre-indication des antiarythmiques de classe Ic (Flecaïne) et du Sotalol
- Envisager une procédure d’ablation
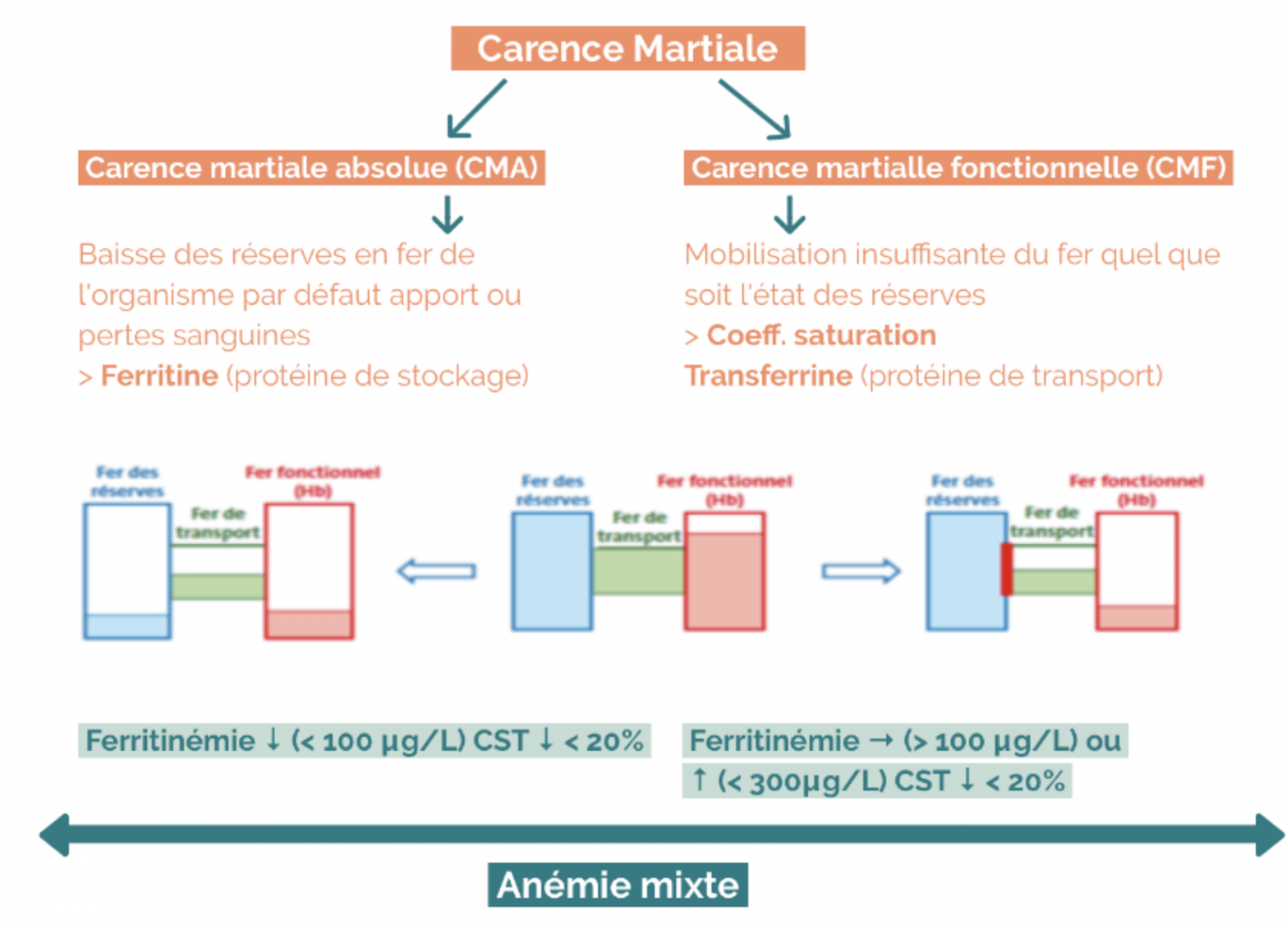
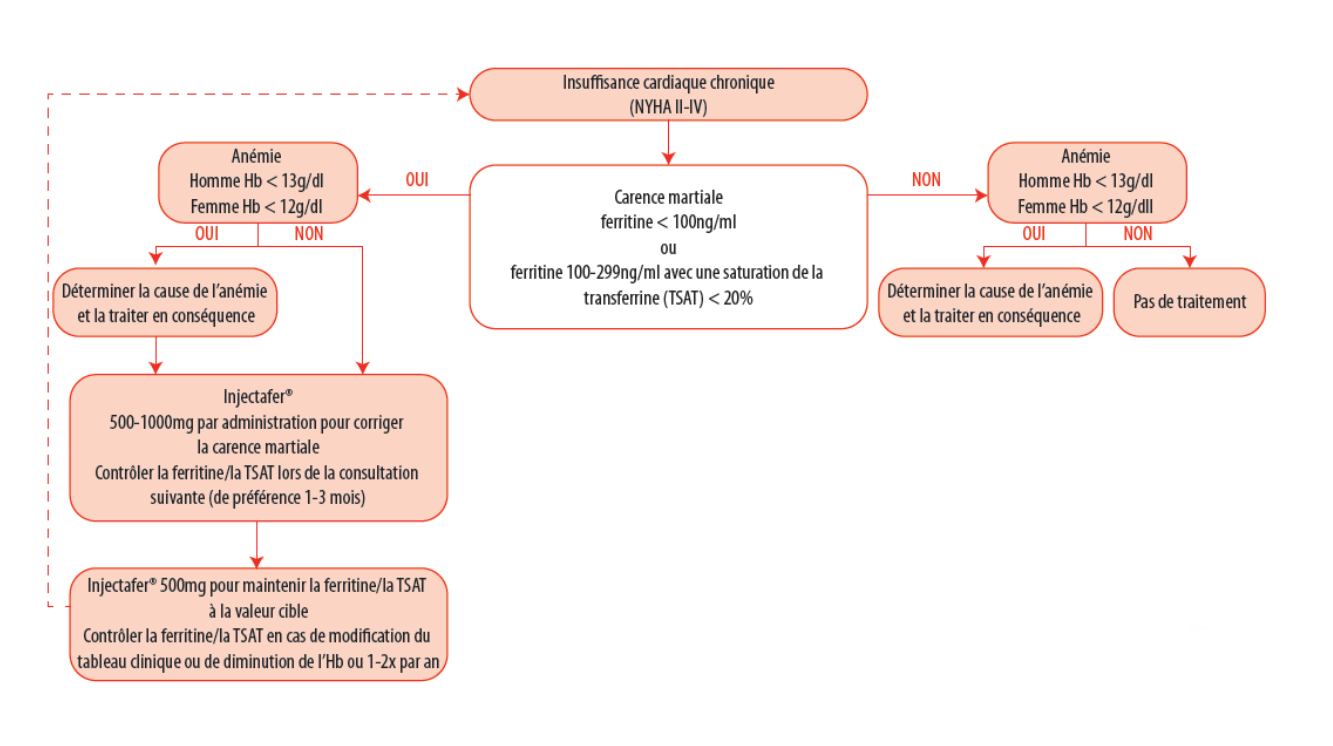
4) Carence martiale
- Le déficit en fer est fréquent dans l’IC et est associé à un pronostic moins bon, quel que soit le statut anémique ou non.
- Il a été démontré que le carboxymaltose ferrique en intraveineux améliore les symptômes d’IC, la qualité de vie, et la capacité d’effort chez les patients qui ont une IC à FEVG altérée et un déficit en fer.
.png)
Supplémentation ferrique intraveineuse :
- Indiquée dans l’IC à FE altérée si carence martiale définie par ferritine < 100 µg/l ou ferritine 100-299 µg/l et CST<20%.
- Améliore les symptômes d’insuffisance cardiaque, la capacité d’exercice et la qualité de vie.
Education thérapeutique
A) Acteurs de l’éducation thérapeutique
- Tous les professionnels de santé accompagnent le patient dans la prise en charge de sa maladie et lui délivrent conseils et éléments d’information.
- Médecin traitant
- Médecin cardiologue
- Infirmières
- Diététicienne
- Équipe multiprofessionnelle formée à l’éducation thérapeutique, lorsque l’apprentissage des compétences par le patient nécessite l’intervention d’emblée d’autres professionnels : rôle de la réadaptation cardiovasculaire.
B) Objectifs de l’éducation thérapeutique
Le médecin traitant convient d’objectifs partagés, en lien avec le cardiologue et les soignants concernés, avec le patient et son entourage.
Faire acquérir au patient (en lien avec son entourage) des compétences lui permettant de gérer sa maladie, de réaliser lui-même les gestes liés aux soins, de prévenir les complications évitables et de s’adapter à sa situation :
- Connaître la maladie et ses répercussions sur la vie quotidienne, les bénéfices des traitements non pharmacologiques et pharmacologiques sur l’évolution de la maladie,
- Connaître les médicaments à éviter.
- Connaître les signes de décompensations, formation à l’autosurveillance du poids, de la pression artérielle et de la fréquence cardiaque.
Adaptation du mode de vie :
- Règles hygiéno-diététiques
- Activité physique
- Conseils pour la vie quotidienne
C) Education thérapeutique
1) Les différentes étapes
a) Étape 1 : Elaborer un diagnostic éducatif
- Connaître le patient, identifier ses besoins, ses attentes et sa réceptivité à la proposition de l’ETP.
- Appréhender les différents aspects de la vie et de la personnalité du patient, évaluer ses potentialités, prendre en compte ses demandes et son projet.
- Appréhender la manière de réagir du patient à sa situation et ses ressources personnelles, sociales, environnementales.
Évaluer :
- les habitudes alimentaires (consultation diététique avec enquête alimentaire si besoin) et l’aptitude à surveiller et à noter son poids ;
- l’activité physique habituelle (questionnaire d’activité physique si besoin) et la capacité à réaliser une activité physique régulière et adaptée ;
- les troubles psychiques (stress, anxiété, troubles du sommeil, dépression), les addictions qui peuvent nécessiter une prise en charge spécifique.
b) Étape 2 : Définir un programme personnalisé d’ETP avec des priorités d’apprentissage
- Formuler avec le patient les compétences à acquérir au regard de son projet et de la stratégie thérapeutique.
- Planifier un programme individuel.
- Les communiquer sans équivoque au patient et aux professionnels de santé impliqués dans la mise en œuvre et le suivi du patient.
c) Étape 3 : Planifier et mettre en œuvre les séances d’ETP individuelle ou collective
- Sélectionner les contenus à proposer lors des séances d’ETP, les méthodes et techniques participatives d’apprentissage.
- Réaliser les séances.
d) Étape 4 : Réaliser une évaluation des compétences acquises et du déroulement du programme
- Faire le point avec le patient sur ce qu’il sait, ce qu’il a compris, ce qu’il sait faire et appliquer, ce qu’il lui reste éventuellement à acquérir, la manière dont il s’adapte à ce qui lui arrive.
- Proposer au patient une nouvelle offre d’ETP qui tient compte des données de cette évaluation et des données du suivi de la maladie chronique.
2) Connaître sa pathologie et ses traitements
Le patient doit acquérir des compétences sur :
- l’insuffisance cardiaque et ses symptômes
- les thérapeutiques prescrites, les effets indésirables possibles du traitement, la planification des examens de routine ou de dépistage de complications éventuelles et les résultats de ces examens
- les traitements à interrompre dans la mesure du possible et les médicaments à éviter (AINS, inhibiteurs calciques)
- l’importance de l’observance thérapeutique.
- Cette information est délivrée par le médecin généraliste et peut être complétée par l’intervention d’autres professionnels (médecin spécialiste, infirmier, autres professionnels de santé).
3) Connaître les médicaments à éviter
Pas d'automédication et Médicaments à éviter :
- Inhibiteurs calciques bradycardisants (vérapamil, diltiazem) ;
- Antiarythmiques de classe I (cibenzoline, disopyramide, flecainide, hydroquinidine, propafenone) ;
- Trastuzumab, inhibiteurs de la tyrosine kinase, monoxidine (forme retard)
- Corticostéroïdes ;
- AINS et coxibs ;
- Lithium et antidépresseurs tricycliques ;
- Glitazones.
4) Connaître les signes de décompensation
Un certain nombre de symptômes sont très évocateurs d'une décompression cardiaque (ou poussée d'une insuffisance cardiaque). Ce sont des signes d'alerte car ils annoncent l'aggravation de l'insuffisance cardiaque. Si on les identifie dès leur apparition, une prise en charge rapide est possible. C'est pourquoi, il est important de bien les connaître.
Ces signes peuvent être :
- Une gêne respiratoire plus marquée : par exemple, vous vous essoufflez lors d'efforts moins importants, vous toussez, vous avez du mal à dormir allongé et êtes obligé de dormir à demi-assis
- Une prise de poids rapide (2-3 kilogrammes en une semaine)
- L'apparition de gonflements (œdèmes) : vos chevilles ou vos jambes enflent et peuvent garder la trace de la pression de votre doigt, votre ceinture vous serre, vos doigts sont gonflés
- Une modification de votre pouls : les battements de votre coeur sont plus rapides ou plus lents, ou sont irréguliers (palpitations)
- La survenue de malaises lorsque vous changez de position
- Une baisse de votre tension artérielle si votre médecin vous a conseillé de la surveiller régulièrement.
5) Règles hygiéno-diététiques
- Restriction sodée modérée 6 g/jour
- Régime méditerranéen en ayant soin d'équilibrer la balance calorique
- Supprimer toute consommation d’alcool
- Sevrage tabagique
- Mesure du poids notée au moins 1-2 fois/semaine chez les patients stables, au moins 2-3 fois/semaine chez les patients en stade III-IV de la NYHA.
a) Régime hyposodé
- Suivre un régime hyposodé signifie des choix qualitatifs et quantitatifs parmi les aliments tout en jouant avec les équivalences en sel selon le goût des patients.
- Éviter une restriction sodée stricte chez la personne âgée, facteur d’hyponatrémie et de dénutrition.
Quelques conseils pratiques :
- Cuisiner sans mettre de sel ;
- Ne pas utiliser la salière à table, et saler à l’assiette les plats les plus fades ;
- Privilégier les préparations « maison », les épices et les herbes aromatiques ;
- Reconnaître les aliments contenants du sel, et ceux qui n’en ont pas.
- Les produits les plus contributeurs au regard des apports en sel sont : le pain, la charcuterie, les fromages, les produits du commerce (soupes, potages, plats cuisinés, tartes, quiches, pizza…), les condiments et sauces, les eaux gazeuses, les fruits de mer, les biscuits apéritifs et graines salées, les conserves.
- Une alimentation cuisinée strictement sans sel, et sans ajout d’aliments salés, contient naturellement 2 grammes de sel.
- Afin de garder le plaisir de manger et de conserver l’appétit, vous pouvez ajouter 4 grammes de sel ou équivalent en aliments salés.
Portions alimentaires usuelles apportant environ 1 gramme de sel :
- 1 pincée de sel = 1 gramme de sel, une cuillère à café de sel = 5 grammes de sel
- 80 g de pain ou 10 biscottes ou 30 g de corn flakes ou 1 croissant ou 100 g de brioche
- 100 g de biscuits type Petit Beurre ou 1 part de gâteau réalisé avec de la levure chimique
- 40 g de fromage
- 1 tranche de jambon blanc ou 50 g de pâté ou 20 g de saucisson sec
b) Patient coronarien
- Conseiller la consommation d’au moins 5 portions de fruits / légumes par jour
- Conseiller la consommation d’huiles riches en polyphénols
- Limiter la consommation d’alcool à 1 à 2 verres par jour, lors des repas
- Conseiller la consommation de poisson à raison de 3 fois par semaine minimum dont 2 fois du poisson gras
- Conseiller la consommation d’aliments riches en ALA : noix, huile de noix, colza..
- Conseiller des aliments ayant un index glycémique bas : légumes secs 2 fois par semaine, fruits 2 à 3 fois par jour, aliments riches en amidon résistant
- Réduire la consommation d’aliments apportant trop d’acides gras saturés : viande de ruminants (bœuf 1 à 2 fois par semaine, mouton-agneau 1 fois par mois), beurre à remplacer par une margarine riche en acides gras oméga 3, fromage 30 à 40 g/jour, charcuterie 70 à 100 g par semaine, œufs 4 à 6 / semaine, éviter les huiles hydrogénées et l’huile de palme (pâtisseries, gâteaux, biscuits, viennoiseries).
6) Alcool et tabac
- En cas de cardiomyopathie dilatée, lorsqu’une consommation excessive a été repérée, l’arrêt total de l’alcool peut dans certains cas s’accompagner d’une régression partielle voire totale de la cardiopathie.
- Ce conseil vaut également pour les autres causes, compte tenu du caractère potentiellement aggravant de l’alcool ; dans ce cas, il est licite de conseiller une réduction de la consommation même si aucune donnée n’existe pour attester de l’efficacité de ces mesures.
- L’arrêt du tabac est impératif chez tous les patients a fortiori s’ils sont atteints d’une cardiopathie ischémique.
7) Activité physique
- L’exercice doit être encouragé en dehors des épisodes de décompensation. Contrairement à ce qui était préconisé il y a quelques années, le repos strict n’est pas souhaitable, car le désentraînement physique progressif (déconditionnement) ne fait qu’aggraver les symptômes à l’effort.
- Assurer la régularité (aide de l’entourage, activité en club, activité d’intérieur).
- Signaler tout symptôme inhabituel (douleur, dyspnée, malaise).
- On conseillera une activité physique d’endurance adaptée aux possibilités et aux choix du patient
- Encourager la pratique d’une activité physique de loisir en endurance (marche, vélo, natation…), équivalente à 30minutes de marche par jour (soit 3 à 4 heures par semaine), d’intensité modérée (en aisance respiratoire, « un peu difficile » sur l’échelle de Borg), éventuellement dans une « fourchette » de fréquence cardiaque.
- Associer un renforcement musculaire (gymnastique, aquagym…) 2 fois par semaine.
- Éviter les efforts statiques trop intenses et les conditions climatiques défavorables (froid, vent).
Les 5 règles à observer pour que l'activité soit efficace :
- Une activité d’une durée suffisante : 30 minutes par séance. Privilégier la durée plutôt que la performance ;
- Une activité régulière : 2 à 3 séances par semaine ;
- Une activité adaptée à chacun : demander conseil à votre médecin avant d’entreprendre une nouvelle activité ;
- Une activité soutenue dans le temps : plus on s’entraine plus on devient performant ;
- Une activité simple à réaliser : il ne s’agit pas que d’un sport, mais d’une activité quotidienne que tout le monde peut faire.
8) Vaccinations
- Selon le calendrier vaccinal ;
- Les infections respiratoires sont des facteurs de décompensation et d’aggravation ;
- Vaccination antigrippale tous les ans ;
- Vaccination antipneumococcique tous les 5 ans.
9) Vie quotidienne
a) Conduite automobile
- L’aptitude à la conduite est subordonnée au risque de survenue de perte de connaissance.
- Le médecin qui émet des réserves sur l’aptitude de son patient à conduire est tenu de respecter le secret médical. Il doit donc essayer de convaincre son patient de faire les démarches auprès de la commission médicale d’aptitude et lui fournir toute pièce utile à la décision.
- L’avis argumenté du service de réadaptation devra clairement apparaître dans le dossier médical et si le patient ne s’y oppose pas, sur le courrier de sortie.
- La consultation des tableaux précisant les aptitudes en fonction des pathologies inscrits dans le Journal Officiel est recommandée avant tout avis.
b) Voyages
- Séjours en altitude : Une condition physique adaptée et un délai minimum de 4 semaines de stabilisation clinique sont requis pour envisager une activité physique au dessus de 1500-2000 m, après évaluation à l’effort négative.
- Séjours en milieu tropical : Il n’y a pas de contre-indication spécifique aux vaccinations.
- Coronaropathie : Première cause des hospitalisations des européens à l’étranger et deuxième cause de décès et de rapatriement sanitaire des français à l’étranger.
Les contre-indications au voyage aérien à respecter chez le coronarien sont :
- angioplastie coronaire ou SCA < 2 semaines / pontage < 3 semaines
- insuffisance cardiaque non stabilisée
- trouble du rythme supra-ventriculaire ou ventriculaire non contrôlé.
- Certaines précautions générales sont recommandées avant un voyage :
- contracter une assurance de rapatriement médicalisé
- avoir une synthèse de son dossier médical traduit en anglais et un tracé ECG de référence
- avoir le nom des médicaments en DCI sur les ordonnances
- avoir une réserve de médicaments en cabine et pour couvrir le voyage
c) Activité sexuelle
- L’activité sexuelle représente un effort physique modéré (2,5 à 3,3 METS)
- Elle ne doit pas être limitée si le patient peut réaliser 60 Watts sur bicyclette ou monter deux étages avec une bonne tolérance.
- Le risque de déclencher un syndrome coronaire aigu à la suite d’une activité sexuelle est peu élevé surtout si le patient pratique une activité physique régulière.
- De nombreux traitements à visée cardiovasculaire ont un retentissement sur la dysfonction érectile. En parler avec les patients permet de les rassurer et d’ajuster de façon individuelle le choix des molécules.
- Ne pas hésiter à travailler en réseau avec l’aide d’autres spécialistes pour éventuellement dépister une autre cause : endocrinienne ou urologique.
- Les inhibiteurs spécifiques de la phosphodiestérase de type 5 (PDE5), donneurs de NO et traitant la dysfonction érectile, ont une bonne tolérance hémodynamique et peuvent être prescrits chez les patients coronariens stables. La seule contre-indication est la co-prescription avec les dérivés nitrés (risque d’hypotension).
d) Vivre avec un DAI
- Progressivement, vous pouvez reprendre normalement et sans crainte vos activités professionnelles, sportives et votre vie sexuelle. Il faut juste veiller à se protéger des coups au niveau de la poitrine et ne pas faire de violents mouvements circulaires du bras.
- Vous pouvez aussi voyager normalement : prévenez simplement votre médecin et la compagnie aérienne et ne passez pas à travers les détecteurs de métaux. Les antivols dans les magasins sont sans danger.
- Faites-vous surveiller régulièrement. Votre cardiologue sait quand il est nécessaire de changer la pile


.png)
Réadaptation cardiovasculaire
Les fondements de la réadaptation cardiovasculaires sont :
- Le réentraînement physique et apprentissage des activités d’entretien physique à poursuivre.
- L’optimisation thérapeutique, qui doit être adaptée à l’état du patient et à son mode de vie. L’éducation thérapeutique spécifique, qui doit être pluridisciplinaire et qui doit donner au patient les moyens d’améliorer son pronostic par des comportements adaptés.
- La réinsertion socioprofessionnelle.
Les bénéfices attendus sont :
- L’amélioration de la tolérance à l’effort
- L’amélioration des symptômes et de la qualité de vie
- La réduction des réhospitalisations pour insuffisance cardiaque et de la mortalité.
A) Indications
La réadaptation cardiovasculaire est indiquée chez tous les patients en classe NYHA II-III, stables sous traitement médical, quelle que soit la FEVG.
Elle est particulièrement adaptée en cas de :
- déconditionnement à l’effort
- problème de réinsertion professionnelle et/ou sociale, d‘adaptation du mode de vie
- présence de plusieurs facteurs de risque cardio-vasculaires, polydéficiences
- suites opératoires de chirurgie cardio-vasculaire.
B) Contre-indications
- insuffisance cardiaque décompensée stade IV NYHA ;
- angor instable ou apparition d’une ischémie à bas niveau d’effort (< METs, < 50 W) ;
- hypertension pulmonaire > 60 mmHg ;
- rétrécissement aortique serré ou myocardiopathie obstructive ;
- troubles du rythme ventriculaire sévères ;
- thrombus mobile intracardiaque, embolie pulmonaire ou phlébite récente.
C) 3 phases
1) Phase 1 (hospitalière)
- Kinésithérapie : mobilisation, kinésithérapie respiratoire, lever précoce.
- Compte tenu de la durée d'hospitalisation de plus en plus courte (2 à 3 jours sauf complications pour les patients atteints d'un syndrome coronarien aigu), l'individualisation de cette phase 1 est, dans la pratique, remise en cause.
2) Phase 2 (post-hospitalière)
En pratique, cette phase s'effectue en centre de réadaptation cardio-vasculaire et en hospitalisation complète ou en hospitalisation de jour.
- Evaluation initiale
- Ré-entraînement à l'effort : l'objectif est d'atteindre une capacité permettant la plupart des efforts de la vie courante sans gêne. Cet objectif varie en fonction de votre âge, de votre capacité fonctionnelle antérieure et de la pathologie cardiaque.
- Optimisation téhrapeutique
- Education thérapeutique, lutte contre les facteurs de risque cardio-vasculaire. : réunions de groupe et/ou entretiens individuels.
- Évaluation des possibilités de reprise du travail et visite de pré-reprise.
3) Phase 3
- Poursuite de l’éducation thérapeutique
- Clubs cœur et Santé : Créés par la Fédération Française de Cardiologie, avec ses associations régionales, dont l’un des objectifs est de favoriser cette phase 3, essentielle dans la réadaptation cardiaque. Activités éducatives, diététiques, permettent aux patients de continuer à modifier dans le bon sens leur hygiène de vie, leurs comportements alimentaires et psychologiques. Trois heures d’activités physiques et sportives par semaine :
Deux arguments plaident en faveur d’une activité physique pratiquée en groupe et encadrée (en clubs) par rapport à celle pratiquée individuellement et à domicile :
- La fidélité : Meilleur taux de participation, après six mois, dans des programmes menés en groupes que lors d'une activité individuelle.
- La sécurité : La pratique en club, encadrée par des cardiologues bénévoles, des kinésithérapeutes, des diplômés Activité Physique Adaptée et Santé, améliore encore cette sécurité.
D) L’évaluation initiale repose sur :
- Une évaluation clinique (interrogatoire et examen physique)
- Un électrocardiogramme de repos
- Une échocardiographie cardiaque transthoracique
- Une évaluation initiale de la performance à l’effort est souhaitable par :
- test de marche de 6 minutes ou test d’effort avec VO2
- évaluation musculaire
- questionnaire d’activité physique pour les personnes âgées (QAPPA).
E) Modalités
- Le plus souvent, initiée en centre spécialisé, notamment au décours d’un épisode de décompensation. Pour les patients les plus sévères, le programme d’entraînement débute en hospitalisation, avant d’envisager une prise en charge ambulatoire. La poursuite de l’entraînement à la sortie est essentielle au maintien du bénéfice obtenu
- L’orientation vers des structures associatives de phase 3 type « clubs cœur et santé » peut améliorer l’observance à l’activité physique au long cours.
- Si la réadaptation est uniquement réalisée à domicile, en l’absence d’équipement spécifique, la combinaison de différentes techniques d’exercices adaptés à l’état du patient est souhaitable.
- La réadaptation cardiaque, ambulatoire ou en centre de réadaptation, comporte toujours un volet d’éducation thérapeutique. Elle peut faciliter une modification des habitudes de vie du patient.
F) Protocoles
Activité physique modérée :
- comportant des exercices d’endurance, de résistance (renforcement musculaire analytique)
- et éventuellement d’amélioration de la capacité respiratoire ;
- si sujets âgés avec risque de chute, exercices d'équilibre ;
- exercices de relaxation.
Une stratification du risque permet une adaptation des exercices avec une plus grande progressivité et une surveillance régulière.
Les types d’exercices possibles sont très variés, adaptables aux goûts, à l’âge et aux aptitudes d’un grand nombre de sujets : marche, course, vélo, natation, gymnastique, activités sportives diverses, utilisation de différents ergomètres ou système de musculation.
Il importe de fixer des objectifs réalistes qui, même imparfaits, seront poursuivis au long cours par le patient.
G) Modalités de l’entraînement physique
- Entraînement en endurance à intensité constante : Effort sous maximal prolongé (20 à 60 minutes) mobilisant des masses musculaires importantes.
- Entraînement en endurance à intensité intermittente : Alternance d’efforts de haute intensité pendant une courte durée avec des phases de récupération active. Phases de haute intensité (80 à 95 % de la puissance maximale aérobie) d’une dizaine de secondes àŁ1 ouł2 minutes et phases de récupération active (20 à 30 % de la puissance maximale aérobie) pendant 1 à 4 minutes.
- Entraînement en résistance dynamique : Réalisé avec de petites haltères, des bracelets lestés, des bandes élastiques. Succession de 8 à 10 types de mouvements différents répétés 10 à 15 fois, de faible intensité (30 à 50 % de la force maximale développée), 2 à 3 séances par semaine d’une durée de 20 à 30 minutes
H) Mise en place d’un programme d’éducation thérapeutique
Délivrance d’informations :
- Connaître la maladie et ses répercussions sur la vie quotidienne, les bénéfices des traitements non pharmacologiques et pharmacologiques sur l’évolution de la maladie
- Connaitre les médicaments à éviter
- Connaître les signes de décompensations, formation à l’autosurveillance du poids, de la pression artérielle et de la fréquence cardiaque.
- Règles hygiéno-diététiques
- Activité physique
- Conseils pour la vie quotidienne
- Aide au sevrage tabagique
I) Prise en charge psychologique
- Dépistage des facteurs de risque psychologiques par des questionnaires spécifiques validés (échelle Hospital Anxiety Depression 14 items, version courte 13 items du Beck Depression Inventory)
- Rôle du psychologue ou du psychiatre consultant : La présence d’un psychologue dans l’équipe de réadaptation cardiovasculaire est hautement souhaitable. Il participe au programme d'éducation thérapeutique, informe les patients sur le rôle des facteurs psychosociaux, les notions de stress perçu, détecte d’éventuels troubles sexuels chez les patients coronariens, rencontre l’entourage.
- Approches non pharmacologiques : Il peut s’agir de groupes de parole de patients complétés par des entretiens individuels, de médiations corporelles (séances de yoga, séances de relaxation…), de techniques d’aide à la gestion du stress.
- Approches pharmacologiques : Dans certains cas, prescription ponctuelle d’hypnotiques, prescpriton d’antidépresseurs en cas de dépression caractérisée associée à un suivi personalisé prolongé.
J) Aide à la réinsertion professionnelle
- Le reconditionnement à l’effort joue un rôle déterminant pour la réinsertion professionnelle, en raison de l’optimisation des capacités à l’effort qu’il entraîne, mais également au plan psychologique par l’image positive de soi qu’il génère.
- L’adéquation entre les capacités fonctionnelles et le poste de travail peut être évaluée par des abaques, tout en connaissant leurs limites.
- Les données de l’épreuve d‘effort peuvent aider à conseiller le patient et son médecin du travail.
- Une évaluation de la pénibilité du poste peut être appréciée lors de séances d’ergonomie, voire en situation réelle par la mesure ambulatoire de la pression artérielle et de la fréquence cardiaque.
K) Évaluer les possibilités de reprise du travail
- La prise Évaluer les possibilités de reprise du travail en charge des accidents cardiaques aigus permet désormais une reprise professionnelle plus fréquente et plus précoce, notamment après un infarctus.
- Les possibilités de reprise de travail doivent être envisagées avec l'assistante sociale, le médecin du travail et éventuellement avec l'organisme de reclassement professionnel.
- La décision d’aménagement voire d’inaptitude au poste de travail, prononcée au final par le médecin du travail, peut être lourde de conséquences pour le patient et ne doit être évoquée qu’en dernier recours.
L) La visite de pré-reprise
- Doit être sollicitée personellement par le salarié pour un arrêt supérieur à trois mois.
- Elle est déterminante pour préparer la réinsertion en organisant une éventuelle adaptation du poste de travail ou un aménagement des horaires.
- Elle accorde au médecin du travail un certain délai pour préparer le retour du salarié, pour faire intervenir les aides extérieures ou organiser les échanges entre les différents acteurs de la réinsertion professionnelle.
ÉVOLUTION/PRONOSTIC
A) Marqueurs de mauvais pronostic


PRÉVENTION
Votre texte ici
SURVEILLANCE
A) Coordination des soins et suivi
1) Coordination des soins
- La prise en charge du patient insuffisant cardiaque nécessite une bonne coordination entre médecin traitant, cardiologue et, le cas échéant, des réseaux de soins, les infirmières libérales, l’équipe hospitalière et les aidants familiaux.
- La coordination est facilitée par l’existence d’un dossier médical partagé à jour, car les professionnels concernés changent au fil du temps.
- Les patients âgés de 75 ans ou plus qui nécessitent une prise en charge par plusieurs acteurs sanitaires et sociaux peuvent bénéficier d’une concertation pluriprofessionnelle et d’une planification du parcours de soins grâce à l’élaboration d’un Plan Personnalisé de Santé (PPS).
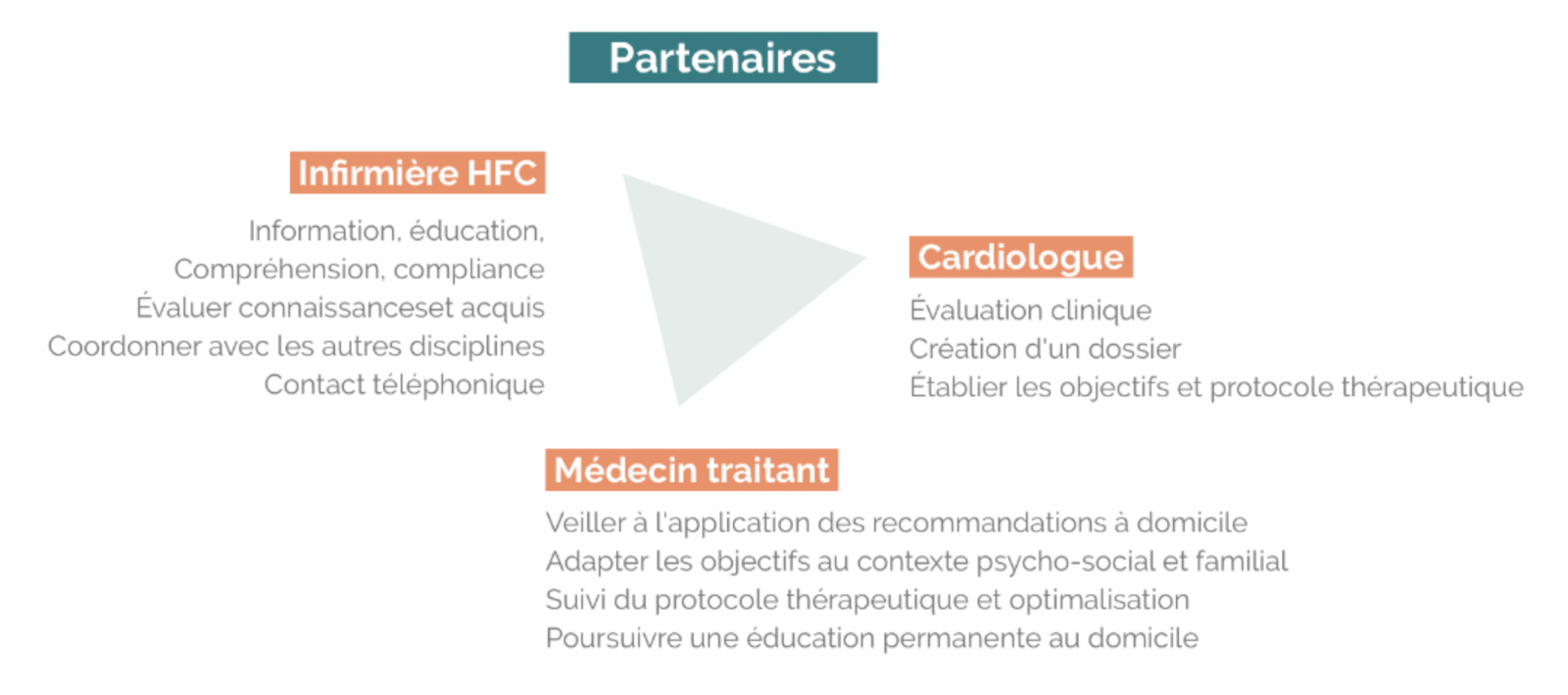
2) Professionnels de santé impliqués dans le parcours de soins
a) Traitement de l'insuffisance cardiaque stable et suivi

.png)

b) Articulation ville-hôpital
Hospitalisation en cardiologie :
- Hospitalisation complète ou en hôpital de jour.
- Directement, par l’intermédiaire du médecin traitant ou du cardiologue.
- Le médecin qui organise l’hospitalisation rédige un courrier à l’intention des professionnels du service qui vont accueillir le patient.
La transmission et le partage d’informations sont essentiels :
- Recueil des données, tenue du dossier médical et transmission d’informations, notamment sur le niveau d’information fournie relative au diagnostic.
- Partage des données de l’évaluation initiale et des évaluations réalisées à intervalle régulier dans le cadre du suivi médical et du suivi éducatif du patient.
- Définition des objectifs de la prise en charge, des interventions et des acteurs impliqués, et adaptation dans le cadre du suivi.
- Repérage des difficultés psychologiques et sociales, et des besoins d’accompagnement.
- Remise au patient hospitalisé d’un document de sortie le jour-même de la sortie contenant toutes les informations nécessaires à la continuité du suivi.
c) Objectifs :
- Les objectifs spécifiques dépendent de l’état du patient, stable ou en phase de décompensation et de ses souhaits : réduire la morbi-mortalité, améliorer les symptômes et l’état de santé, diminuer la fréquence des épisodes de décompensation et des hospitalisations.
d) Rythme du suivi
- La surveillance clinique et paraclinique, le rythme et l’organisation du suivi entre le médecin généraliste, le cardiologue et les autres spécialistes et professionnels de santé dépendront du stade de la maladie, des comorbidités associées et de l’organisation locale.
- Le rythme du suivi dépend principalement des symptômes du patient :

e) Contenu de la surveillance
Evaluation du niveau d’implication du patient dans sa prise en charge :
- observance du traitement
- connaissance des signes d’alerte
- mesure du poids et ses variations
- activité physique
- régime et habitudes alimentaires
- consommation d’alcool, de tabac
- état psychologique
- vie familiale et de la vie sociale.
Observance : Evaluation par questionnaire CNAM
- « Non » à toutes les questions : patient considéré comme un bon observant
- « Oui » une ou deux fois : patient considéré comme non-observant mineur
- « Oui » trois fois ou plus : patient considéré comme non-observant.

Apprécier l’efficacité et la tolérance du traitement :
- Evaluation de la qualité de vie et de la capacité d’effort ;
- Mesure de la PA et de la FC ;
- Recherche de signes congestifs, de signes de bas débit ;
- Recherche des effets secondaires des médicaments prescrits sur le plan clinique et biologique.
Demande des examens biologiques nécessaires au suivi :
- natrémie, kaliémie, à adapter en fonction des résultats antérieurs ;
- créatininémie, albuminémie, urée ;
- hémogramme enzymes hépatiques, en cas d’événement intercurrent ;
- BNP, NT-proBNP en cas de suspicion de décompensation : il est préférable de garder le même peptide natriurétique et le même laboratoire au cours du suivi.
f) Suivi biologique recommandé par l’HAS


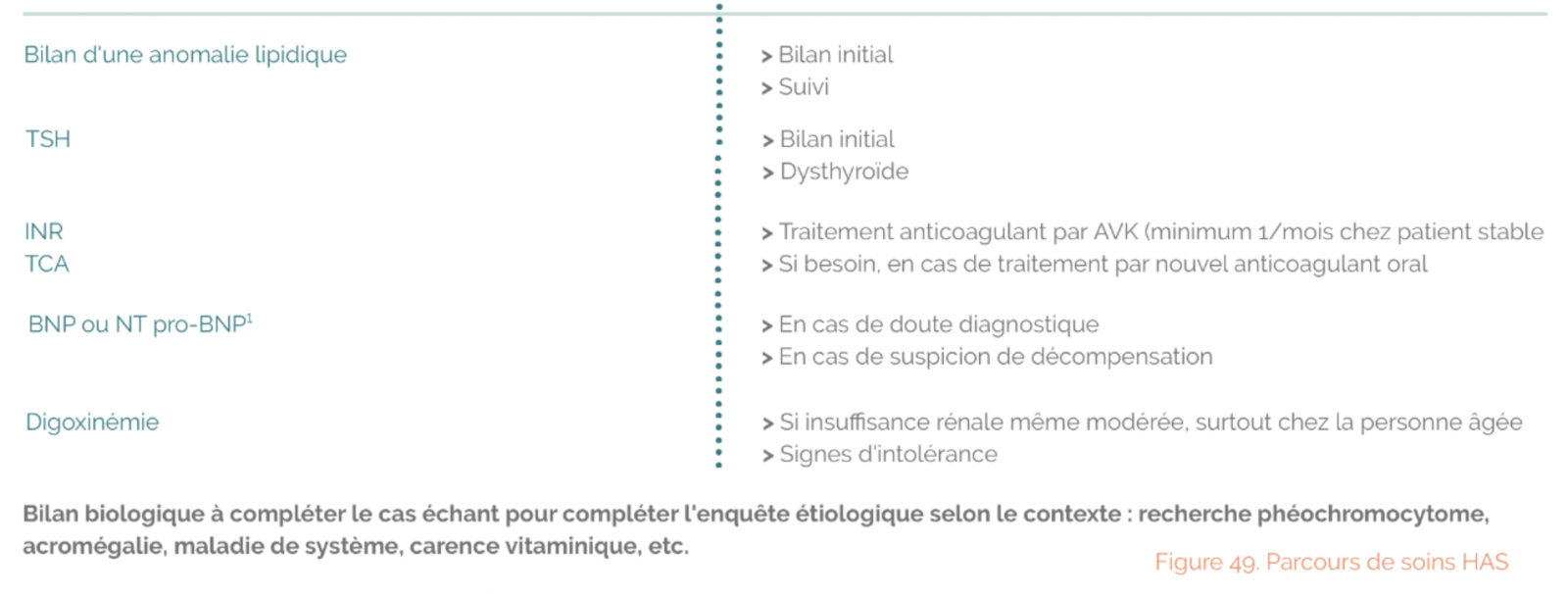
g) Actes de suivi recommandés par l’HAS


h) Signes devant conduire à une consultation médicale
- Modification rapide du poids : Poids mesuré et noté, dans des conditions reproductibles, avec le même pèse-personne. Une perte de poids rapide évoque une déshydratation, favorisée par les diurétiques et la restriction hydrosodée, dans des conditions de chaleur excessive, de fièvre, de diarrhée. Une prise de poids > 2-3 kg en moins d’une semaine évoque une rétention hydrosodée.
- Apparition ou aggravation d’œdèmes.
- Baisse symptomatique de la PA (Voile noir devant les yeux, vertiges, lipothymie au lever)
- Bradycardie < 50/min ou a accélération brutale/arythmie évocatrice de FA
- Aggravation de la dyspnée : la dyspnée est le critère essentiel d’évaluation du retentissement fonctionnel de l’IC. Le patient doit alerter s’il doit dormir assis au fauteuil la nuit ou ajouter des oreillers.
- Toux : la toux peut faire évoquer un sub-œdème pulmonaire, une surinfection bronchique (avec risque de décompensation cardiaque) mais aussi les effets secondaires des IEC.
i) Surveillance infirmière
- Elle peut être prescrite par le médecin traitant pour une durée de 3 mois si besoin à renouveler, sur le formulaire intitulé Prescription de démarche de soins infirmiers (DSI).
- Rôle de surveillance et d’alerte auprès du médecin traitant, en cas d’instabilité clinique, de persistance ou de réapparition de symptômes.
Surveillance clinique hebdomadaire incluant :
- Surveillance PA, poids, œdèmes
- Identification des signes d'alertes
- Suivi des règles hygiéno-diététiques, observance du traitement
- Éducation du patient et de l'entourage, temps d'échanges et d'écoute.
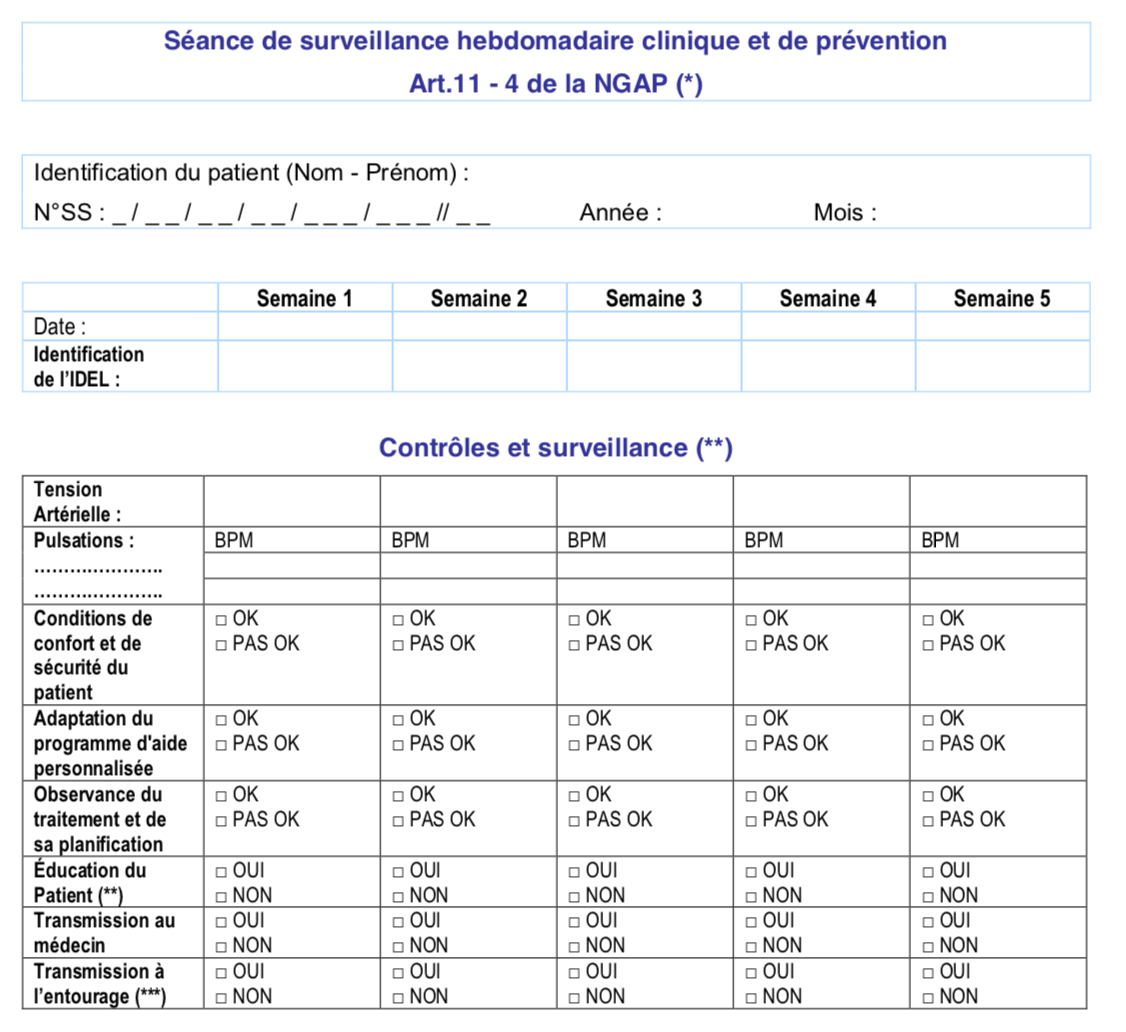
j) Suivi éducatif
Le suivi éducatif intégré ou planifié fait partie du suivi médical :
- Fréquence individualisée, afin d’actualiser le bilan éducatif partagé, de répondre aux besoins du patient et d’accompagner les changements de thérapeutique ;
- Adaptée au niveau de connaissances et aux représentations du patient, au degré de sévérité et à l’évolution de la maladie.
Les objectifs de l’éducation thérapeutique dans le suivi sont les suivants :
- Faire un bilan de ce que le patient a maintenu en termes de connaissances, de gestes, de comportement et actualiser le bilan éducatif ;
- Evaluer les difficultés d’autogestion du traitement par le patient, du vécu de la maladie au quotidien, de ses attentes vis-àvis du médecin et de la médecine ;
- Prévoir ou non d’autres séances éducatives ou interventions de professionnels de santé
Un renforcement des compétences peut être nécessaire en particulier :
- Autosurveillance par le patient et son entourage des symptômes, connaissance des signes d’alerte, et éventuel renforcement thérapeutique prédéfini dans le cadre d’un plan d’action
- Programmation d’une consultation rapide si les symptômes persistent malgré le renforcement thérapeutique.
k) Suivi minimal de l’IC systolique stable 1
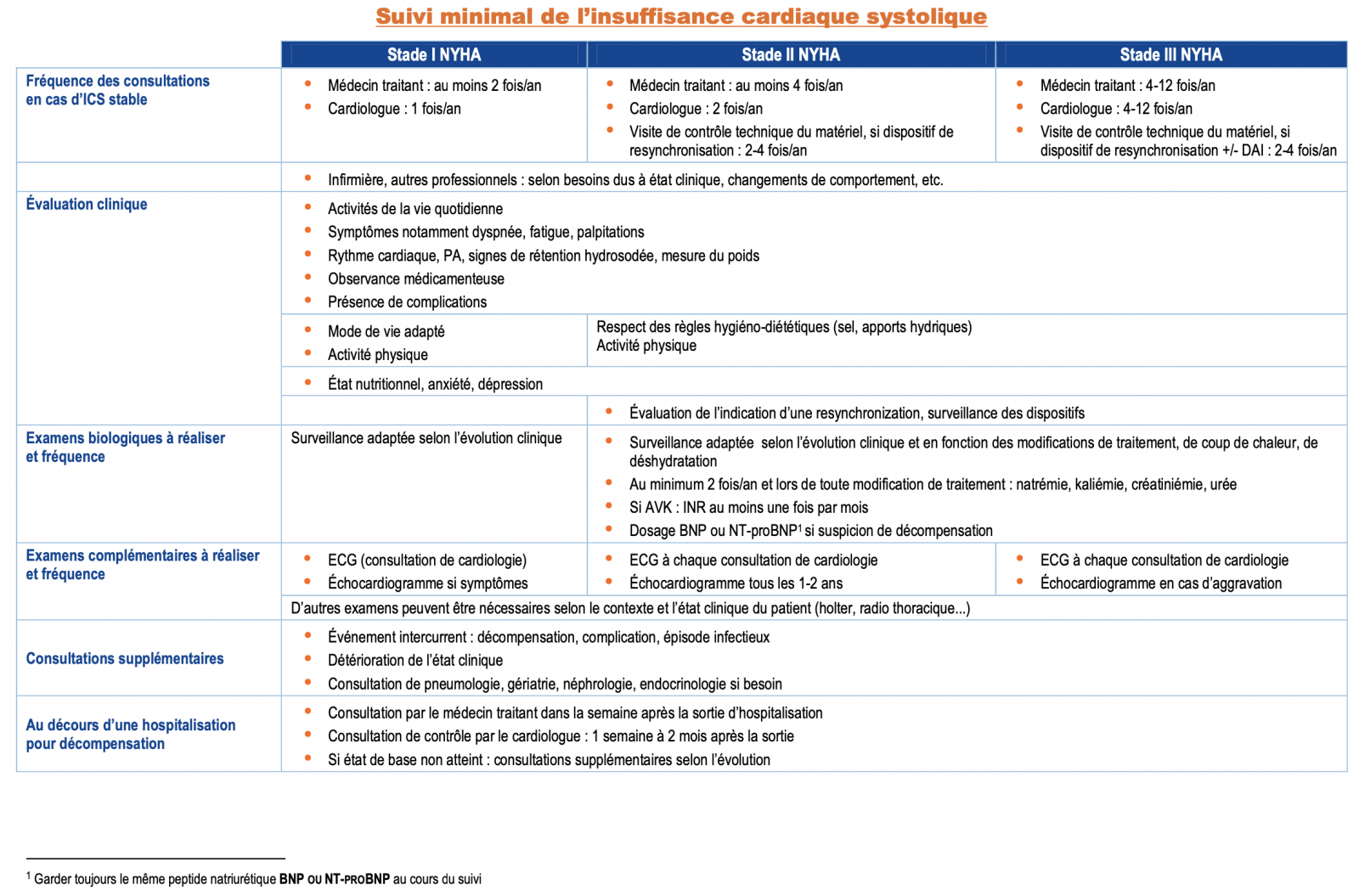
l) Suivi minimal de l’insuffisance cardiaque à fraction d’éjection préservée (ICFEP) 1
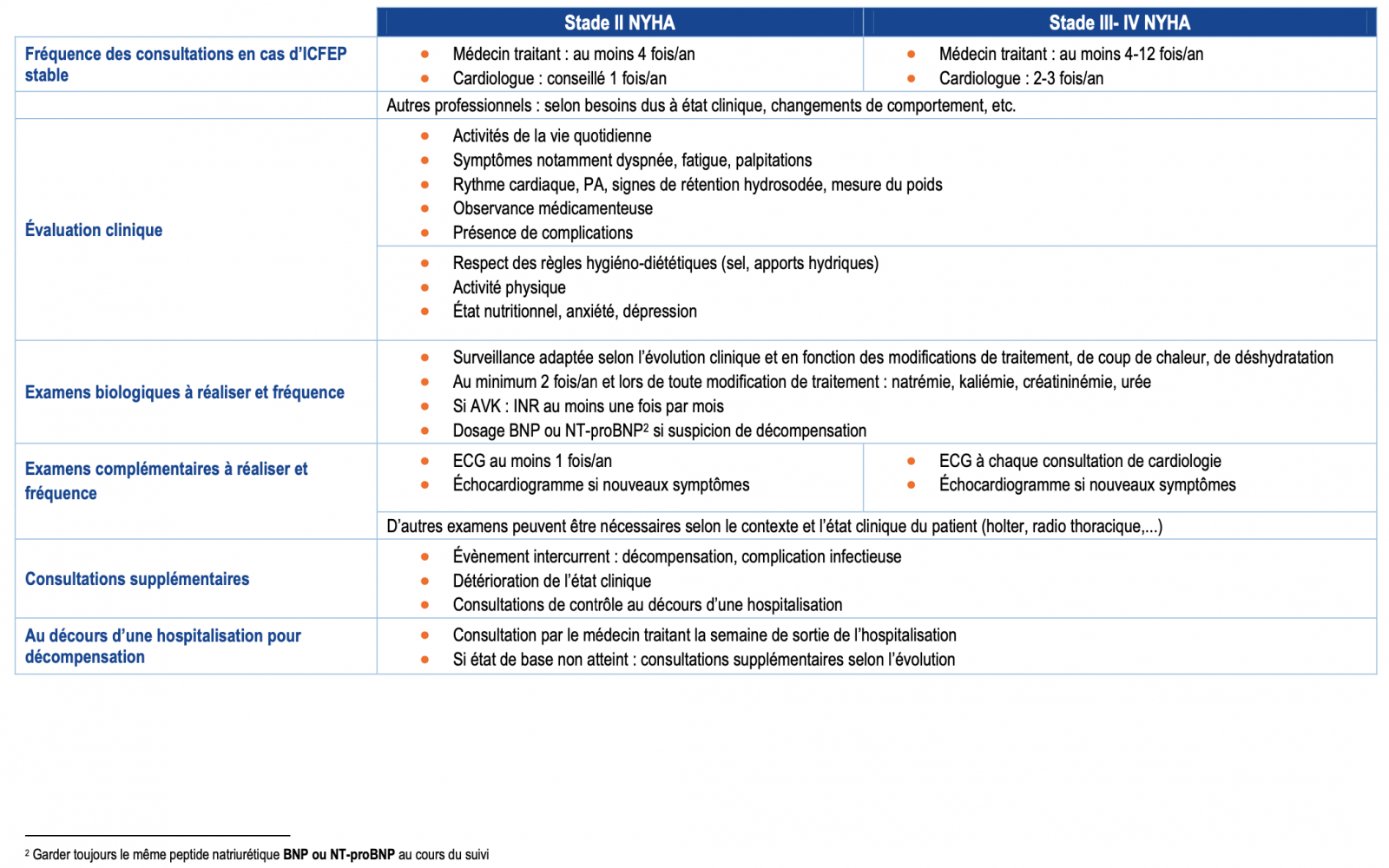
B) Organisation du retour à domicile après hospitalisation pour décompensation
1) Actions visant à réduire le taux de réadmission pour IC
- Impliquer le patient et sa famille.
- Réévaluation précoce dans la semaine qui suit la sortie.
- Collaboration renforcée hopital - mèdecins généralistes.
- Etablir un plan de suivi (biologies, visites,…) et un plan thérapeutique pour l’optimisation du traitement (titration IEC- BB).
- Mettre en place une communication optimale avec le médecin traitant.
- Inclure le patient dans un programme pluri-disciplinaire
2) Sortie d’hospitalisation après décompensation
a) Suivi minimal après une hospitalisation pour décompensation :
- Consultation par le médecin traitant dans la semaine après la sortie d’hospitalisation
- Consultation de contrôle par le cardiologue : 1 semaine à 2 mois après la sortie
b) Information du patient et de son entourage :
- pour comprendre les raisons de la décompensation ;
- pour adhérer à son traitement : médicaments, doses et horaires d’administration ;
- pour prévenir une nouvelle décompensation.
- Contenu et planification de la réadaptation cardiaque.
- L’intervention des services sociaux peut être nécessaire
c) Information du médecin traitant :
- par courrier, avec remise au patient le jour-même de la sortie d’un document de sortie contenant toutes les informations nécessaires à la continuité du suivi ;
- par le compte rendu d’hospitalisation.
d) Mise en place d’une plan d’action écrit, destiné au patient qui comporte :
- le traitement en cours,
- les numéros d’urgence, à contacter en cas de signes d’alerte,
- les propositions d’interventions de professionnels de santé,
- les coordonnées des professionnels concernés, des services sociaux et des associations de patients.
e) Selon l’organisation locale :
- planification des rendez-vous à la sortie, notamment pour titration des IEC-BB ;
- prise en charge par une équipe multiprofessionnelle, notamment pour des séances éducatives, le cas échéant ;
- intervention d’une infirmière formée, le cas échéant, avec courrier spécifique.
- Le médecin traitant vérifie la condition clinique, la cohérence des prescriptions. Il fait le lien avec ce qui était fait, pour permettre au patient de comprendre ce qui est éventuellement changé. Il apprécie alors le besoin d'une consultation cardiologique au décours de l’hospitalisation, selon la clinique ou les plaintes.
3) Programme de retour à domicile
- Le programme de retour à domicile après hospitalisation pour décompensation cardiaque est destiné au patient qui le souhaite dès la sortie d’hospitalisation.
- Il s’appuie sur la prise en charge du patient, en ville, par le médecin traitant en collaboration avec le cardiologue et l’infirmièr(e) libéral(e) formé(e) au suivi de l’insuffisance cardiaque.
- Il peut aussi comprendre, pour les patients qui en ont besoin, un service «d’aide à la vie» (aide ménagère, portage de repas).
- Les visites et consultations dans le cadre de ce programme se déroulent dans le respect du libre choix du patient et s’appuient sur les missions : du médecin traitant qui coordonne l’ensemble des prises en charge nécessaires et de l’infirmièr(e) qui prodigue les soins, contrôle la prise des médicaments et participe à l’éducation du patient.
a) Justification :
- Parmi la population des insuffisants cardiaques, 95 000 ont été hospitalisés pour décompensation cardiaque en 2013 avec des taux élevés de réhospitalisation et de mortalité à moyen terme (source : PMSI 2013).
- Près de 60 % ont été réhospitalisés dans les 6 mois après leur retour à domicile, dont plus de la moitié (62 %) pour une récidive.
- On observe également durant cette période près de 16 % de décès.
- L'analyse des soins remboursés menée à partir des données de l'Assurance Maladie montre que deux tiers de ces patients n’ont pas consulté de cardiologue et 14 % n’ont pas consulté de médecin généraliste dans les 2 mois suivant la sortie d'hôpital.
b) Périodicité des visites et consultations :
- La première consultation du médecin et la première visite de l'infirmièr(e) ont lieu dans les sept jours suivant la sortie d'hospitalisation. À l'issue de sa première consultation, le médecin décide de la périodicité de ses consultations et de la nécessité d'avis cardiologique(s) supplémentaire(s). Il réalise par ailleurs une consultation longue deux mois après le retour à domicile.
- L'infirmièr(e), pour sa part, se rend au domicile du patient une fois par semaine pendant deux mois. Pour les patients en stade III et IV de la NYHA à l'issue des deux mois, elle poursuit ses visites deux fois par mois jusqu'au sixième mois.
c) Contenu des visites et consultation :

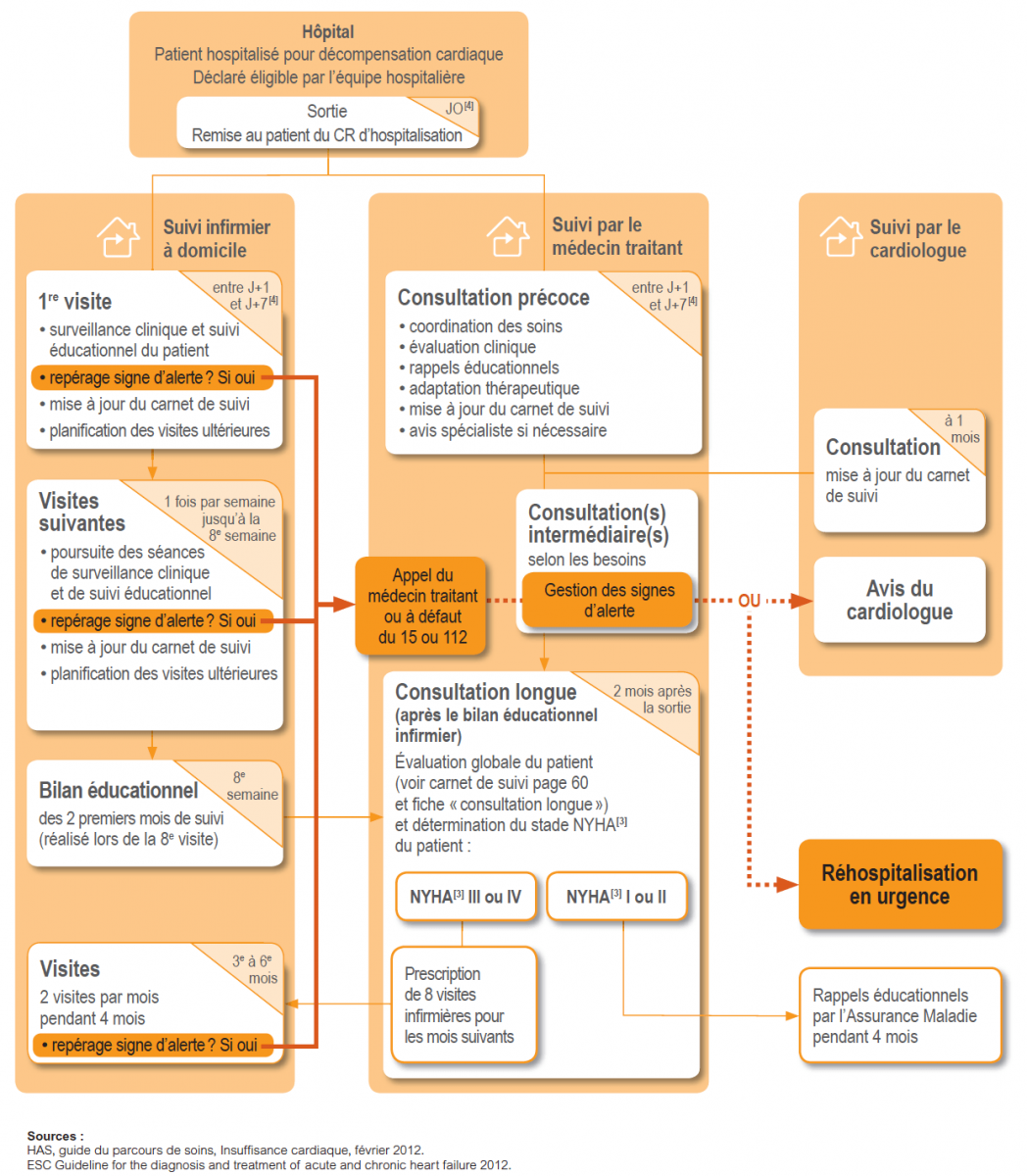
4) Consultation longue
- Une consultation longue est recommandée 2 mois après la sortie, si possible en présence des aidants habituels.
- Objectifs : favoriser le maintien à domicile du patient et limiter le recours à l’hospitalisation et évaluer l’adéquation entre les besoins du patient et des aidants et les moyens de suivi / accompagnement mis en place.
a) Contenu de la consultation longue. Au cours de cette consultation, le médecin traitant :
- évalue le niveau d'information et d'implication du patient ;
- évaluer l'efficacité et la tolérance du traitement ;
- s'assure qu'une consultation cardiologique a été réalisée avant la fin du deuxième mois et juge l'utilité de consultations spécialisées complémentaires ;
- mène toute une action afin d'éviter l'hospitalisation en urgence ;
- vérifie l'adéquation entre les besoins du patient, les aidants naturels et les moyens mis en place ;
- en fonction de ces constats, prescrit pour les patient en stade III et IV de la NYHA la poursuite de la surveillance par l'infirmièr(e) pour les quatre mois suivants (deux séances par mois pendant quatre mois) ;
- notifie les conclusions de cette visite dans le carnet de suivi du patient.
b) Modalités pratiques :
- La consultation longue a lieu à l'issue du deuxième mois après la fin d'hospitalisation, idéalement après les 8 premières séances de suivi et d'éducation de l'infirmièr(e) et après la consultation du cardiologue du premier mois.
- Cette consultation, côtée C+MIC, est réalisée au tarif opposable par les médecins généralistes de secteur 1 et les médecins de secteur 2 signataires du contrat d'accès aux soins.
- Cette visite ne peut être tarifée qu'une seule fois, deux mois après la fin d'hospitalisation du patient pour l'IC.
5) Le programme PRADO
- Le service de retour à domicile Prado a été initié par l'Assurance Maladie en 2010, pour anticiper les besoins du patient et fluidifier le parcours hôpital-ville. Initié sur les sorties de maternité, le service a été étendu aux sorties d'hospitalisation après chirurgie en 2012, après décompensation cardiaque en 2013, et après exacerbation de BPCO en 2015, après accident vasculaire cérébral, et aux personnes âgées de 75 ans et plus quel que soit le motif de leur hospitalisation.
- En 2017, plus de 480 000 patients ont bénéficié de ce service
a) Les principaux enjeux de Prado sont :
- de préserver la qualité de vie et l'autonomie des patients ;
- d'accompagner la diminution des durées de séjour à l'hôpital ;
- de renforcer la qualité de la prise en charge en ville autour du médecin traitant ;
- d'améliorer l'efficience du recours à l'hospitalisation en réservant les structures les plus lourdes aux patients qui en ont le plus besoin.
b) L'offre est composée de 3 volets suivants :
- Initialisation du suivi médical ;
- Accompagnement attentionné ;
- Aide à la vie.
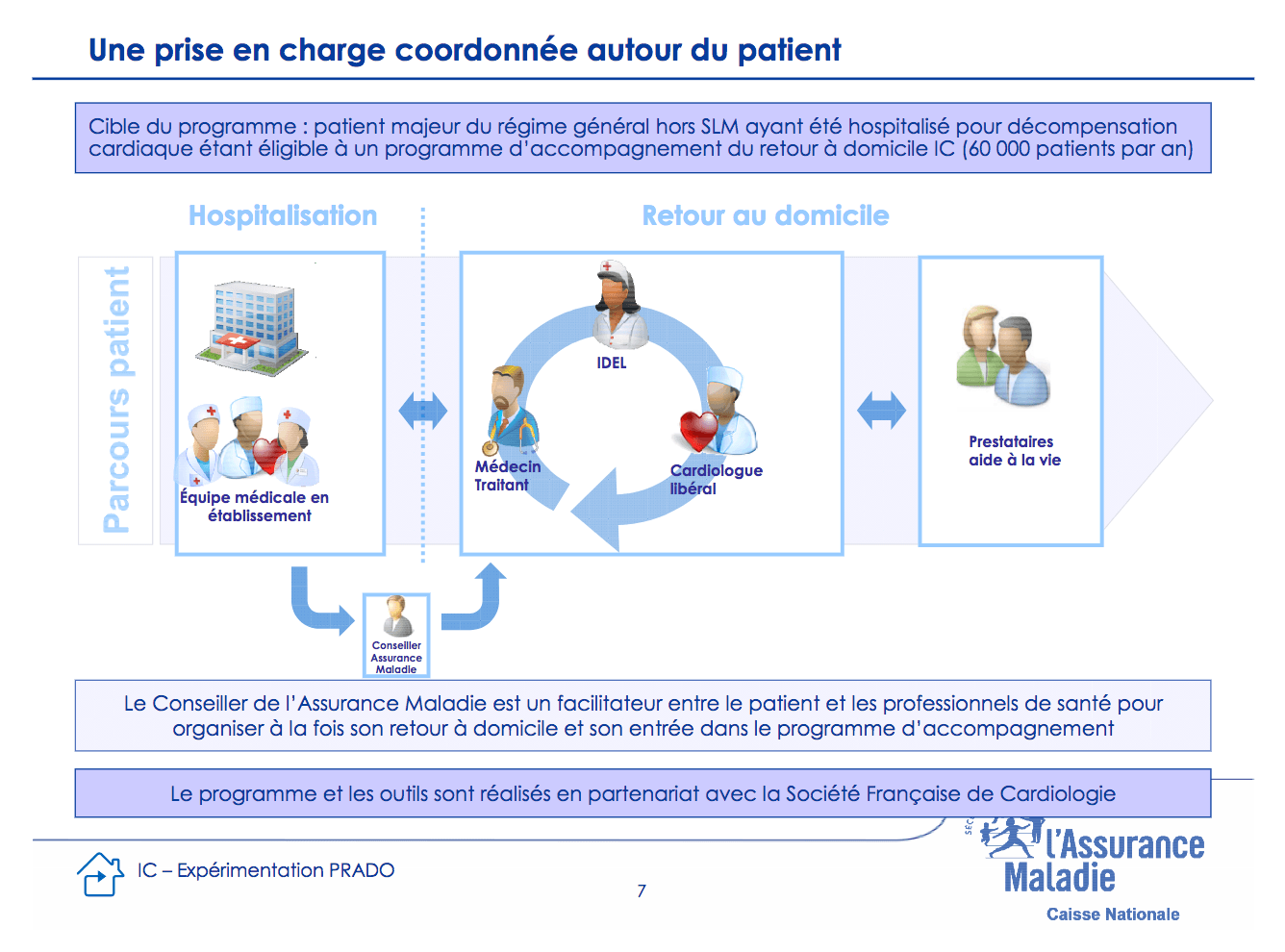
c) Déroulement du service :
Au cours de l'hospitalisation :
- l'équipe hospitalière décide de l'éligibilité médicale du patient au service Prado ;
- le conseiller de l'Assurance Maladie rencontre le patient afin de lui présenter l'offre Prado et de recueillir son adhésion au service ;
- le conseiller de l'Assurance Maladie facilite le retour à domicile du patient en planifiant les premiers rendez-vous avec l'ensemble des professionnels de santé qui le suivront en ville (sur le principe de libre-choix) : médecin traitant, infirmier(ère), cardiologue.
- La durée de l'accompagnement Prado varie selon le stade de sévérité NYHA : un patient en stade NYHA I et II bénéficie d'un accompagnement à domicile d'une durée de 2 mois et de 6 mois pour les stades NYHA III et IV. Le Prado a été élaboré selon le guide du parcours de soins des insuffisants cardiaques de la Haute Autorité de santé en 2013.
d) Ce parcours prévoit :
- une consultation avec le médecin traitant la semaine suivant le retour à domicile et une consultation longue (MIC) dans les 2 mois ;
- une consultation dans le 2e mois avec le cardiologue ;
- une séance hebdomadaire de surveillance et d'éducation par l'infirmier(ère) pendant 2 mois pour tous les patients, puis une séance bimensuelle pendant 4 mois pour les patients en stade III et IV (15 séances au total).
- La fréquence des consultations sera adaptée aux besoins du patient. Cet accompagnement dans la cadre de Prado est complété par la mise en place, si nécessaire, d'une aide à la vie (aide-ménagère et/ou portage de repas).


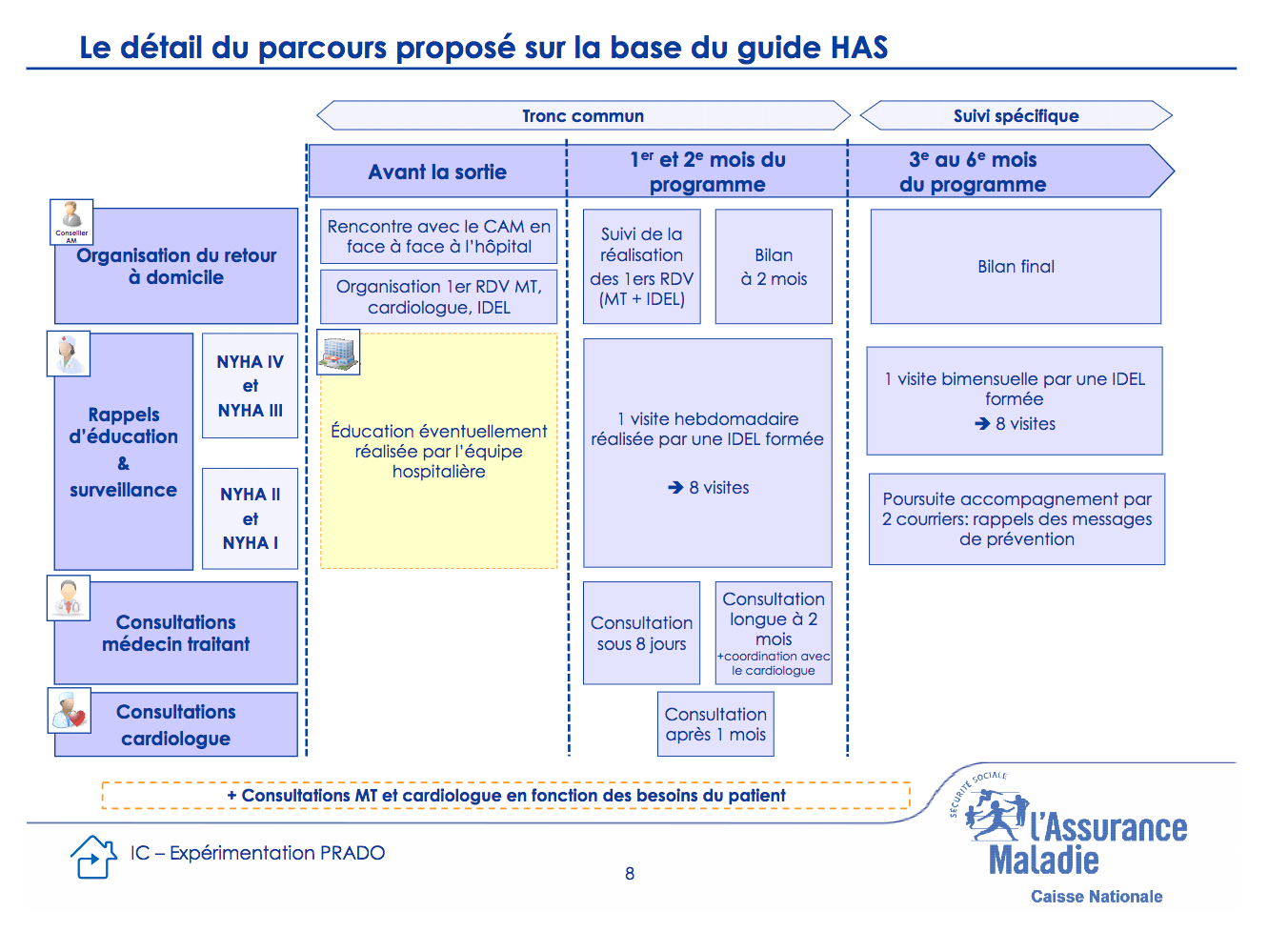
CAS PARTICULIERS
A) Adaptation des traitements, prise en charge des évènements intercurrents
1) Adaptation du traitement par IEC
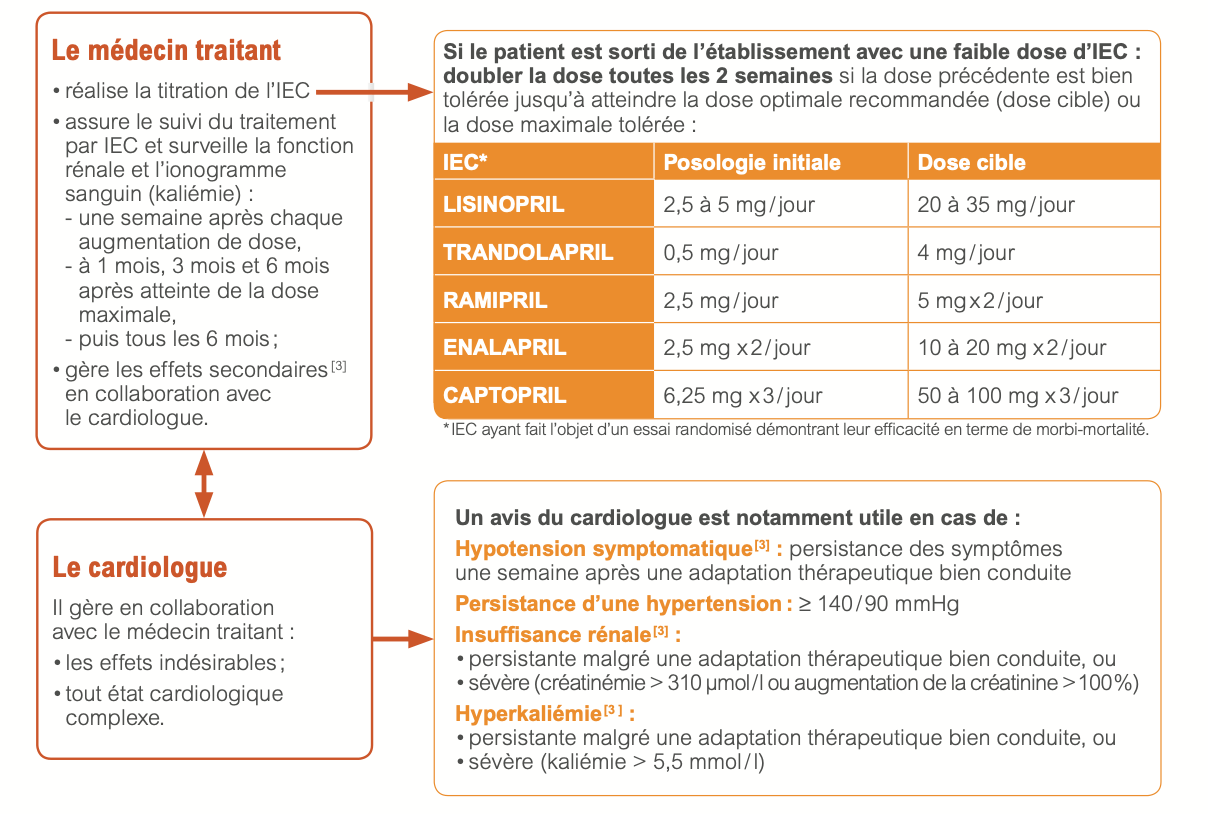
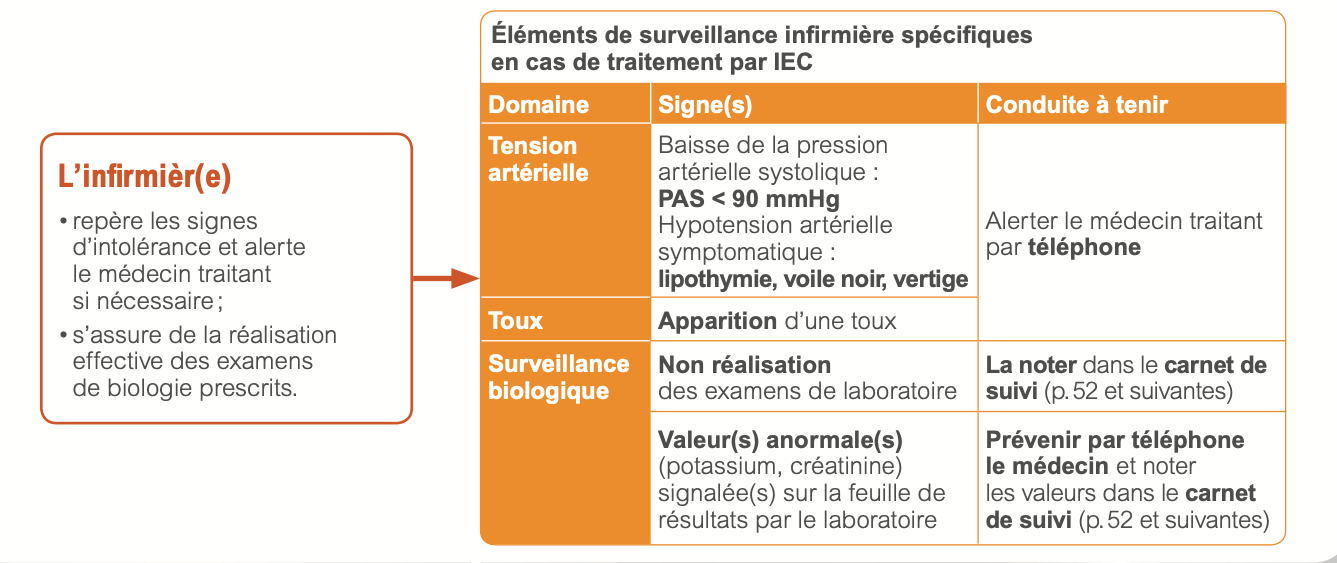
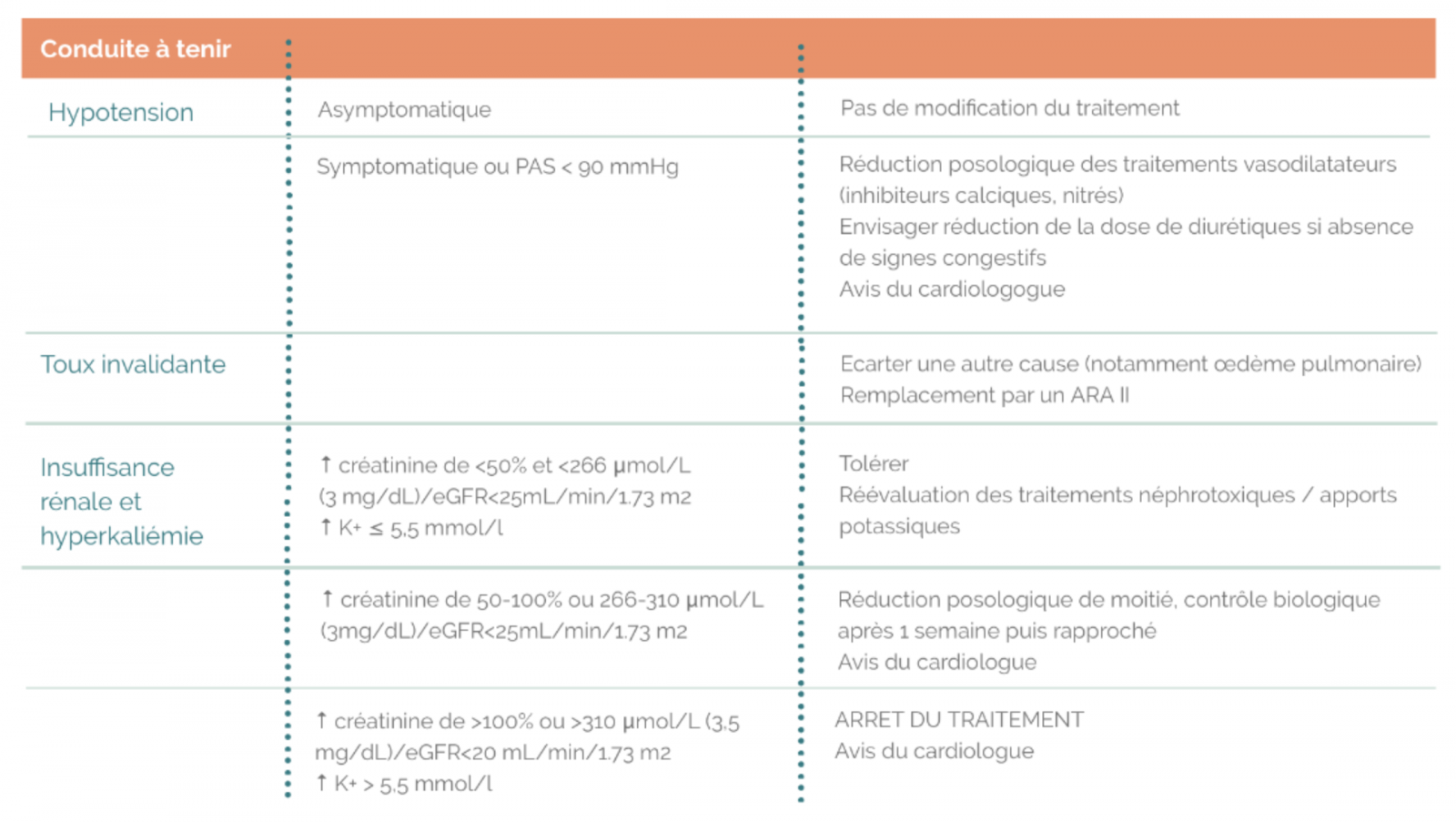
2) Adaptation du traitement par betabloquant

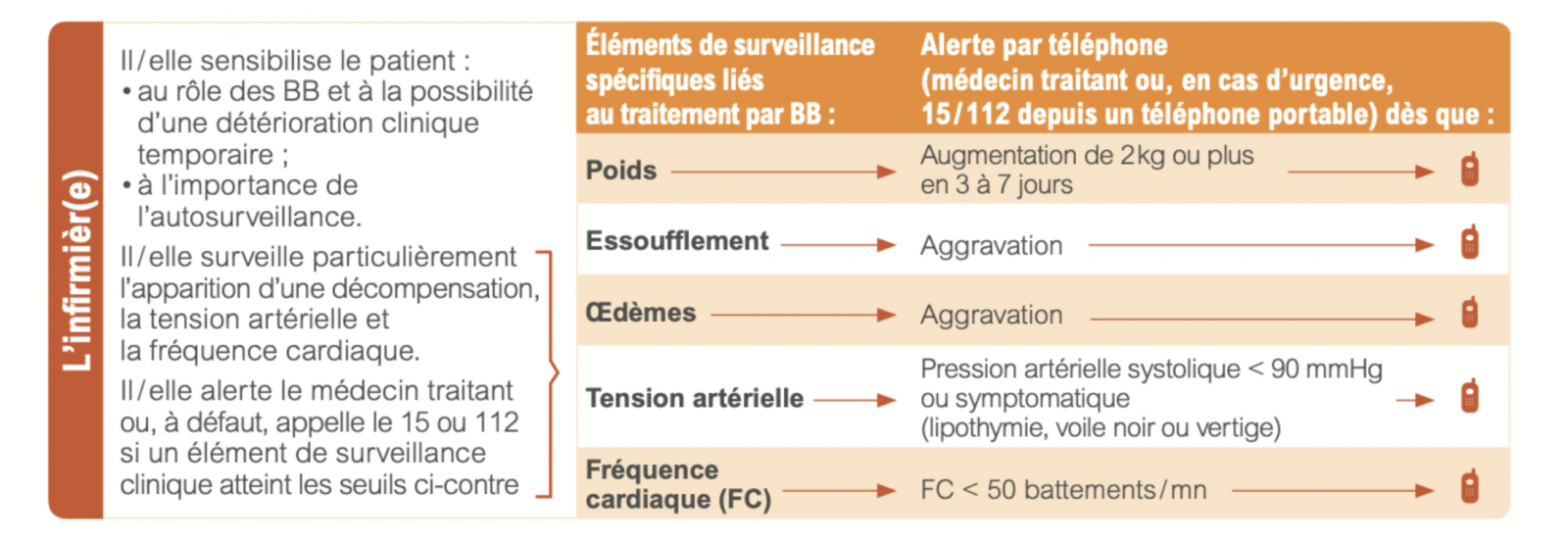
3) Hypotension artérielle sous traitement BB/IEC/ARA II
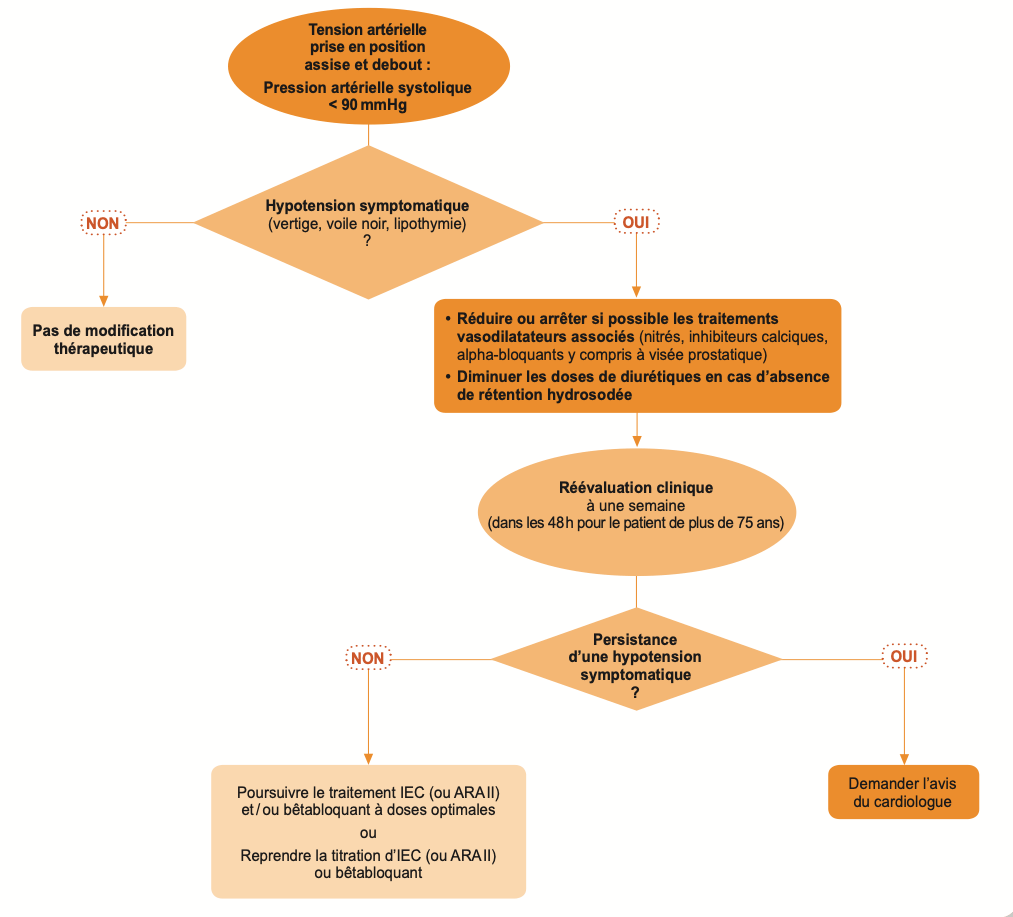
4) Insuffisance rénale sous IEC / ARAII
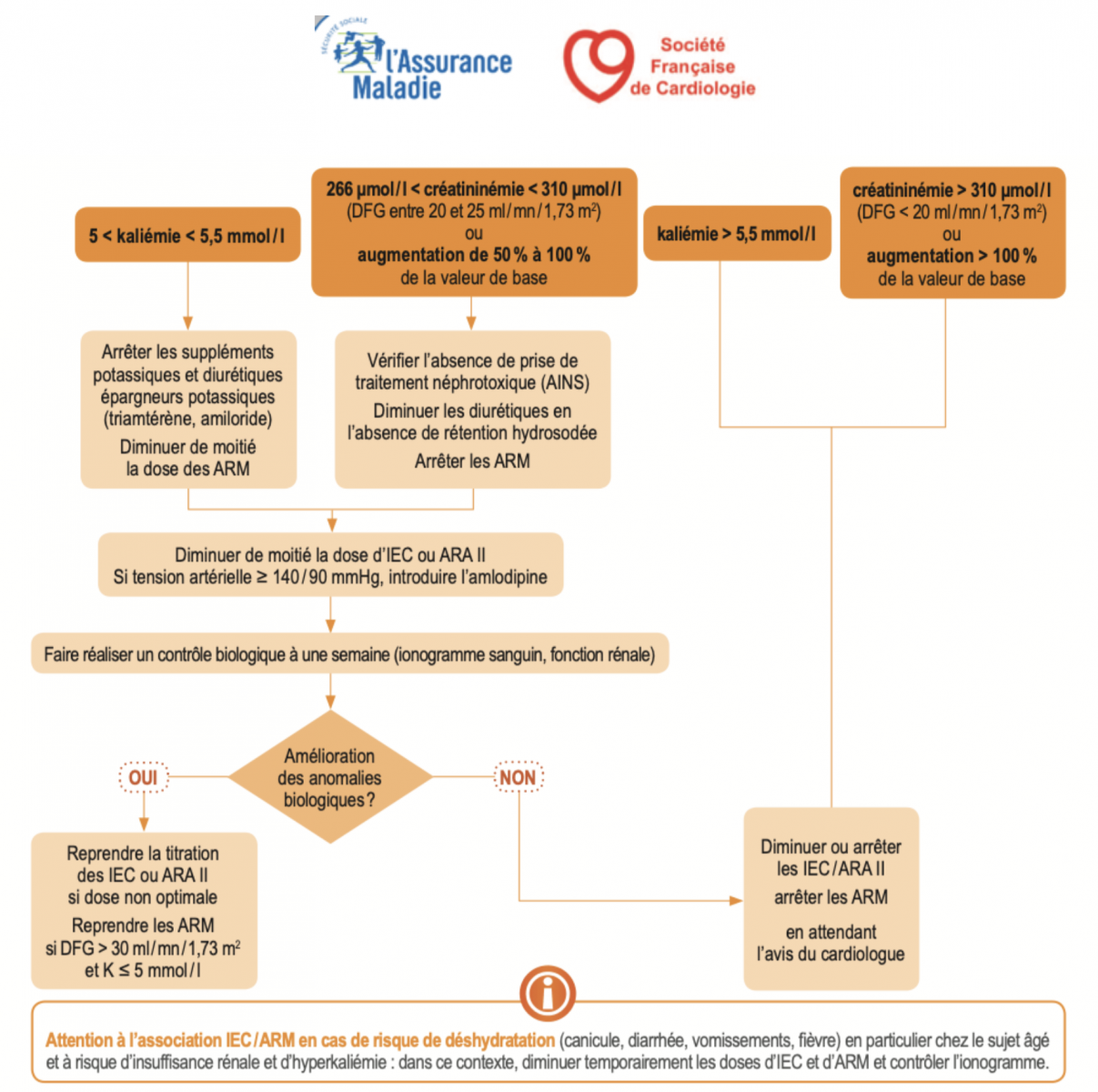
5) Conduite à tenir en cas d’aggravation clinique
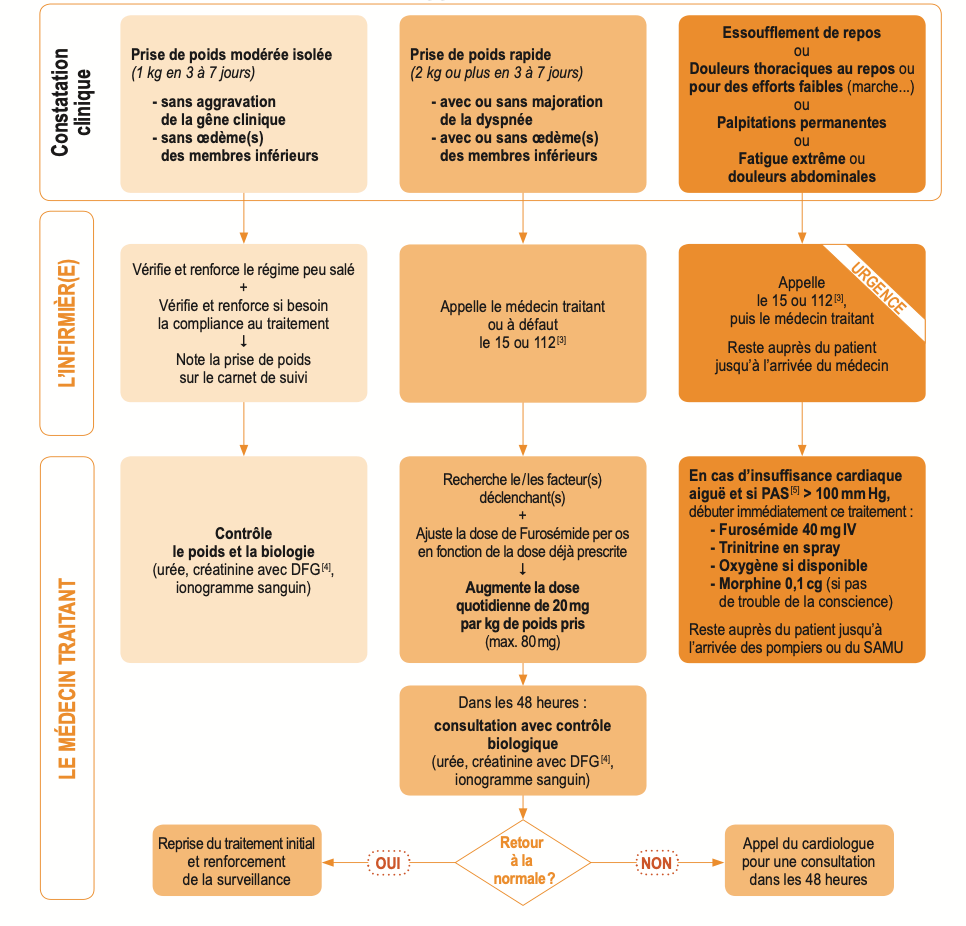
a) critères d’hospitalisation à rechercher
Critères de sévérité clinique :
- augmentation marquée des symptômes (dyspnée) ou dégradation majeure par rapport à l’état de base (cyanose, œdèmes, signes de bas débit).
- exacerbations fréquentes ou épisode récent d’évolution défavorable.
- tachycardie irrégulière (fibrillation atriale).
- bradycardie < 50/min mal tolérée ou BAV de haut degré.
- hypotension artérielle mal tolérée.
Critères de sévérité biologique :
- hyponatrémie sévère, hyperkaliémie menaçante.
- anémie.
- insuffisance rénale d’aggravation progressive.
Comorbidités sévères :
- valvulopathie sévère associée.
- autres pathologies rendant le maintien à domicile impossible.
- patient isolé, aides à domicile insuffisantes.
- angor associé d’apparition récente ou aggravé.
B) Insuffisance cardiaque aiguë (ICA)
- L’ICA correspond au développement rapide ou à l’aggravation des symptômes/signes physiques d’IC.
- C’est une situation grave, qui nécessite une évaluation et un traitement urgent, avec typiquement une hospitalisation en urgence.
- L’ICA peut se présenter comme la première survenue d’une IC (de novo) ou, plus souvent, comme une décompensation aiguë d’une IC chronique.
- Une dysfonction myocardique aiguë (ischémique, inflammatoire ou toxique), une insuffisance valvulaire aiguë ou une tamponnade péricardique sont parmi les causes cardiaques primaires aiguës les plus fréquentes d’ICA.
- La décompensation d’une IC chronique peut survenir sans facteur précipitant connu, mais le plus souvent il y a un ou plusieurs facteurs, tels qu’une infection, une HTA non contrôlée, un trouble du rythme ou une non-compliance aux médicaments et/ou au régime alimentaire.
1) Profils cliniques
- Parmi plusieurs classifications de l’ICA, une classification clinique peut être basée sur l’examen physique de façon à détecter la présence de symptômes/ signes physiques de congestion (état “humide” ou “sec” selon qu’ils sont présents ou absents) et/ou hypoperfusion périphérique (état “froid” ou “chaud” selon qu’ils sont présents ou absents).
- Cette classification peut être utile pour guider le traitement pendant la phase initiale ; elle apporte également des informations pronostiques (gravité en cas de signes d’hypoperfusion périphérique).
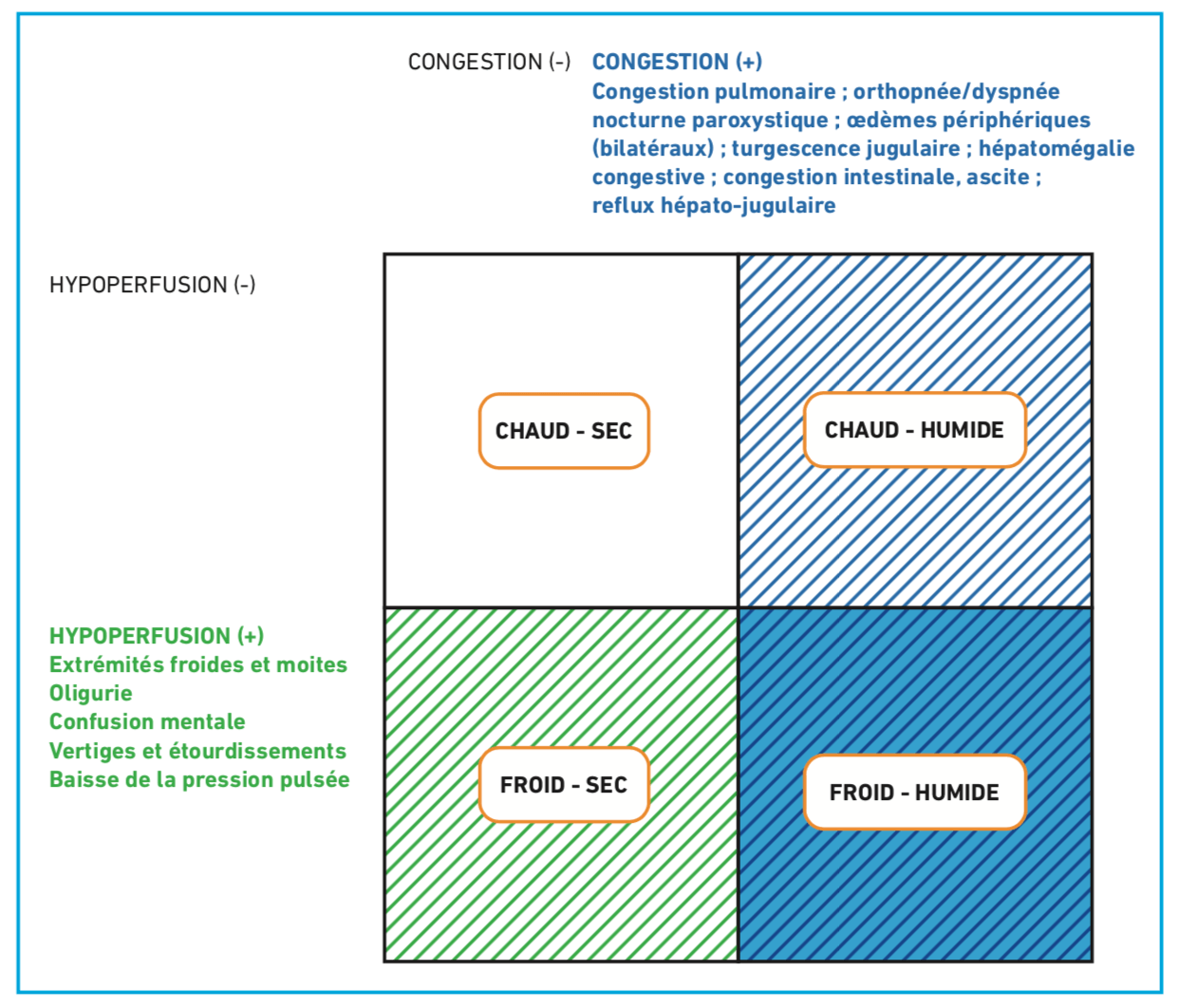
2) Prise en charge diagnostique initiale
- Un diagnostic précoce est important dans l’ICA.
- Un bilan diagnostique doit être mis en œuvre rapidement chez tous les patients qui ont une suspicion d’IC aiguë et un traitement pharmacologique et non pharmacologique approprié doit être commencé dès que possible, parallèlement aux investigations diagnostiques.
- L’évaluation initiale et la surveillance non invasive continue des fonctions cardiorespiratoires vitales du patient, dont l’oxymétrie de pouls, la PA, la fréquence respiratoire et un ECG continu, doivent être institués en quelques minutes afin de vérifier si la ventilation, la perfusion périphérique, l’oxygénation, la FC et la PA sont adéquates. La diurèse doit aussi être évaluée, mais un sondage urinaire n’est pas recommandé en routine.
3) Objectifs du traitement de l’insuffisance cardiaque aiguë
a) Objectifs immédiats (USI / USC / service d'urgences) :
- Améliorer l'hémodynamique et la perfusion des organes.
- Rétablir une oxygénation normale.
- Soulager les symptômes.
- Limiter les atteintes rénale et cardiaque.
- Prévenir les thromboembolies.
- Minimiser la durée du séjour en USI
b) Objectifs intermédiaires pendant l'hospitalisation :
- Identifier les causes et les comorbidités associées.
- Augmenter la dose des traitements afin de contrôler les symptômes et la congestion et d'optimiser la PA.
- Initier et augmenter la dose des traitements pharmacologiques modificateurs de la maladie.
- Chez certains patients, envisager un traitement par dispositif médical.
c) Objectifs avant la sortie de l'hôpital à long terme :
- Élaborer une stratégie de traitement qui inclut un échéancier pour l'augmentation posologique et la surveillance du traitement pharmacologique, une évaluation régulière des éventuels bénéfices d'un traitement par dispositif médical, quand et par qui le patient sera suivi.
- Intégrer le patient dans un programme d'éducation thérapeutique, l'informer sur sa maladie et sur les ajustements de style de vie nécessaires.
- Prévenir une réhospitalisation précoce.
- Améliorer les symptômes, la qualité de vie et la survie.
4) Prise en charge initiale
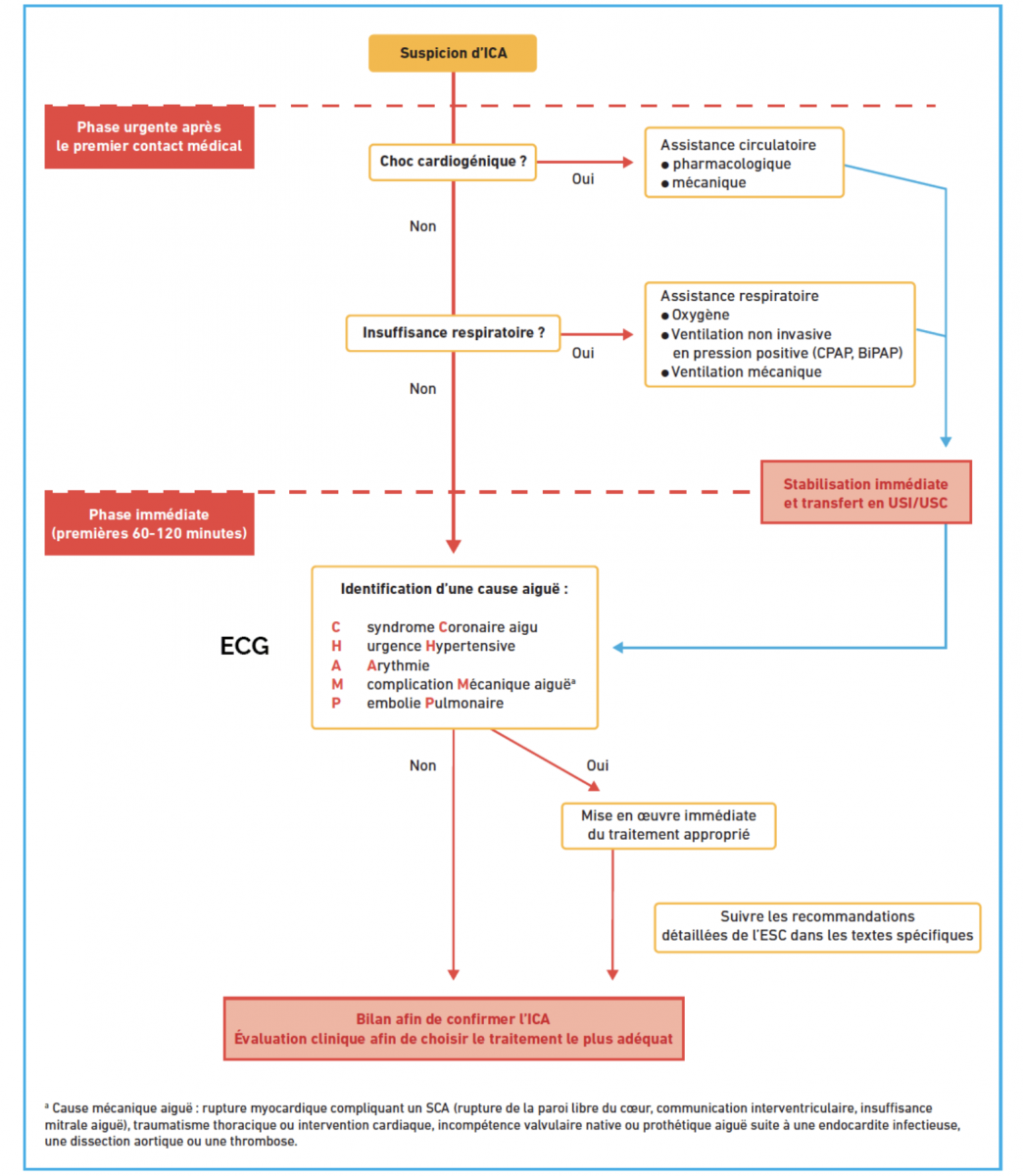
5) Prise en charge diagnostique initiale
- ECG 12 dérivations : En urgence pour éliminer un SCA à très haut risque (revascularisation en urgence) ou un trouble du rythme grave (cardioversion en urgence).
- Radiographie thoracique : Afin d’évaluer les signes de congestion pulmonaire et de dépister d’autres maladies (cardiaques ou non cardiaques) suceptibles de provoquer ou contribuer aux symptômes du patient.
- Bilan sanguin : troponines cardiaques, urée, créatinine, sodium, potassium, glucose, TSH, numération formule sanguine, bilan hépatique.
- Echocardiographie (Cardiopathie, Pressions de remplissage, FeVG, Pressions, Echopulmonaire) : En urgence (Instabilité hémodynamique, Suspicion d'anomalie structurelle ou fonctionnelle aiguë (complications mécaniques d'un IDM, IAo, IM aiguës…)) ou dans les 24-48 heures si ICA de novo ou fonction cardiaque inconnue ou suspect du changement
6) Recherche de facteurs déclenchants
- SCA
- Tachyarythmie (FA, tachycardie ventriculaire…)
- Augmentation excessive de la PA
- Infection (pneumonie, endocardite infectieuse, sepsis…)
- Non-respect des restrictions alimentaires (sel, liquides) ou du traitement médicamenteux
- Bradyarythmie
- Consommation d'alcool et de drogues
- Médicaments 'AINS, corticostéroïdes, substances à éffet inotrope négatif, chimiothérapies cardiotoxiques…)
- Exacerbation d'une BPCO
- Embollie pulmonaire
- Intervention chirurgicale et complications périopératoires
- Hyperactivité sympathique, cardiomyopathie du au stress
- Perturbations métaboliques/hormonales (dysfonction thyroïdienne, acidocétose diabétique, dysfonction surrénalienne, troublés liés à la grossesse et à l'accouchement…)
- Accident vasculaire cérébral
- Cause mécanique aiguë : rupture myocardique compliquant un SCA (rupture de la paroi libre du coeur, communication interentriculaire, insuffisance mitrale aiguë), traumatisme thoracique ou intervention cardiaque, incompétence valvulaire native ou prothétique aiguë suite à une endocardite infectieuse, une dissection aortique ou une thrombose
7) Traitement diurétique
- Les diurétiques de l’anse par voie IV sont recommandés chez tous les patients en ICA qui ont des signes de surcharge liquidienne afin d’améliorer les symptômes.
- Posologie recommandée : Chez les patients qui ne reçoivent pas de traitement diurétique oral : furosémide 20-40 mg (ou équivalent). Pour ceux qui sont déjà sous traitement diurétique oral, la dose IV initiale doit être au moins égale à la dose orale (I, B).
- La dose et la durée doivent être ajustées en fonction des symptômes et de l’état clinique du patient (I, B). Il est recommandé de régulièrement surveiller les symptômes, la diurèse, la fonction rénale et les électrolytes pendant l’utilisation de diurétiques par voie IV (I, C).
- L’association d’un diurétique de l’anse et d’un diurétique thiazidique ou de la spironolactone peut être envisagée chez certains patients en cas d’œdème résistant ou de réponse symptomatique insuffisante (IIb, C).
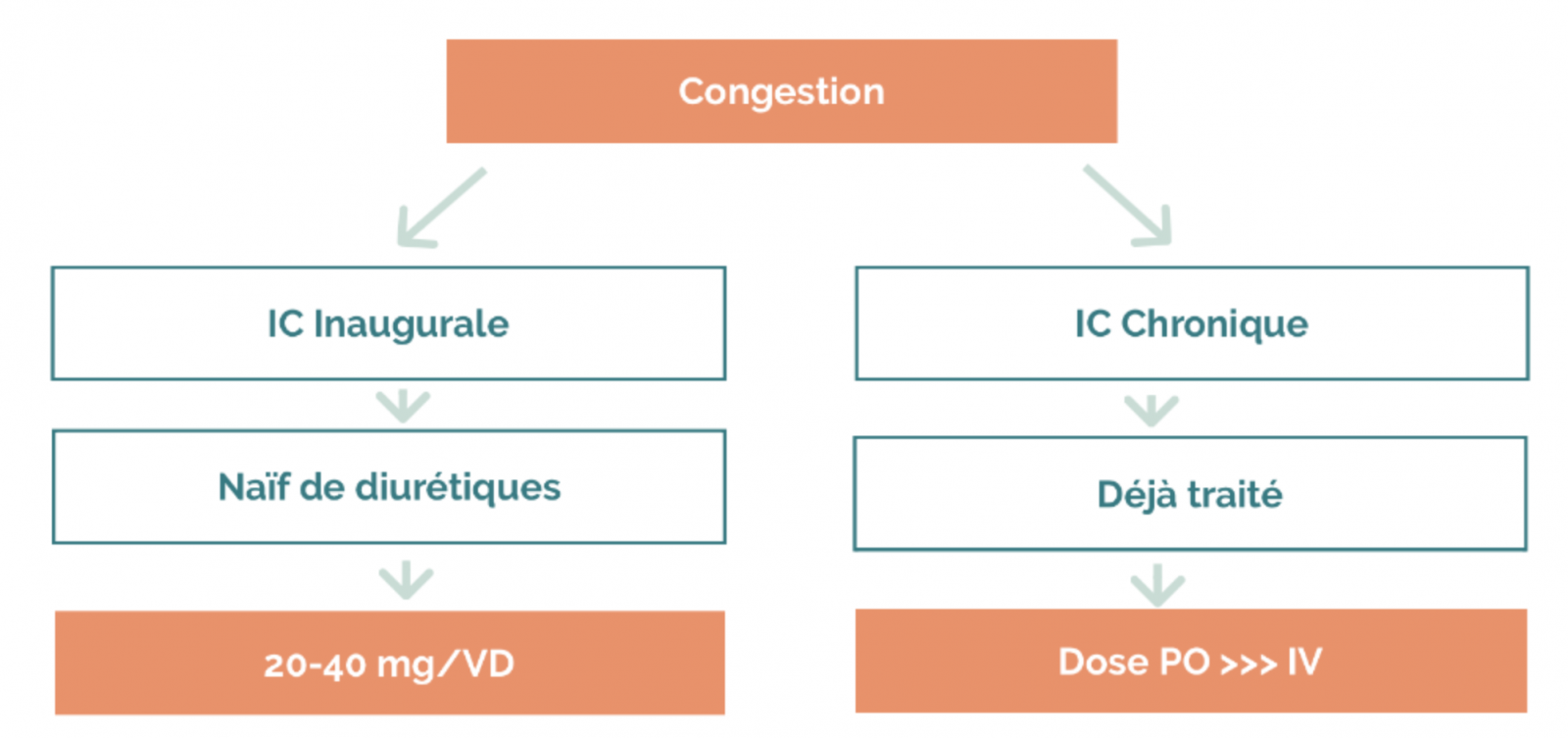
8) Traitement vasodilatateur
- Les vasodilatateurs par voie IV doivent être envisagés pour soulager les symptômes dans les cas d’ICA où la PA systoliqu est > 90 mmHg (en l’absence d’hypotension symptomatique) (IIa, B).
- Chez les patients en ICA hypertensive, les vasodilatateurs par voie IV doivent être envisagés comme traitement initial afin d’améliorer les symptômes et de réduire la congestion (IIa, B).
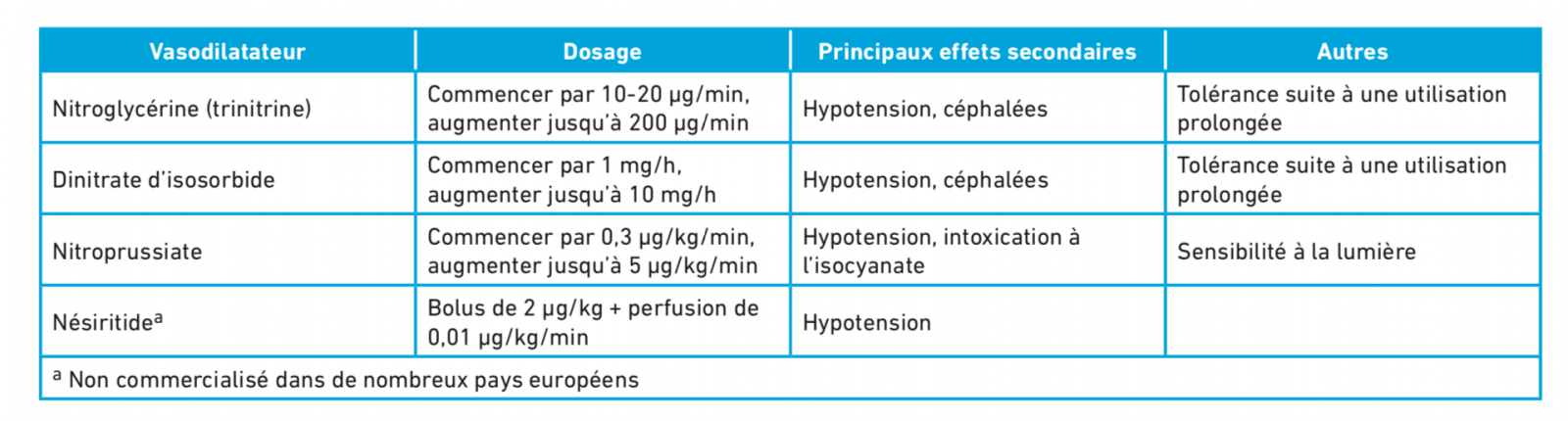
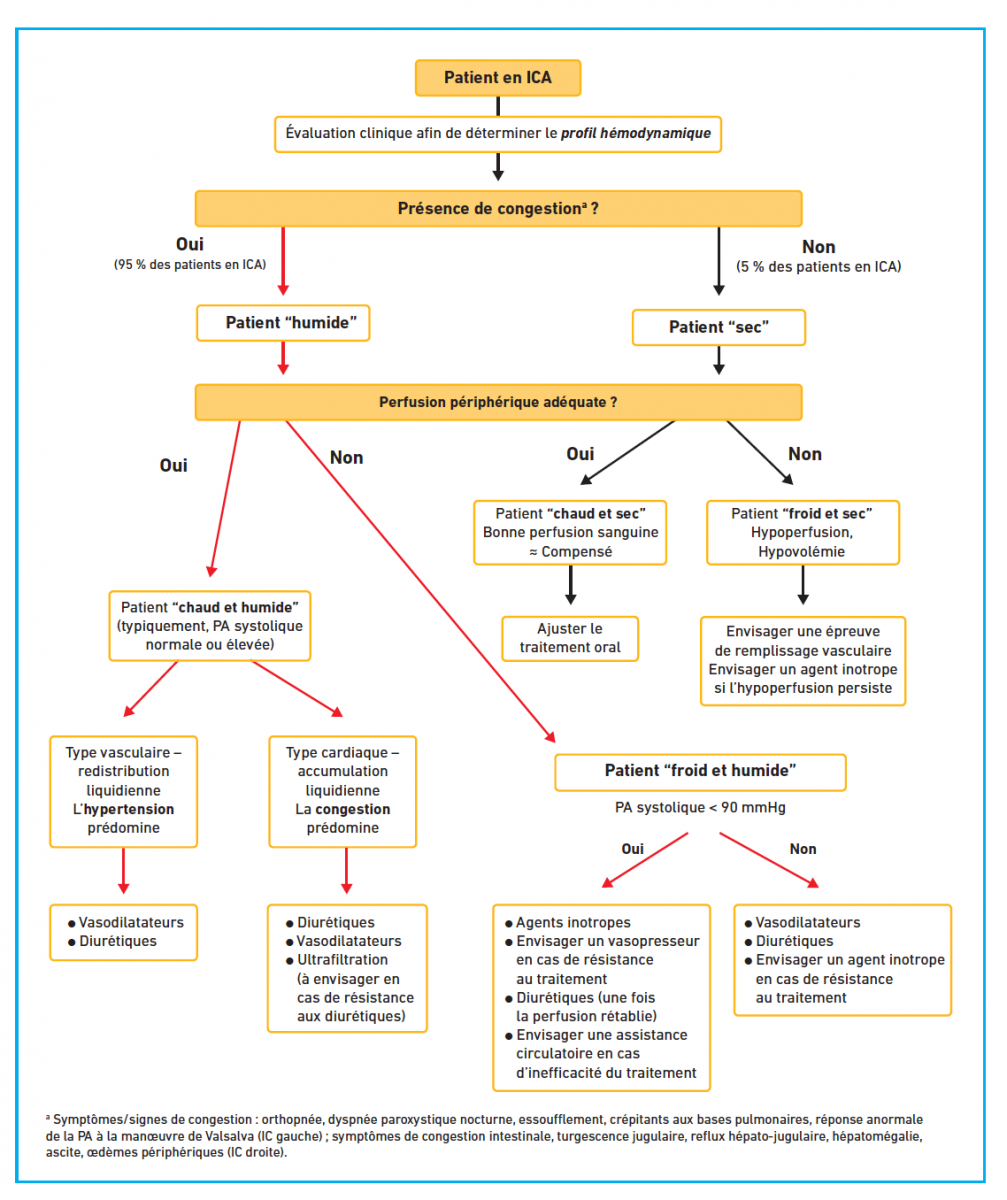
9) Support ventilatoire
- Oxygénothérapie si SpO2 < 90% ou PaO2 < 60 mmHg
- VNI (CIPAP, BIPAP) si signes de détresse respiratoire, acidose respiratoire, BPCO
- Soit CPAP, Peep débutée à 5 et augmentée jusqu’à 10 mmHg si bien tolérée
- Soit VSAI = Bipap (Mode : VSAI + PEP ; FIO2 : selon la SpO2 (objectif spO2 > 92%) ; PEEP : 7 à 10 cm H2O ; AI : 10 à 20 cmH2O, selon FR et VC
10) Agents inotropes et vasopresseurs
- Les agents inotropes: dobutamine, dopamine, lévosimendan, inhibiteurs de la phosphodiestérase III
- L’administration IV d’agents inotropes à court terme peut êtr envisagée chez les patients hypotendus (PA systolique < 90 mmHg) et/ou présentant des signes/symptômes d’hypoperfusion malgré un remplissage liquidien adéquat afin d’augmenter le débit cardiaque, d’augmenter la PA, d’améliorer la perfusion périphérique et d’assurer le fonctionnement des organes (IIb, C).
- L’administration IV de lévosimendan ou d’un inhibiteur de la phosphodiestérase III peut être envisagée afin de contrer l’effet des bêtabloquants, si ceux-ci sont soupçonnés de contribuer à une hypotension avec hypoperfusion subséquente (IIb, C).
- Les agents vasopresseurs (de préférence, la noradrénaline) peuvent être envisagés chez les patients en choc cardiogénique malgré un traitement par un autre agent inotrope, afin d’augmenter la PA et d’améliorer la perfusion des organes vitaux (IIb, B)
11) Assistance circulatoire mécanique
- Les patients qui ont une IC aiguë et qui ne peuvent pas être stabilisés avec un traitement médical peuvent être candidats à une assistance circulatoire mécanique afin de décharger le ventricule défaillant et maintenir une perfusion suffisante des organes.
12) Critères permettant la sortie d’un patient hospitalisé pour ICA
- Le patient est hémodynamiquement stable, euvolémique, reçoit un traitement oral fondé sur des preuves, sa fonction rénale est stable depuis au moins 24 heures.
- Le patient a reçu une éducation et des conseils sur l’auto-prise en charge (“self- care”)
- Les patients qui ont une IC chronique doivent être suivis par un service multiprofessionnel spécialisé dans l’IC.
Les patients sortis après une hospitalisation pour ICA devraient, durant la période de haut risque qui suit :
- être engagés dans un programme de prise en charge de la maladie ; les plans de prise en charge doivent être mis en place avant la sortie et clairement communiqués à l’équipe de soins primaires ;
- être revus par leur médecin généraliste dans la semaine après la sortie ;
- être vus par l’équipe cardiologique hospitalière dans les 2 semaines après la sortie si cela est faisable.
résumé
- 2 à 3% de la population française soit plus d’un million de personnes en France sont atteintes d’une insuffisance cardiaque.
- L’insuffisance cardiaque est un syndrome défini par l’association de symptômes et signes cliniques avec une preuve objective d’une anomalie cardiaque structurelle ou fonctionnelle.
- L’insuffisance cardiaque est classée en fonction du retentissement sur la FEVG : on parle d’insuffisance cardiaque à FEVG préservée lorsque la FEVG est ≥ 50%.
- L’insuffisance cardiaque aiguë est définie comme l’apparition ou l’aggravation rapide de symptômes et de signes d’insuffisance cardiaque.
- La symptomatologie de l’insuffisance cardiaque est liée à l’augmentation de pression «en amont» responsable de signes congestifs, et à la diminution du débit «en aval» responsable de signes d’hypoperfusion.
- Des mécanismes compensateurs cardiaques et extracardiaques visant à maintenir le débit cardiaque sont activés, mais ont un effet délétère sur le long terme et vont constituer la cible des traitements.
- La cardiopathie ischémique représente aujourd’hui la première cause d’insuffisance cardiaque.
- Le diagnostic de cardiomyopathie dilatée ou hypertrophique suppose qu’on ait éliminé une cause ischémique, valvulaire, congénitale ou une HTA.
- L’insuffisance cardiaque présente une symptomatologie variable et peu spécifique.
- La dyspnée d’effort est le signe clinique le plus fréquent mais le moins spécifique, souvent révélateur de la maladie. Le degré d’effort pour lequel apparaît la dyspnée permet de quantifier la tolérance fonctionnelle de la maladie.
- L’examen doit rechercher des signes d’insuffisance cardiaque gauche et d’insuffisance cardiaque droite.
- L’ECG et la radiographie du thorax peuvent être normaux.
- Les peptides natriurétiques BNP et NT-proBNP ont une bonne valeur prédictive négative mais une faible valeur prédictive positive, ils peuvent être élevés dans d’autres pathologies cardiaques ou extracardiaques.
- L’échocardiographie permet la confirmation du diagnostic, la classification de l’insuffisance cardiaque, et l’orientation du bilan étiologique.
- Le bilan paraclinique systématique comprend un bilan biologique sanguin, un ECG, et une radiographie du thorax.
- D’autres examens complémentaires vont permettre de préciser l’étiologie de l’insuffisance cardiaque et de mettre en place un traitement spécifique : coronarographie, IRM cardiaque, cathétérisme cardiaque droit.
- Le traitement médicamenteux de première intention de l’insuffisance cardiaque à FEVG altérée comprend toujours en l’absence de contre-indication : un traitement diurétique à dose minimale efficace, un traitement bétabloquant à dose maximale tolérée, et un traitement inhibiteur de l’enzyme de conversion à dose maximale tolérée.
- En cas de persistance des symptômes, des médicaments de seconde intention pourront être introduits : Antagonistes des récepteurs des minérallocorticoïdes, inhibiteurs de la néprilysine, Ivabradine.
- Une prise en charge étiologique de la cardiopathie sous-jacente sera toujours associée au traitement médicamenteux en fonction de la cause retrouvée (revascularisation, remplacement valvulaire,…).
- L’implantation d’un défibrillateur pourra être indiquée afin de réduire le risque de mort subite par arythmie ventriculaire.
- Un traitement par resynchronisation biventriculaire peut être discutée dans certains cas chez les patients présentant des QRS larges (120 ms) toujours symptomatiques sous traitement médical optimal.
- Le traitement des comorbidités, notamment des autres facteurs de risque cardiovasculaires ainsi que de la carence martiale, est essentiel à la prise en charge optimale du patient insuffisant cardiaque.
- L’éducation thérapeutique est un élément essentiel de la prise en charge du patient insuffisant cardiaque.
- Le patient et son entourage doivent connaitre : La pathologie et ses traitements, les médicaments à éviter, les signes d’alerte.
- Une restriction sodée modérée doit être mise en place et expliquée.
- Une activité physique en endurance est fortement recommandée.
- La réadaptation cardiovasculaire est indiquée chez tous les patients en classe NYHA II-III, stables sous traitement médical, quelle que soit la FEVG.
- Les grands principes et objectifs de la réadaptation cardiovasculaire sont : réentrainement à l’effort, optimisation thérapeutique, poursuite de l’éducation thérapeutique, réinsertion socio-professionnelle.
- Tolérer sous traitement bétabloquant et IEC/ARAII :Une hypotension asymptomatique avec PAS > 90 mmHg, une augmentation modérée de la créatininémie : ↑ créatinine <50% et <266 μmol/L (3 mg/dL)/eGFR<25mL/min/1.73 m2, et ↑ K+ ≤ 5,5 mmol/l.
- Arrêt du traitement IEC/ARA II/ARM en cas d' ↑ créatinine de >100% ou >310 μmol/L (3,5 mg/dL)/eGFR<20 mL/min/1.73 m2 ou ↑ K+ > 5,5 mmol/l.
- Importance de la coordination et du suivi du patient insuffisant cardiaque.
- La fréquence du suivi par le médecin généraliste et le cardiologue dépend du stade de la maladie
- A chaque consultation : recherche de signes d’aggravation, évaluation de la tolérance du traitement clinique (FC, PA) et biologique (ionogramme, créatininémie +++), Adaptation posologique si nécessaire en évitant tant que possible une rétrogradation du traitement, suivi éducationnel.
- Organisation du retour à domicile après un épisode de décompensation : consultation par le médecin traitant dans la semaine après la sortie, consultation de contrôle par le cardiologue : 1 semaine à 2 mois après la sortie, rôle important des programmes de retour à domicile : programme PRADO.
